Introduzione
In Canada, circa 300.000 pazienti, ovvero l’1% della popolazione, sono affetti da artrite reumatoide (RA).1 I progressi del trattamento negli ultimi 20 anni hanno migliorato radicalmente la partecipazione e la qualità di vita dei pazienti con accesso a cure informate sull’evidenza. Questi progressi hanno incluso prove di alta qualità per sostenere l’uso di farmaci antireumatici convenzionali sintetici che modificano la malattia (csDMARD) a combinazioni e soglie di dosaggio ottimali, e lo sviluppo di DMARD biologici, che mirano specificamente ai meccanismi infiammatori della RA.
Il passaggio alla terapia biologica per la RA è una decisione sanitaria costosa per i pazienti, i medici e chi paga. Ottimizzare la dose e il tempo di trattamento con i csDMARD di prima linea consente di risparmiare risorse sanitarie, con una differenza di costi di oltre CaD$15.000 (US$11.460) all’anno, preservando al contempo la scelta clinica di passare alla terapia biologica.2,3,4 L’abilità di passare a un DMARD biologico è fondamentale; tutte le linee guida di pratica clinica per la RA raccomandano un adeguato studio di csDMARD prima di iniziare un farmaco biologico.2,3,4 Nonostante queste raccomandazioni, le prove limitate informano i medici e i responsabili politici sui fattori associati alla ricezione anticipata di un DMARD biologico. Questa limitazione è preoccupante perché sono state osservate ampie variazioni nell’accesso e nei tempi di inizio della terapia biologica in tutte le giurisdizioni sanitarie.5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20
Ci sono diverse sfide per la ricerca in questo settore. La ricerca sull’avvio del primo farmaco biologico è spesso limitata da piccoli campioni non rappresentativi e da brevi periodi di follow-up, riducendo l’interpretabilità e la generalizzabilità dei risultati.21,22 Inoltre, le decisioni dei medici di passare ai DMARD biologici sono spesso influenzate da ragioni non mediche associate alla copertura assicurativa del paziente.8,9 Le variazioni della copertura assicurativa all’interno delle popolazioni di pazienti confondono gli studi clinici e limitano l’attribuzione causale. Inoltre, le caratteristiche dei pazienti, dei prescrittori e delle regioni sono spesso analizzate individualmente invece che simultaneamente, un metodo che non riflette la complessità del processo decisionale del trattamento nelle cure abituali.23,24 Gli obiettivi di questo studio erano di descrivere l’accesso al primo DMARD biologico prescritto in una popolazione di pazienti con RA e identica copertura assicurativa sanitaria completa in Ontario, Canada, e di esplorare le associazioni di pazienti, prescrittori e regione geografica con differenze di tempo alla prima prescrizione di DMARD biologico.
Metodi
Studio Design e impostazione
Abbiamo condotto uno studio di coorte retrospettivo utilizzando database di assistenza sanitaria amministrativa amministrativa basati sulla popolazione deidentificata dell’ICES (precedentemente l’Istituto per le Scienze Cliniche di Valutazione).25 Tutti i residenti dell’Ontario di età pari o superiore ai 65 anni sono coperti dal piano di assicurazione sanitaria dell’Ontario, che comprende le visite mediche, l’uso dell’ospedale per le cure acute e tutte le prescrizioni. L’approvazione del comitato etico della ricerca è stata ricevuta dall’University Health Network, Toronto, Canada, con rinuncia al consenso individuale in conformità con le leggi locali sulla privacy concesse dalla sezione 45 dell’Ontario’s Personal Health Information Privacy Act. Questo rapporto segue la linea guida per il rafforzamento della segnalazione di studi osservazionali in epidemiologia(STROBE) per gli studi di coorte.26
Fonti dei dati
Le fonti di dati includono il database delle persone registrate per i dati demografici dei pazienti, il database delle richieste di rimborso del piano di assicurazione sanitaria dell’Ontario per le visite mediche, il database delle dimissioni per le registrazioni dei ricoveri ospedalieri e il database delle richieste di rimborso dell’Ontario Drug Benefit per la dispensazione di farmaci su prescrizione medica. Le variabili dei prescrittori sono state ottenute dal database dei medici dell’ICES. L’Immigration Refugees and Citizenship Canada Database conteneva informazioni sullo stato dell’immigrazione per il nostro studio.
Criteri di inclusione
I pazienti sono stati inclusi se erano residenti in Ontario con un numero di tessera sanitaria valida e una diagnosi di RA, che è stata identificata utilizzando un algoritmo convalidato. La data dell’incidente della diagnosi di RA è stata determinata come la data in cui sono stati soddisfatti i criteri di fatturazione finale (cioè 3 fatture RA entro 2 anni, con fatturazione ≥1 da parte di uno specialista muscoloscheletrico o ricovero ≥1 per RA).1 Per essere idonei ai modelli analitici, i pazienti dovevano avere una RA all’inizio dell’incidente all’età di 67 anni o più ed essere csDMARD ingenui. Per l’analisi descrittiva non corretta, gli utenti attivi di età superiore ai 65 anni sono stati inclusi dal 2001 al 2015, e i modelli di sopravvivenza non corretta hanno utilizzato pazienti maturati dal 2002 al 2015, con un follow-up massimo fino al 2017.
Periodo di lavaggio
Questa popolazione ha avuto un periodo di studio di 2 anni (cioè, coprendo l’età di 65 e 66 anni) per assicurare la cattura di tutti i csDMARDs e DMARDs biologici di nuova somministrazione dalla diagnosi di RA nell’era biologica (cioè, dopo il 2001). Un ulteriore anno di dilavamento dal 2001 al 2002 è stato utilizzato per rimuovere potenziali pregiudizi dai pazienti che potrebbero essere passati immediatamente ai DMARD biologici quando hanno ricevuto l’approvazione dalle autorità di regolamentazione.
Il tempo di passare al primo DMARD biologico
Per essere idonei all’analisi del tempo dalla prima csDMARD alla prima DMARD biologica, i pazienti dovevano aver ricevuto almeno 1 csDMARD o DMARD biologica con un’indicazione approvata per la RA. Un elenco completo dei farmaci utilizzati in questa analisi è fornito nell’appendice del supplemento. L’inibitore selettivo delle piccole molecole tofacitinib è stato escluso perché meno di 10 pazienti hanno avuto un’esposizione durante la finestra di osservazione.
Finestra di osservazione
La finestra di osservazione dello studio andava dal 2002 al 2015, con una maturazione che terminava nel 2014, garantendo almeno 1 anno completo di follow-up per ogni paziente (eFig. 1 nel Supplemento). I dati sono stati analizzati nel novembre 2017, consentendo una finestra di 2 anni per garantire l’acquisizione di tutti i dati da ogni fonte.
Caratteristiche del paziente
Le variabili demografiche dei pazienti erano l’età, il sesso, la durata della malattia, l’area geografica di residenza, la distanza da chi prescrive ciascun farmaco e la distanza dal reumatologo più vicino. L’uso delle risorse sanitarie è stato reso operativo utilizzando la versione 10 del Johns Hopkins Adjusted Comorbidity Group,27 indice di ruralità (intervallo, 0-100; 0 indica la maggior parte urbana; 100, la maggior parte rurale),28 quintile di reddito del quartiere,29 e indice di emarginazione.30 Il quintile di reddito del quartiere è stato calcolato utilizzando i dati del censimento nazionale per impostare la distribuzione del quintile di reddito con assegnazione geografica basata su aree di diffusione che contengono da 500 a 800 persone ciascuna. L’indice di emarginazione è stato basato anche sulle caratteristiche delle aree di diffusione, concentrandosi su 4 dimensioni che contribuiscono al processo di emarginazione: instabilità residenziale, deprivazione materiale, dipendenza e concentrazione etnica. L’età e il sesso sono stati considerati variabili fisse, con la durata della malattia considerata una variabile variabile variabile nel tempo (conteggio) e l’anno solare considerata una variabile categoriale. Tutte le variabili dei pazienti, ad eccezione dell’età, del sesso e della durata della malattia, erano variabili temporali variabili per anno civile.
Caratteristiche del Prescrittore
Per ogni paziente, le variabili prescrittive sono state assegnate per numero identificativo univoco del medico alla prima nuova dispensazione di prescrizione csDMARD o DMARD biologica e riportate a tutte le successive prescrizioni dello stesso farmaco. Pertanto, le caratteristiche del primo prescrivente di ogni nuovo farmaco RA sono state assegnate per ogni paziente nel modello a tempo variabile. I prescrittori di DMARD biologici (eTable nel supplemento) sono stati resi operativi come medici che avevano prescritto almeno 10 trattamenti biologici durante il periodo di studio. Le caratteristiche dei prescrittori erano l’età, la sede dello studio, le dimensioni dello studio, l’anno di laurea e la specializzazione. La preferenza per la prescrizione di DMARD biologico per ogni medico è stata calcolata dividendo il numero di volte che il medico ha cambiato un paziente biologico-naivale a un DMARD biologico ogni anno per il numero totale di pazienti biologico-naivali in ogni anno. Questa variabile regola le preferenze a livello medico per la prescrizione di un DMARD biologico in un determinato anno, riflettendo al tempo stesso il cambiamento delle preferenze del medico nel tempo.
Caratteristiche regionali
L’accesso ai medici è stato stimato calcolando la distanza lineare dal paziente al prescrivente di ogni farmaco e dal paziente al reumatologo più vicino disponibile. Per regolare simultaneamente l’assistenza reumatologica in relazione alla domanda regionale di reumatologi, abbiamo calcolato l’offerta di reumatologi regolata in base alla quantità,31 una nuova variabile di fornitura del reumatologo. Questa è stata calcolata dividendo il numero annuale di visite reumatologiche in ogni regione per il numero annuale di pazienti con RA che risiedevano in ogni regione. La ruralità e lo stato socioeconomico delle pratiche mediche sono stati misurati utilizzando il punteggio di ruralità28 e il quintile di reddito del quartiere.29 Abbiamo reso operative 14 regioni geografiche utilizzando il Local Health Integration Network, uno stratificatore geografico amministrativo per la fornitura di assistenza sanitaria in Ontario.32 (eFig. 2 nel supplemento).
Risultato, esposizione e definizioni covariate
Il risultato primario per i modelli analitici esplicativi è stata un’analisi dell’intenzionalità del trattamento dal momento della prima prescrizione di csDMARD fino al ricevimento di un DMARD biologico approvato per la RA, con la censura alla morte, la perdita dell’idoneità all’assistenza sanitaria pubblica (cioè, trasferita fuori dall’Ontario), o la fine del follow-up (cioè, il 31 dicembre 2015). Le variabili di esposizione esplicative del modello, compresi i fattori a livello di paziente, di medico e di regione, sono state misurate a intervalli annuali, con i farmaci registrati in ogni farmacia di dispensazione e le caratteristiche demografiche del medico aggiornate ogni 90 giorni.
Dati mancanti
Non mancavano variabili caratteristiche del paziente o variabili di prescrizione dei farmaci; tuttavia, su 385 su 612 variabili caratteristiche del medico (4,8%), 18 su 571 mancavano a causa dell’omissione della farmacia. Alle osservazioni in cui mancava il valore del numero di identificazione del prescrittore è stato assegnato il numero di identificazione della prescrizione identica più vicina nel tempo per il paziente.
Analisi statistica
Per illustrare l’associazione non corretta della regione con la ricezione del primo DMARD biologico, sono state calcolate le curve Kaplan-Meier stratificate per regione. Il tempo trascorso tra la prima prescrizione di csDMARD e la prima prescrizione di DMARD biologico è stato il risultato di modelli di pericolo proporzionali di Cox a effetti misti, con effetti casuali per regione e medico annidati all’interno di regioni33 (eTabella nel supplemento). Questa scelta del modello annidato riflette la cura abituale; ai pazienti vengono prescritti farmaci da medici che praticano all’interno delle regioni. Le covariate dipendenti dal tempo sono state misurate in base alle covariate del primo prescrittore del csDMARD o DMARD biologico e alle caratteristiche del paziente al momento della prescrizione. I modelli hanno anche accomodato gli effetti casuali incrociati; i pazienti potevano cambiare medico e i medici potevano spostare le sedi di pratica. Pertanto, sebbene i modelli fossero annidati, i modelli erano flessibili per tener conto del fatto che i pazienti cambiavano medico o si spostavano da una regione all’altra, il che rifletteva la realtà delle cure cliniche abituali. Per adeguarsi al cambiamento del numero di farmaci biologici disponibili nel tempo e ai fattori specifici dell’anno, al modello è stata aggiunta una variabile categorica per l’anno solare.
I risultati sono stati misurati a livello del paziente e riportati come rapporti di rischio (HR) con il 95% di IC e valori di P. Abbiamo utilizzato il P a 2-coda P<0,05 come soglia per la significatività statistica. Dalla prima prescrizione csDMARD, le prescrizioni del paziente sono state suddivise in una sequenza di intervalli basati sul farmaco prescritto, in modo da adattarsi al variare del tempo del paziente, del prescrittore e delle covariate regionali. Alla fine del periodo di follow-up, ogni paziente è stato censurato o aveva ricevuto un DMARD biologico, il che significa che le tendenze nella preferenza del medico per l’uso biologico sono stati esplicitamente misurati. Un modello semplice che mostra l’associazione non corretta dell’esposizione con il risultato è stato confrontato con un modello completo, regolando per tutte le variabili del modello semplice così come gli effetti casuali, per calcolare l’associazione della variazione del medico con il tempo di ricezione del primo DMARD biologico. Tutte le analisi sono state eseguite utilizzando il software statistico R versione 3.1.2 (R Project for Statistical Computing).34
Risultati
Un totale di 17-672 pazienti hanno soddisfatto i criteri di inclusione dello studio, maturando 82-445 anni di follow-up (Tabella).35 Un totale di 719 pazienti (4,1%) hanno ricevuto una prima prescrizione biologica durante lo studio.
| Caratteristica | Covariate di basea | Modello Cox completamente regolato | |||
|---|---|---|---|---|---|
| Media (SD) | Mediana (IQR) [Gamma] | HR (95% CI) | SE | P Valore | |
| Caratteristiche per 17-672 pazienti | |||||
| Uomini, n. (%) | 6074 (34.4) | NA | 0.76 (0.66-0.89) | 0.08 | <.001 |
| Età, per ogni aumento di 5 anni, y | 75.2 (5.8) | 74 (70-79) [67-99] | 0.66 (0.62-0.71) | 0.01 | <.001 |
| Distanza lineare dal prescrittore, per ogni 10 km di aumento, km | 125.50 (304.37) | 11.60 (4.37-53.62) [0-3016] | 1.01 (1.00-1.02) | 0.01 | <.001 |
| Distanza lineare dal reumatologo più vicino, per ogni 10 km di aumento, km | 129.40 (309.15) | 11.99 (4.44-56.39) [0-3016] | 0.99 (0.98-0.99) | 0.01 | <.001 |
| Anno civile, per ogni aumento di 5 anni | 2009 (3.91) | 2009 (2006-2013) [2002-2015] | 0.49 (0.43-0.55) | 0.01 | <.001 |
| Indice di ruralità, per 20 unità di incremento | 11.86 (18.51) | 2 (0-20) [0-100.00] | 1.09 (0.99-1.05) | 0.05 | .06 |
| Durata della malattia, per ogni aumento di 5 anni | NA | NA | 1.35 (1.19-1.54) | 0.01 | <.001 |
| Indice di marginalità, per unità di incremento | 3.12 (0.78) | 3.00 (2.50-3.75) [1-5] | 0.99 (0.87-1.11) | 0.06 | .81 |
| Quintili di reddito di quartiere | 3.06 (1.39) | 3.00 (2.00-4.00) [1.00-5.00] | 0.92 (0.65-1.31) | 0.03 | .16 |
| 1 | NA | NA | 0.92 (0.65-1.31) | 0.03 | .16 |
| 2 | NA | NA | 1.07 (0.83-1.37) | 0.28 | .14 |
| 3 | NA | NA | 1.19 (0.91-1.55) | 0.33 | .16 |
| 4 | NA | NA | 1.07 (0.81-1.42) | 0.31 | .16 |
| 5 | NA | NA | 1.27 (0.95-1.71) | 0.39 | .19 |
| Immigrato, n. (%)b | 1131 (6.40) | NA | 0.59 (0.42-0.84) | 0.18 | .003 |
| Punteggio di Hopkins Adjusted Comorbidity Groupc | 4749 (435.30) | 4910 (4420-4930) [300-5200] | 1.00 (0.99-1.01) | 0.01 | .48 |
| Caratteristiche del Primo Prescrittore di csDMARD | |||||
| Anno di laurea, per ogni aumento di 5 anni | 1984 (11.33) | 1984 (1977-1994) [1942-2013] | 1.10 (1.04-1.17) | 0.01 | .001 |
| Donne, N. (%)d | 5703 (32.3) | NA | 0.97 (0.74-1.27) | 0.14 | .83 |
| Punteggio dell’indice di ruralità, per 20 unità di incremento | 4.80 (11.22) | 0 (0-5) [0-100] | 0.67 (0.50-0.92) | 0.01 | .01 |
| Reumatologo, N. (%) | 12 771 (72.2) | NA | 0.92 (0.65-1.31) | 0.01 | .66 |
| Fornitura di reumatologi regolata in base alla quantità | 4.14 (2.72) | 3.78 (2.36-5.13) [0-16.69] | 1.03 (1.00-1.06) | 0.02 | .03 |
Differenze nella prescrizione biologica DMARD per caratteristiche del paziente
Caratteristiche demografiche del paziente
I pazienti che hanno ricevuto un csDMARD dopo la diagnosi di RA a 65 anni o più avevano un’età media (SD) di 75,2 (5,8) anni al basale, erano prevalentemente donne (11-598 donne [65,6%]), e tendevano a risiedere in aree più urbane (punteggio medio di ruralità [SD], 11,86 [18,51]). Gli immigrati rappresentavano 1131 pazienti (6,4%) che ricevevano csDMARD alla linea di base(Tabella).
Nell’analisi descrittiva non corretta di tutti i consumatori di farmaci attivi, le disparità nella percentuale di prescrizioni biologiche tra le regioni sono aumentate nel tempo in Ontario(Figura 1). Nel 2002, la differenza tra le percentuali regionali più alte e più basse di DMARD biologici utilizzati per persona è stata di 1,8 punti percentuali (Toronto, 2,7% contro il Centro Est, 0,9%; differenza, 68,4%). Nel 2015, la differenza tra la percentuale regionale più alta e quella più bassa è stata di 8,7 punti percentuali (Hamilton Niagara, 21,3% contro il Centro Est, 12,6%; differenza, 66,3%). Le curve Kaplan-Meier non corrette, stratificate per regione e come aggregato di tutte le regioni, hanno illustrato differenze significative nel tempo rispetto al primo DMARD biologico a seconda della regione di residenza del paziente (test log-rank, χ 213=147; P<<.001) (Figura 2).
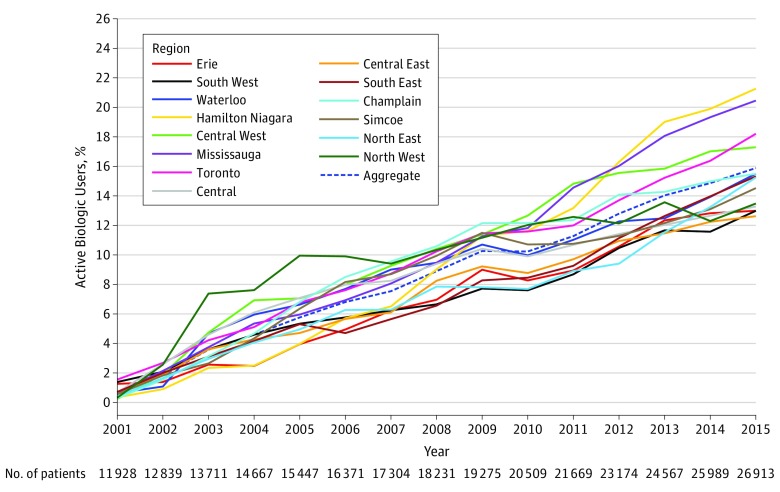
Figura 1.Figura 1. Percentuale attiva di prescrizione biologica come percentuale di utenti attivi di tutti i farmaci antireumatici che modificano le malattie (DMARD) tra gli adulti anziani con artrite reumatoidePercentuale non corretta di tutti i pazienti di età superiore ai 65 anni che ricevono DMARD biologico per l’artrite reumatoide, per regione.
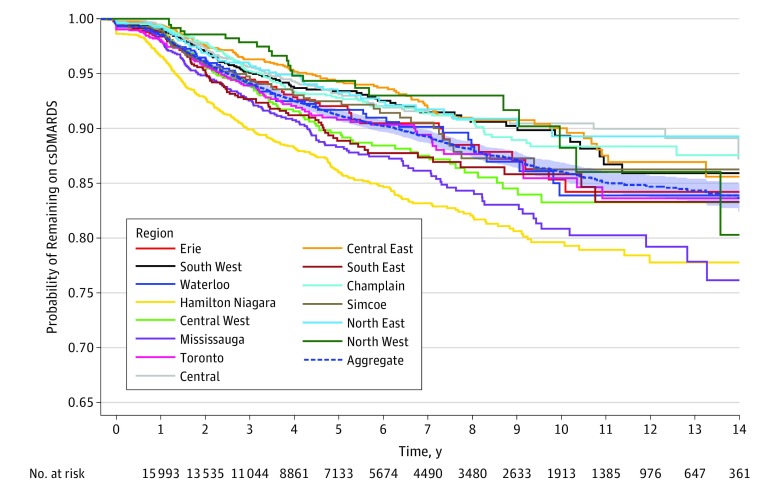
Figura 2.Figura 2. Tempo dal primo farmaco antireumatico convenzionale che modifica le malattie sintetiche (csDMARD) al primo DMARD biologico tra gli adulti più anziani con artrite reumatoide in Ontario, Canada, stratificato per regioneCurve di sopravvivenza non corrette per i pazienti di età superiore ai 67 anni che hanno iniziato la loro prima prescrizione di csDMARD tra il 2002 e il 2015, incluso, con un follow-up massimo fino al 2017. L’area ombreggiata intorno alla curva aggregata rappresenta il 95% dell’IC.
L’anno solare è stato associato al tempo al primo DMARD biologico nel modello Cox completamente regolato (HR per aumento di 5 anni nell’anno solare, 0,49; CI, 0,43-0,55; P<<.001) (Tabella). Per ogni aumento dell’età di 5 anni all’inizio del csDMARD, i pazienti avevano meno probabilità di ricevere un DMARD biologico (HR, 0,66; 95% di IC, 0,62-0,71; P<<001). Anche gli uomini (HR, 0,76; 95% IC, 0,66-0,89; P</ 001) avevano meno probabilità delle donne di ricevere farmaci biologici. I pazienti che avevano una durata più lunga della malattia avevano maggiori probabilità di ricevere un DMARD biologico (HR per ogni aumento di 5 anni della durata della malattia, 1,35; 95% di IC, 1,19-1,54; P  P<<.001). L’uso delle risorse sanitarie, rappresentato da un punteggio più alto del gruppo Hopkins Adjusted Comorbidity Group, non aveva alcuna associazione osservabile con il tempo di ricezione del primo DMARD biologico (HR, 1,00; 95% CI, 0,99-1,01; P==.48) (Tabella).

Figura 1.Figura 1. Percentuale attiva di prescrizione biologica come percentuale di utenti attivi di tutti i farmaci antireumatici che modificano le malattie (DMARD) tra gli adulti anziani con artrite reumatoidePercentuale non corretta di tutti i pazienti di età superiore ai 65 anni che ricevono DMARD biologico per l’artrite reumatoide, per regione.

Figura 2.Figura 2. Tempo dal primo farmaco antireumatico convenzionale che modifica le malattie sintetiche (csDMARD) al primo DMARD biologico tra gli adulti più anziani con artrite reumatoide in Ontario, Canada, stratificato per regioneCurve di sopravvivenza non corrette per i pazienti di età superiore ai 67 anni che hanno iniziato la loro prima prescrizione di csDMARD tra il 2002 e il 2015, incluso, con un follow-up massimo fino al 2017. L’area ombreggiata intorno alla curva aggregata rappresenta il 95% dell’IC.
Fattori socioeconomici
Dopo aver misurato le variabili a livello di paziente, tra cui il quintile di reddito del quartiere, i punteggi compositi dell’indice di emarginazione, lo status di immigrato e l’offerta di variabili di assistenza (cioè la distanza dal medico), abbiamo trovato risultati contrastanti per l’associazione di fattori socioeconomici con il tempo di ricezione del primo DMARD biologico. Vivere in un quartiere che apparteneva al quintile di reddito 1 (HR, 0,92; 95% IC, 0,65-1,31; P==,16) e il punteggio composito dell’indice di marginalità (HR, 0,99; 95% CI, 0,87-1,11; P==, 81) non erano fattori statisticamente significativi associati al ricevimento della prima prescrizione biologica. Gli immigrati erano statisticamente meno probabili di ricevere prescrizioni biologiche (HR, 0,59; 95% CI, 0,42-0,84; P==.003) (Tabella). Una maggiore distanza dal prescrittore del farmaco, indipendentemente dalla specialità, è stata associata ad un leggero aumento della probabilità di ricevere una prescrizione biologica (HR per ogni 10 km di aumento, 1,01; 95% di CI, 1,00-1,02; P = .003) (Tabella).001), mentre i pazienti con una distanza maggiore dal reumatologo più vicino, che potrebbe non essere il reumatologo che il paziente stava visitando, avevano meno probabilità di ricevere una DMARD biologica (HR per ogni aumento di 10 km, 0,99; 95% di IC, 0,98-0,99; P P<<.001) (Tabella).
Differenze nella prescrizione di DMARD biologico per caratteristiche del prescrittore
Caratteristiche demografiche del prescrittore
Un totale di 214 prescrittori unici aveva scritto 10 o più prescrizioni biologiche durante il periodo di studio. I prescrittori erano principalmente reumatologi (151 su 214 [70,6%]) e medici di base (26 su 214 [12,1%]). Tra le 405-321 prescrizioni di DMARD biologici e csDMARD iniziate o mantenute durante lo studio, 291162 (71,8%) sono state fatte da un reumatologo, 56-470 (13,9%) da un medico di base, 38-306 (9,40%) da un internista e 16 461 (4,0%) da altri specialisti. Le prescrizioni di DMARD biologici sono state prevalentemente iniziate o mantenute dai reumatologi (1629 del 1977 prescrizioni [82,4%]), ma anche i medici di base (164 prescrizioni [8,3%]), i medici di medicina interna (55 prescrizioni [2,8%]) e i dermatologi (23 prescrizioni [1,3%]) hanno prescritto DMARD biologici in quantità superiori all’1% di tutte le prescrizioni biologiche. L’aver conseguito più recentemente la laurea in medicina è stato associato ad una maggiore propensione a prescrivere il primo DMARD biologico (HR per 5 anni dopo la laurea, 1,10; 95% CI, 1,04-1,17; P==.001), mentre le donne non erano statisticamente diverse dagli uomini nella propensione ad iniziare il trattamento biologico (HR, 0,97; 95% CI, 0,74-1,27; P==.83). I medici che praticano in aree più rurali sono stati associati negativamente con la prescrizione di DMARD biologici (HR per 20 unità di aumento del punteggio di ruralità, 0,67; 95% di IC, 0,50-0,92; P==.01), mentre una maggiore quantità di fornitura di reumatologi punteggio reumatologi è stata associata ad una maggiore probabilità di ricevere DMARD biologici (HR, 1,03; 95% CI, 1,00-1,06; P==.03) (Tabella e Figura 3).
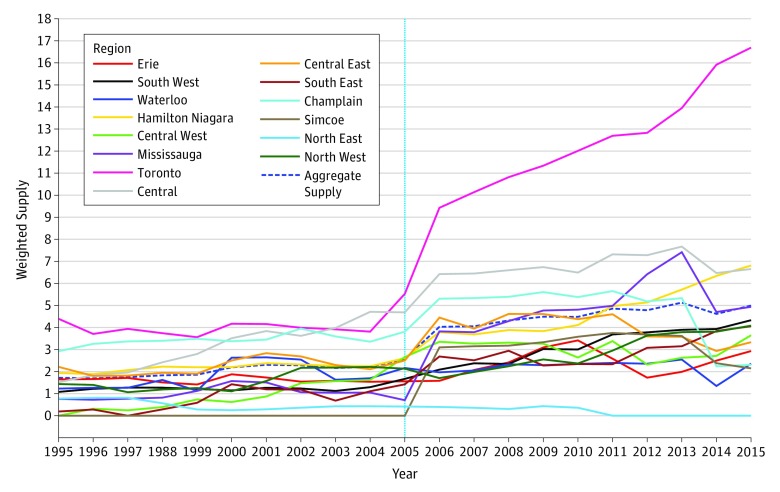
Figura 3.Figura 3. Fornitura di reumatologi regolata in base alla quantità per regioneLa linea verticale rappresenta il cambiamento del codice identificativo di fatturazione del reumatologo.

Figura 3.Figura 3. Fornitura di reumatologi regolata in base alla quantità per regioneLa linea verticale rappresenta il cambiamento del codice identificativo di fatturazione del reumatologo.
Preferenza del reumatologo e variazione regionale
Le preferenze del reumatologo per la prescrizione del primo DMARD biologico tra i pazienti biologicamente idonei a ricevere il primo DMARD biologico sono aumentate di un fattore 3 dal 2001 al 2015, passando dall’1,7% al 4,9%, corretto per il numero di pazienti idonei a ricevere il primo DMARD biologico(Figura 4). Nei modelli corretti per l’età, il sesso e l’anno solare, la varianza del prescrittore ha rappresentato il 74% della varianza nel tempo tra il primo csDMARD e il primo DMARD biologico (eTable nel supplemento). Dopo l’aggiustamento per tutte le covariate del paziente e del medico, la preferenza del medico ha rappresentato il 65% delle differenze tra le regioni, mentre le differenze tra le regioni stesse hanno contribuito per il 4,6% alla variazione complessiva della prescrizione. Il restante 30,4% era dovuto alla variazione sottostante (eTable nel supplemento).
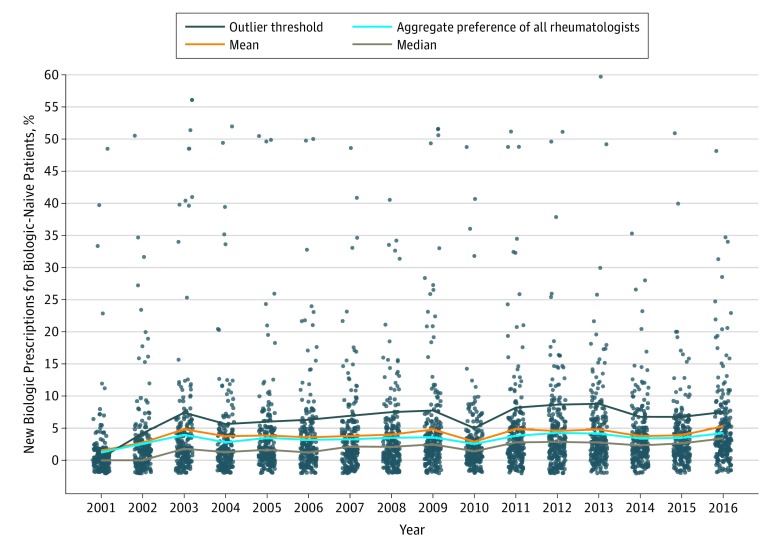
Figura 4.Figura 4. Preferenze di prescrizione biologica tra i 270 medici che hanno prescritto farmaci antireumatici biologici che modificano le malattie nel tempoPreferenza calcolata utilizzando tutti i pazienti disponibili. I punti rappresentano i singoli medici.

Figura 4.Figura 4. Preferenze di prescrizione biologica tra i 270 medici che hanno prescritto farmaci antireumatici biologici che modificano le malattie nel tempoPreferenza calcolata utilizzando tutti i pazienti disponibili. I punti rappresentano i singoli medici.
Discussione
In un sistema in cui tutti i pazienti hanno ricevuto la stessa copertura completa di prescrizione, le differenze di tempo per la ricezione della prima DMARD biologica sono persistite dopo l’aggiustamento per il singolo paziente, il prescrivente e le caratteristiche regionali. Modeste variazioni tra le regioni per il tempo alla prima prescrizione biologica sono state scoperte in concomitanza con variazioni relativamente grandi tra i prescrittori. Uno studio del 201536 ha mostrato che diversi fattori, tra cui un decorso di malattia complessa, più assicuratori sanitari, le preferenze dei pazienti e i comportamenti prescrittivi dei medici, sono stati associati con le differenze di tempo per la prescrizione del primo DMARD biologico, evidenziando l’importanza dell’analisi nidificata. I risultati di questo studio sono simili al tasso di penetrazione biologica della Svezia, dove circa il 4% dei pazienti anziani riceve DMARD biologici.37 Nel nostro studio, il tasso di penetrazione biologica del 4,1% (719 su 17-692) era quasi identico ai risultati della Svezia. Il nostro adeguamento nidificato per i pazienti, i prescrittori e la regione ha fornito una valutazione completa della relativa associazione di una moltitudine di fattori con il tempo alla prima prescrizione biologica e ha dimostrato persistenti variazioni tra le regioni geografiche. Una differenza del 4,6% nel tempo al ricevimento di DMARD biologici tra regioni dovrebbe essere considerata problematica in assenza di altri fattori esplicativi. Per esempio, ogni aumento dell’1% delle prescrizioni biologiche su una popolazione di 72.000 pazienti finanziati con la RA costa circa 10,8 milioni di dollari (8,25 milioni di dollari) all’anno (supponendo una penetrazione biologica del 10% e 15.000 dollari all’anno per prescrizione di DMARD biologico [11.460 dollari]).38 Per portare la regione dell’Ontario con la più alta spesa in Ontario in linea con la spesa media si risparmierebbero circa CaD$6 milioni a $8 milioni (US$4,6 milioni a $6,1 milioni) all’anno, rappresentando il 16% del budget totale della RA biologica e lo 0,32% del budget totale per la formulazione dei farmaci. Al contrario, per aumentare la penetrazione biologica nelle regioni dell’Ontario scarsamente servite sarebbe costato circa 6-8 milioni di dollari (4,6-6,1 milioni di dollari) per soddisfare la media della popolazione di tutte le regioni dell’Ontario.
Un’offerta più elevata di reumatologi regolata in base alla quantità e una pratica reumatologica più urbana sono state associate alla ricezione di DMARD biologici. I pazienti che risiedevano in aree con uno status socio-economico più basso e in aree rurali con meno accesso ai reumatologi, così come i pazienti che erano immigrati, avevano meno probabilità di ricevere prescrizioni biologiche, suggerendo un gradiente sociodemografico di cura per i pazienti più svantaggiati. Questo studio ha indicato che i pazienti con uno status socio-economico inferiore erano i meno propensi a ricevere DMARD biologici. Questo risultato è sorprendente se si considera che altri studi pubblicati mostrano che lo stato socioeconomico è un noto fattore di rischio per malattie più gravi.39,40,41,42 I risultati di questo studio suggeriscono che avere accesso locale ad un reumatologo può aiutare ad estendere il corso di trattamento efficace di csDMARDs. I nostri risultati suggeriscono anche che i pazienti possono essere più disposti a percorrere distanze più lunghe per cercare trattamenti biologici. L’associazione tra l’aumento dell’età e un tempo maggiore per ricevere un DMARD biologico ha suggerito un continuo pregiudizio contro la fornitura di DMARD biologici per i pazienti più anziani, nonostante pochi segnali di sicurezza che indicano un maggiore rischio di infezione o altri gravi eventi avversi e infezioni.37,43
Punti di forza e limitazioni
I punti di forza di questo studio sono stati la combinazione di dati di alta qualità e metodi statistici. I database amministrativi utilizzati per l’esposizione, l’esito e la definizione covariata sono stati convalidati per tutte le malattie e contengono dati uniformi per la raccolta e il follow-up. I modelli statistici utilizzati sono stati innovativi nell’assegnare l’esposizione variabile nel tempo al medico curante invece di basarsi su esposizioni proxy, in cui le covariate del medico sono fissate in base al primo prescrivente di un csDMARD. Inoltre, l’inclusione di effetti casuali nidificati per i medici all’interno delle regioni ci ha permesso di stimare la variazione associata alla regione e al medico. Inoltre, è stata creata una nuova variabile, l’offerta regolata in base alla quantità dei reumatologi, per riflettere l’offerta disponibile dei reumatologi in relazione alla domanda per la loro cura. Questa variabile ha una forte base teorica nella letteratura economica esistente con potenziali applicazioni ad altri studi sulle disparità nell’erogazione dei servizi sanitari.23,24
Questo studio aveva anche dei limiti, tra cui la limitazione dell’analisi ai pazienti di 67 anni o più, una fascia d’età in cui la propensione a prescrivere DMARD biologici è notoriamente più bassa. A causa della più alta percentuale di prescrizione biologica (cioè, stima del 30%)37) nella popolazione dei pazienti più giovani con RA, in combinazione con la mancanza di un’assicurazione universale finanziata con fondi pubblici per i pazienti di età inferiore ai 65 anni in Ontario, ci aspettiamo che le conseguenti disparità nelle prescrizioni biologiche potrebbero essere più gravi tra i pazienti di età inferiore ai 65 anni. Lo studio conteneva un ampio campione di pazienti con RA che vivono in Canada perché l’Ontario ospita il 38% della popolazione canadese.35 Con la metà dei pazienti con RA di età superiore ai 65 anni, circa il 19% di tutti i pazienti con RA in Canada è stato incluso nello studio. Erano presenti anche limitazioni intrinseche dei dati amministrativi. Anche se convalidata, la definizione di esposizione alla RA potrebbe portare a una classificazione errata dei casi. Questo problema di errata classificazione è stato in qualche modo alleviato dalla progettazione, perché ai pazienti doveva essere prescritto un csDMARD correlato alla RA per essere incluso nello studio. Le covariate non disponibili, come la gravità della malattia, i questionari di disabilità funzionale (ad esempio, il Disease Activity Score, 28, o il Questionario di valutazione della salute), e altre covariate non osservate, possono essere associate a un’influenza differenziale sistemica tra le regioni, i pazienti e i prescrittori. I dati a livello individuale per i pazienti e i prescrittori sono stati utilizzati per ridurre al minimo i rischi di distorsioni sistemiche e di fallacia ecologica.
Conclusioni
La prescrizione del primo DMARD biologico è una decisione sanitaria costosa, con la scelta di prescrivere un DMARD biologico associato a grandi costi e implicazioni cliniche. Pertanto, piccoli cambiamenti nel tempo al primo DMARD biologico hanno un grande impatto clinico ed economico. Da un punto di vista clinico, la prescrizione di un DMARD biologico rappresenta una transizione verso un piano di cura più complesso, con meno dati a supporto della scelta della prossima prescrizione dopo il primo DMARD biologico.
Sebbene le disparità di accesso ai DMARD biologici siano aumentate in questo studio, la percentuale complessiva di prescrizioni è diminuita rispetto alla popolazione di utenti di farmaci attivi con RA. Questo suggerisce che, nonostante i reumatologi prescrivano in media meno DMARD biologici per paziente per unità di tempo, le variazioni nella prescrizione di DMARD biologici continuano a crescere. Il termine “effetti casuali” nei nostri modelli indicava un’elevata quantità di variazioni associate alla pratica dei reumatologi all’interno delle regioni. Queste differenze nelle preferenze dei prescrittori hanno implicazioni poco chiare per gli esiti dei pazienti, ma mostrano che esistono differenze tra i prescrittori nell’erogazione dell’assistenza sanitaria per i pazienti con RA, nonostante l’identica copertura assicurativa sanitaria.
References
- Accuracy of Canadian health administrative databases in identifying patients with rheumatoid arthritis: a validation study using the medical records of rheumatologists. Arthritis Care Res (Hoboken). 2013; 65(10)DOI | PubMed
- Canadian Rheumatology Association recommendations for pharmacological management of rheumatoid arthritis with traditional and biologic disease-modifying antirheumatic drugs. J Rheumatol. 2012; 39(8):1559-1582. DOI | PubMed
- EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017; 76(6):960-977. DOI | PubMed
- 2015 American College of Rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken). 2016; 68(1):1-25. DOI | PubMed
- Canadian variation by province in rheumatoid arthritis initiating anti-tumor necrosis factor therapy: results from the optimization of adalimumab trial. J Rheumatol. 2010; 37(12):2469-2474. DOI | PubMed
- Comparison of anti-TNF treatment initiation in rheumatoid arthritis databases demonstrates wide country variability in patient parameters at initiation of anti-TNF therapy. Semin Arthritis Rheum. 2011; 41(1):81-89. DOI | PubMed
- Sociodemographic, disease, health system, and contextual factors affecting the initiation of biologic agents in rheumatoid arthritis: a longitudinal study. Arthritis Care Res (Hoboken). 2014; 66(7):980-989. DOI | PubMed
- Use and spending for biologic disease-modifying antirheumatic drugs for rheumatoid arthritis among US Medicare beneficiaries. Arthritis Care Res (Hoboken). 2015; 67(9):1210-1218. DOI | PubMed
- Receipt of disease-modifying antirheumatic drugs among patients with rheumatoid arthritis in Medicare managed care plans. JAMA. 2011; 305(5):480-486. DOI | PubMed
- Disparities in rheumatoid arthritis disease activity according to gross domestic product in 25 countries in the QUEST-RA database. Ann Rheum Dis. 2009; 68(11):1666-1672. DOI | PubMed
- Biologic TNF inhibiting agents for treatment of rheumatoid arthritis: persistence and dosing patterns in Germany. Health Econ Rev. 2014; 4(1):32. DOI | PubMed
- Do rheumatoid arthritis patients have equal access to treatment with new medicines? tumour necrosis factor-alpha inhibitors use in four European countries. Health Policy. 2012; 104(1):76-83. DOI | PubMed
- Barriers to accessing biologic treatment for rheumatoid arthritis in Greece: the unseen impact of the fiscal crisis: the Health Outcomes Patient Environment (HOPE) study. Rheumatol Int. 2014; 34(1):25-33. DOI | PubMed
- Access to biologic treatment for rheumatoid arthritis in Central and Eastern European (CEE) countries. Med Sci Monit. 2011; 17(4):SR1-SR13. DOI | PubMed
- Nationwide prevalence of rheumatoid arthritis and penetration of disease-modifying drugs in Sweden. Ann Rheum Dis. 2011; 70(4):624-629. DOI | PubMed
- Small-area variations in sales of TNF inhibitors in Sweden between 2000 and 2009. Scand J Rheumatol. 2011; 40(1):8-15. DOI | PubMed
- Impact of socioeconomic gradients within and between countries on health of patients with rheumatoid arthritis (RA): lessons from QUEST RA. Best Pract Res Clin Rheumatol. 2012; 26(5):705-720. DOI | PubMed
- Inequities in access to biologic and synthetic DMARDs across 46 European countries. Ann Rheum Dis. 2014; 73(1):198-206. DOI | PubMed
- Less educated and older patients have reduced access to biologic DMARDs even in a country with highly developed social welfare (Norway): results from Norwegian cohort study NOR-DMARD. Rheumatology (Oxford). 2016; 55(7):1217-1224. DOI | PubMed
- Variations in criteria regulating treatment with reimbursed biologic DMARDs across European countries: are differences related to country’s wealth?. Ann Rheum Dis. 2014; 73(11):2010-2021. DOI | PubMed
- Confounding control in healthcare database research: challenges and potential approaches. Med Care. 2010; 48(6):S114-S120. DOI | PubMed
- Health insurance coverage and health: what the recent evidence tells us. N Engl J Med. 2017; 377(6):586-593. DOI | PubMed
- A proposal to speed translation of healthcare research into practice: dramatic change is needed. Am J Prev Med. 2011; 40(6):637-644. DOI | PubMed
- Design of Observational Studies. Springer: New York, NY; 2010.
- Publisher Full Text
- The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. J Clin Epidemiol. 2008; 61(4):344-349. DOI | PubMed
- Version 10 Release Notes. PC (DOS/WIN/NT) and Unix Version 10.0. Johns Hopkins Bloomberg School of Public Health: Baltimore, MD; 2014.
- Measuring rurality: RIO2008 BASIC: methodology and results.Publisher Full Text
- Income Reference Guide, Census of Population, 2016.Publisher Full Text
- Development of the Canadian Marginalization Index: a new tool for the study of inequality. Can J Public Health. 2012; 103(8):S12-S16. DOI | PubMed
- The dynamic behavior of alternative price adjustment mechanisms. Manchester School. 1983; 51(1):33-44. DOI
- Management of hospital formularies in Ontario: challenges within a local health integration network. Can J Hosp Pharm. 2016; 69(3):187-193. DOI | PubMed
- A tutorial on multilevel survival analysis: methods, models and applications. Int Stat Rev. 2017; 85(2):185-203. DOI | PubMed
- Mixed effects Cox models.Publisher Full Text
- Publisher Full Text
- Physician preferences and variations in prescription of biologic drugs for rheumatoid arthritis: a register-based study of 4,010 patients in Sweden. Arthritis Care Res (Hoboken). 2015; 67(12):1679-1685. DOI | PubMed
- Costs for hospital care, drugs and lost work days in incident and prevalent rheumatoid arthritis: how large, and how are they distributed?. Ann Rheum Dis. 2015; 74(4):648-654. DOI | PubMed
- Publisher Full Text
- The relationship between social deprivation, disease outcome measures, and response to treatment in patients with stable, long-standing rheumatoid arthritis. J Rheumatol. 2005; 32(12):2330-2336. PubMed
- Disease activity and severity in patients with rheumatoid arthritis: relations to socioeconomic inequality. Soc Sci Med. 1999; 48(12):1743-1750. DOI | PubMed
- Association of socioeconomic status with treatment delays, disease activity, joint damage, and disability in rheumatoid arthritis. Arthritis Care Res (Hoboken). 2015; 67(7):940-946. DOI | PubMed
- The impact of low family income on self-reported health outcomes in patients with rheumatoid arthritis within a publicly funded health-care. Rheumatology (Oxford). 2004; 43(11):1390-1397. DOI | PubMed
- Serious infections in a population-based cohort of 86,039 seniors with rheumatoid arthritis. Arthritis Care Res (Hoboken). 2013; 65(3):353-361. DOI | PubMed
Fonte
Tatangelo M, Tomlinson G, Paterson JM, Ahluwalia V, Kopp A, et al. (2019) Association of Patient, Prescriber, and Region With the Initiation of First Prescription of Biologic Disease-Modifying Antirheumatic Drug Among Older Patients With Rheumatoid Arthritis and Identical Health Insurance Coverage. JAMA Network Open 2(12): e1917053. https://doi.org/10.1001/jamanetworkopen.2019.17053





