Abstract
Introduzione
Le condizioni ambientali vissute in una generazione possono influenzare i fenotipi che si manifestano nelle generazioni future, un fenomeno talvolta indicato come “eredità dei caratteri acquisiti”. Nei mammiferi, un consistente corpus di letteratura collega varie esposizioni materne ai fenotipi della prole (Harrise Seckl ,2011; Rando e Simmons, 2015; Simmons, 2011), e un numero crescente di studi ha dimostrato che l’ambiente paterno può anche alterare il fenotipo della prole (Rando,2012). I paradigmi dell’effetto paterno sono di particolare interesse meccanicistico nei mammiferi, dato che è difficile distinguere gli effetti dell’ambiente materno sull’epigenoma dell’ovocita dagli effetti sull’approvvigionamento uterino durante lo sviluppo della prole. Al contrario, in molti paradigmi di effetto paterno, i maschi contribuiscono poco più dello sperma alla prole, semplificando la ricerca delle basi meccanicistiche degli effetti paterni sui bambini. Un gran numero di paradigmi di esposizione paterna sono stati utilizzati per dimostrare che la dieta di un padre può influenzare i fenotipi metabolici nella prossima generazione (McPhersonet al., 2014; Rando , 2012), mentre un altro ampio gruppo di studi collega lo stress paterno (utilizzando paradigmi come lo stress da sconfitta sociale, o la separazione materna precoce) ai comportamenti legati all’ansia e al rilascio di cortisolo nella prole (Bale, 2015). Infine, è stato dimostrato che un numero crescente di tossine e farmaci inducono effetti su vari fenotipi della prole(Skinner et al., 2011; Vassoler et al., 2013; Yohn et al., 2015; Zeybel et al., 2012).
Una sfida fondamentale in tali studi è attualmente quella di capire come il fenotipo della prole sia correlato allo stimolo presentato nella generazione paterna – in altre parole, quanto è specifica la risposta della prole? Questa sfida è aggravata dal fatto che molti degli stimoli utilizzati per i paradigmi di effetto paterno – diete a basso contenuto proteico e ad alto contenuto di grassi, fattori di stress sociale e perturbatori endocrini – hanno effetti pleiotropici sulla fisiologia dell’organismo. Abbiamo quindi cercato di sviluppare un paradigma di effetto paterno basato su una definita interazione ligneo-recettore, per consentire l’interrogatorio farmacologico della specificità del fenotipo della prole. La nicotina è un farmaco di uso comune negli esseri umani, e agisce legandosi e attivando i recettori nicotinici dell’acetilcolina (nAChRs), canali cationici ligand-gated normalmente attivati dal neurotrasmettitore endogeno acetilcolina. L’uso materno della nicotina è stato collegato a fenotipi multipli nella prole(Yohn et al., 2015; Zhu et al., 2014), e sebbene gli effetti dell’esposizione paterna alla nicotina siano stati meno studiati, il fumo paterno negli esseri umani è stato suggerito per influenzare i fenotipi metabolici nei bambini(Pembrey et al., 2006).
Qui, sviluppiamo un modello di roditori per gli effetti paterni della nicotina, chiedendo (1) se l’esposizione dei topi maschi alla nicotina potrebbe avere un impatto sui fenotipi nella prole, e (2) se qualsiasi fenotipo affetto sarebbe specifico per la nicotina. Abbiamo scoperto che l’esposizione paterna alla nicotina induceva una risposta protettiva nella generazione successiva, poiché la prole maschio dei padri esposti alla nicotina mostrava una protezione significativa dalla tossicità della nicotina. È importante notare che questa resistenza alla tossina non era specifica per la nicotina, ma rifletteva invece una risposta xenobiotica più generale – la prole dei padri esposti alla nicotina mostrava una maggiore espressione epatica di una varietà di geni coinvolti nella clearance degli xenobiotici, e questi animali erano resistenti alla cocaina così come alla tossicità della nicotina. Infine, abbiamo trovato che una maggiore resistenza alla tossicità della nicotina è stata osservata anche nella prole dei maschi trattati con l’antagonista della nicotina mecamilamina, suggerendo fortemente che la resistenza ai farmaci nella prole è un risultato comune dell’esposizione paterna a xenobiotici multipli piuttosto che una risposta specifica derivante dalla segnalazione della nicotina. Presi insieme, i nostri risultati descrivono un nuovo paradigma di effetto paterno, e dimostrano che nel caso di esposizione paterna alla nicotina, il fenotipo osservato nella prole è una risposta relativamente generica – una maggiore resistenza xenobiotica – piuttosto che una riduzione selettiva della via molecolare specifica soggetta a perturbazione paterna.
Risultati
Effetti della storia di esposizione paterna sulla sensibilità alla nicotina della prole
Abbiamo stabilito un paradigma di esposizione paterna in cui i topi maschi sono stati forniti con tartrato di idrogeno nicotina (nicotina 200 μg/ml base libera, addolcita con saccarina) nella loro acqua potabile, o una soluzione di controllo di acido tartarico e saccarina. I topi consumavano nicotina o soluzioni di controllo (NIC o TA, rispettivamente) a partire da 3 settimane di età fino a 8 settimane. Come descritto in precedenza(Zhao-Shea et al., 2015), questo regime di somministrazione mantiene un alto livello di nicotina nel flusso sanguigno(Figura 1-figure supplement 1A-B), e si traduce in dipendenza da nicotina negli animali esposti (Zhao-Sheaet al., 2013). I maschi sono stati poi ritirati dalla nicotina per una settimana prima dell’accoppiamento, al fine di prevenire qualsiasi potenziale di trasmissione del liquido seminale della nicotina (il tempo di dimezzamento della nicotina nei topi è di ~10 min, il tempo di dimezzamento del suo metabolita cotinina “longevo” è di ~40 min [Siu e Tyndale,2007]). La nicotina e i maschi di controllo sono stati poi accoppiati con le femmine di controllo. Nel complesso, non abbiamo osservato alcuna differenza nella dimensione media o nel rapporto sessuale delle cucciolate derivanti da accoppiamenti di controllo o nicotina, o nel peso corporeo della prole(Figura 1-figure supplement 1C-F).
Abbiamo prima cercato di determinare se l’astinenza forzata dalla nicotina nel nostro paradigma di esposizione potrebbe risultare in una risposta allo stress paterno che potrebbe influenzare il fenotipo della prole. Poiché sono stati segnalati comportamenti correlati all’ansia nella prole di maschi soggetti a diversi paradigmi di stress(Dietz et al., 2011; Gapp et al., 2014; Short et al., 2016) (anche se non tutti questi paradigmi – [Rodgers et al.,2013]), abbiamo quindi valutato i comportamenti ansiosi nella prole di TA e NIC. È importante notare che non abbiamo osservato differenze tra TA e NIC prole nel tempo trascorso nel centro durante un test di ansia in campo aperto, o nel tempo trascorso o il numero di ingressi nelle braccia aperte di un labirinto più elevato(Figura 1-figure supplemento 2). Questi risultati e i risultati discussi di seguito (vedi Figura 6) indicano che il nostro paradigma di somministrazione della nicotina non induce una risposta allo stress in modo sufficientemente robusto, o per un tempo sufficientemente lungo prima dell’accoppiamento, da influenzare il fenotipo della prole.
Abbiamo poi chiesto se la somministrazione paterna di nicotina potrebbe influenzare più specificamente i fenotipi correlati alla nicotina nella prossima generazione. Ci siamo prima concentrati su una lettura fisiologica della sensibilità della prole alla nicotina, utilizzando un test ben consolidato per la soppressione dell’attività locomotoria da parte della somministrazione di nicotina acuta(Tapper et al., 2004). In breve, dopo aver acclimatato gli animali a un protocollo di iniezione salina per tre giorni, gli animali vengono iniettati con nicotina (1,5 mg / kg) o soluzione salina, e immediatamente introdotti in un nuovo ambiente. Animali iniettati con soluzione salina esplorano attivamente l’ambiente nuovo, e l’attività locomotoria è quantificata su un corso di tempo di 40 minuti(Figura 1 – Linea di base). In questo paradigma, l’iniezione di nicotina si traduce in una rapida soppressione dell’attività locomotoria, seguita da un graduale recupero del comportamento esplorativo nel corso del tempo del saggio. Utilizzando questo test, abbiamo osservato alcuna differenza significativa nella sensibilità alla nicotina tra TA e la prole NIC, sia per la prole maschio o femmina(Figura 1, Figura 1-figure supplement 3). Concludiamo quindi che la risposta di soppressione acuta dell’attività locomotoria alla nicotina non è alterata dal nostro paradigma di esposizione paterna alla nicotina.10.7554/eLife.24771.003Figure 1.Nicotine suppression of locomotor activity is inalterata dalla storia paterna della nicotina.gli effetti della nicotina sull’attività locomotoria sono stati analizzati nella prole maschile di controllo (TA) o nei padri esposti alla nicotina (NIC). I dati per le femmine e i regimi di somministrazione alternativi sono mostrati nella figura 1-figure supplement 3. Per ogni trama, i maschi sono stati iniettati con soluzione salina o nicotina immediatamente prima di essere posto in un nuovo ambiente per 40 minuti, durante i quali l’attività locomotoria è stata valutata dal numero di volte che l’animale ha interrotto un fascio di luce durante ogni minuto. Ogni punto di tempo mostra il numero di attraversamenti del fascio di luce in quel minuto, mostrato come media più/meno s.e.m. per tutti gli animali testati. È importante notare che, qui e in tutto il manoscritto, il numero di animali elencati rappresenta il numero di cucciolate analizzate, in quanto si valuta solo un animale per cucciolata in un determinato saggio. I dati sono mostrati per l’iniezione di soluzione salina (“Baseline”) – il comportamento esplorativo diminuisce nel tempo negli animali iniettati di soluzione salina mentre si abituano alla gabbia locomotoria – e per l’iniezione di 1,5 mg/kg di nicotina negli animali ingenui alla nicotina (Giorno 1) o dopo cinque o otto giorni precedenti della stessa iniezione di nicotina e del protocollo di valutazione locomotoria.DOI:http://dx.doi.org/10.7554/eLife.24771.00310.7554/eLife.24771.004FigureSupplemento a 1 cifra 1.Effetti fisiologici dell’esposizione alla nicotina sui maschi trattati.(A) Peso dei maschi soggetti a 5 settimane di esposizione alla nicotina (NIC) o soluzione di controllo (TA). I dati sono mostrati per gli animali alla fine di 5 settimane di esposizione alla nicotina (** indica p<0,01), e dopo una settimana di astinenza (n.s.: non significativo), come indicato.(B) Livelli ematici di cotinina, un metabolita relativamente longevo della nicotina, nei maschi (a 8 settimane di età, dopo 5 settimane di trattamento con nicotina/controllo) che consumano soluzioni di controllo o di nicotina.(C) Dimensione media della cucciolata per la prole di maschi di controllo e trattati con nicotina. I dati mostrano la media più/meno s.e.m.(D) Rapporto medio tra i sessi per la prole di controllo e i maschi trattati con nicotina. I dati mostrano la media più/meno s.e.m.(E- F) Pesi medi per la prole maschio (E) e femmina (F)TA e NIC a 4, 5 e 6 settimane di età. I dati sono mostrati come media più / meno S.D.DOI:http://dx.doi.org/10.7554/eLife.24771.00410.7554/eLife.24771.005Figure1-figure supplemento 2.Paternal esposizione alla nicotina non influisce sulla prole ansia comportamenti correlati. (A-B) I dati sono mostrati per elevate prestazioni più labirinto più – il tempo trascorso in braccia aperte (A), o voci totale nelle braccia aperte (B) – per la proleTA(n = 7) e la prole NIC (n = 11).(C- J) Prestazioni di prova in campo aperto, indicate per i primi 10 min (C- F) o i primi 5 min (G- J) successivi all’introduzione dell’animale nello stabulario. I pannelli mostrano la distanza totale spostata(C,G), la velocità(D,H), la frazione di tempo trascorso al centro dello stabulario a campo aperto(E,I) e il tempo cumulativo trascorso nella zona centrale(F,J). Tutti i dati mostrano una media +/- s.e.m. Nessuna delle differenze tra la prole TA e la prole NIC è statisticamente significativa.DOI:http://dx.doi.org/10.7554/eLife.24771.00510.7554/eLife.24771.006FigureSupplemento a 1 cifra 3.Nessun effetto significativo dell’esposizione paterna alla nicotina sulla risposta locomotoria della prole alla nicotina. Per ogni colonna, la prole di controllo e i maschi trattati con nicotina (TA e NIC, rispettivamente) sono stati sottoposti a un test di attività locomotoria come segue. Gli animali sono stati prima acclimatati a iniezioni saline intraperitoneali una volta al giorno per tre giorni. Il terzo giorno (linea di base), la prole è stata iniettata con soluzione fisiologica, poi collocata in un nuovo ambiente – una scatola dotata di fotodiodi a infrarossi per consentire il rilevamento di attività locomotoria. Gli animali iniettati di soluzione salina esplorano attivamente il nuovo ambiente, e l’attività locomotoria è quantificata su un arco di tempo di 40 o 90 minuti dal numero di volte che l’animale interrompe il fascio di luce. Il comportamento esplorativo diminuisce nel tempo negli animali a iniezione di soluzione salina mentre esplorano completamente lo stabulario. In nove giorni successivi (i dati per quattro giorni rappresentativi sono indicati in ogni colonna), gli animali vengono iniettati con nicotina (1,5 o 2,0 mg / kg, come indicato) e immediatamente introdotto nella scatola di misura. In questo paradigma, l’iniezione di nicotina si traduce in una rapida soppressione dell’attività locomotoria, seguita da un graduale recupero del comportamento esplorativo nel corso del tempo del saggio. I dati qui sono mostrati come media più/meno s.e.m.DOI:http://dx.doi.org/10.7554/eLife.24771.006
Abbiamo poi cercato di identificare eventuali effetti dell’esposizione paterna alla nicotina sul rafforzamento della nicotina nella prole utilizzando un test di autosomministrazione operante(Fowler et al., 2011). Qui, dopo l’impianto chirurgico di un catetere nella vena cava superiore, gli animali sono soggetti a restrizione calorica e sono addestrati ad aprire un portale attivo per l’autosomministrazione del saccarosio (SA). TA e la prole NIC ha mostrato un comportamento simile durante il periodo di formazione, con l’eccezione di una modesta ma significativa differenza di saccarosio SA l’ultimo giorno di formazione dietetica(Figura 2-figure supplemento 1). Dopo sette giorni di formazione alimentare, gli animali sono stati collocati nella camera operatoria, una pompa per infusione di nicotina è stata collegata al catetere centrale, e la ricompensa dietetica per il naso-poking del portale attivo è stata sostituita con un’infusione di nicotina. La quantità di nicotina autosomministrati ogni giorno è stata poi misurata per ogni sessione nel corso di 35 giorni, con la dose di infusione di nicotina che aumentava ogni 4-8 giorni (Materiali e metodi). Nel complesso, non c’è stata alcuna differenza nella nicotina SA giornaliera tra la prole dei maschi di controllo e la prole dei maschi esposti alla nicotina(Figura 2A), indicando che il comportamento di ricompensa della nicotina non è riprogrammato in modo significativo dal nostro paradigma di esposizione paterna.10.7554/eLife.24771.007Figure 2.Paternal experience affects nicotine toxicity, but not self-administration, in offspring.(A) Paternal nicotine exposure does not affect nicotine self-administration in offspring. Ogni giorno, un topo addestrato ad autosomministrare la nicotina (Materiali e metodi) è stato collegato all’apparato di autosomministrazione per un’ora, con la dose di nicotina somministrata tramite cannula per ogni corretta puntura del naso che si è scatenata ogni 4-8 giorni, come indicato. La nicotina totale autosomministrabile viene mostrata per ogni giorno del protocollo come media e s.e.m. Si noti che il numero di animali partecipanti alla prova è diminuito nel tempo a causa della rimozione dal protocollo (catetere ostruito) o della morte – la n elencata rappresenta tutti gli animali che sono rimasti sul protocollo fino alla morte.(B) I discendenti di padri esposti alla nicotina mostrano una protezione significativa dalla tossicità della nicotina. La curva di sopravvivenza è mostrata per tutti gli animali sul protocollo di autosomministrazione (i dati sottostanti sono forniti in Figura 2 dati fonte 1). La progenie esposta alla nicotina ha mostrato un significativo aumento della sopravvivenza durante il corso del test rispetto alla progenie di controllo (curva di sopravvivenza Kaplan-Meyer, p<0.0001 sia per il test Log-rank che per il test Gehan-Breslow-Wilcoxon).DOI:http://dx.doi.org/10.7554/eLife.24771.00710.7554/eLife.24771.008Figure2 dati fonte 1.La progenie dei padri esposti alla nicotina mostra una protezione significativa dalla tossicità della nicotina.Curva di sopravvivenza per tutti gli animali sul protocollo di autosomministrazione della nicotina.DOI:http://dx.doi.org/10.7554/eLife.24771.00810.7554/eLife.24771.009FigureSupplemento a 2 cifre 1.Modesto effetto dell’esposizione paterna alla nicotina sulla formazione dietetica.Dopo l’impianto chirurgico di una linea centrale, la TA e la progenie NIC sono stati autorizzati a recuperare per 3 giorni. Gli animali sono stati poi sottoposti a restrizione calorica (80% della dieta giornaliera rispetto agli animali che si nutrono ad libitum), collocati in una scatola di autosomministrazione con due pulsanti, uno dei quali era contrassegnato da una piccola luce. Gli animali sono stati poi forniti di pellet di saccarosio in risposta ad un punch al naso sul pulsante acceso – per 3 giorni è stato fornito un pellet a seguito di ogni punch al naso corretto, poi per un altro giorno sono stati richiesti due punch al naso per un pellet, e infine cinque punch al naso sono stati richiesti per un pellet alimentare per 3 giorni. Le barre qui mostrano il numero di pellet alimentari guadagnati in 1 ora per la prole TA e NIC – la prole NIC ha guadagnato moderatamente più pellet di saccarosio nel regime di ricompensa finale rispetto alla prole TA (p=0,03). Questa formazione alimentare migliorata ha portato al primo giorno di autosomministrazione della nicotina(Figura 2A), quando gli animali NIC si autosomministravano un po’ più di nicotina rispetto agli animali AT, ma questa differenza persisteva solo per il primo giorno.DOI:http://dx.doi.org/10.7554/eLife.24771.009
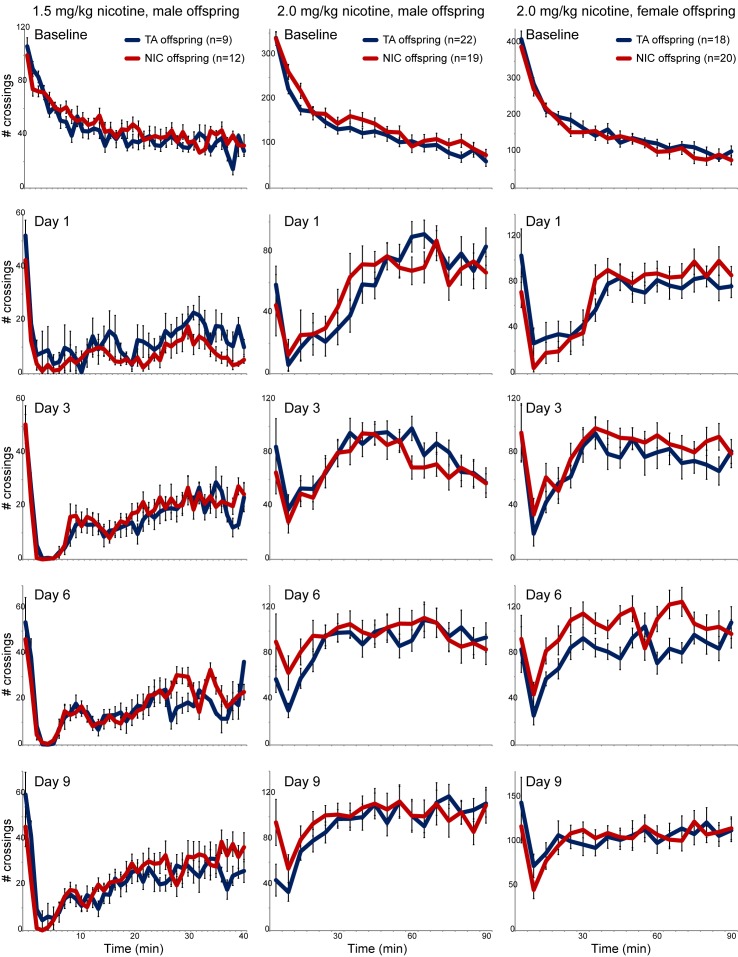
Figura 1-figure supplement 3.Figura 1— figura 3. La soppressione della nicotina dell’attività locomotoria non è influenzata dall’anamnesi paterna della nicotina.effetti fisiologici dell’esposizione alla nicotina sui maschi trattati.l’esposizione paterna alla nicotina non influisce sui comportamenti ansiosi della prole.nessun effetto significativo dell’esposizione paterna alla nicotina sulla risposta locomotoria della prole alla nicotina.Effetti della nicotina sull’attività locomotoria sono stati analizzati nella prole maschio di controllo (TA) o nei padri esposti alla nicotina (NIC). I dati per le femmine e regimi di somministrazione alternativi sono mostrati in Figura 1-figure supplement 3. Per ogni trama, i maschi sono stati iniettati con soluzione salina o nicotina immediatamente prima di essere posto in un nuovo ambiente per 40 minuti, durante i quali l’attività locomotoria è stata valutata dal numero di volte che l’animale ha interrotto un fascio di luce durante ogni minuto. Ogni punto di tempo mostra il numero di attraversamenti del fascio di luce in quel minuto, mostrato come media più/meno s.e.m. per tutti gli animali testati. È importante notare che, qui e in tutto il manoscritto, il numero di animali elencati rappresenta il numero di cucciolate analizzate, in quanto si valuta solo un animale per cucciolata in un determinato saggio. I dati sono mostrati per l’iniezione di soluzione salina (“Baseline”) – il comportamento esplorativo diminuisce nel tempo negli animali iniettati di soluzione salina mentre si abituano alla gabbia locomotoria – e per l’iniezione di 1,5 mg/kg di nicotina negli animali ingenui alla nicotina (Giorno 1) o dopo cinque o otto giorni precedenti della stessa iniezione di nicotina e del protocollo di valutazione locomotoria.DOI:
http://dx.doi.org/10.7554/eLife.24771.003(A) Peso dei maschi soggetti a 5 settimane di esposizione alla nicotina (NIC) o alla soluzione di controllo (TA). I dati sono indicati per gli animali alla fine di 5 settimane di esposizione alla nicotina (** indica p<0,01), e dopo una settimana di astinenza (n.s.: non significativo), come indicato.(B) Livelli ematici di cotinina, un metabolita relativamente longevo della nicotina, nei maschi (a 8 settimane di età, dopo 5 settimane di trattamento con nicotina/controllo) che consumano soluzioni di controllo o di nicotina.(C) Dimensione media della cucciolata per la prole di maschi di controllo e trattati con nicotina. I dati mostrano la media più/meno s.e.m.(D) Rapporto medio tra i sessi per la prole di controllo e i maschi trattati con nicotina. I dati mostrano la media più/meno s.e.m.(E- F) Pesi medi per la prole maschio (E) e femmina (F)TA e NIC a 4, 5 e 6 settimane di età. I dati sono indicati come media più/meno S.D.DOI:
http://dx.doi.org/10.7554/eLife.24771.004(A-B) I dati sono mostrati per le prestazioni elevate più labirinto – tempo trascorso in braccia aperte (A), o ingressi totali nelle braccia aperte (B) – per la prole TA (n = 7) e la prole NIC (n = 11).(C- J) Prestazioni di prova in campo aperto, indicate per i primi 10 min (C- F) o i primi 5 min (G- J) successivi all’introduzione dell’animale nello stabulario. I pannelli mostrano la distanza totale spostata(C,G), la velocità(D,H), la frazione di tempo trascorso al centro dello stabulario a campo aperto(E,I) e il tempo cumulativo trascorso nella zona centrale(F,J). Tutti i dati mostrano una media +/- s.e.m. Nessuna delle differenze tra la prole TA e la prole NIC è statisticamente significativa.DOI:
http://dx.doi.org/10.7554/eLife.24771.005Per ogni colonna, la prole di controllo e i maschi trattati con nicotina (TA e NIC, rispettivamente) sono stati sottoposti a un test di attività locomotoria come segue. Gli animali sono stati prima acclimatati a iniezioni saline intraperitoneali una volta al giorno per tre giorni. Il terzo giorno (Baseline), la prole è stata iniettata con soluzione fisiologica, poi collocata in un nuovo ambiente – una scatola dotata di fotodiodi a infrarossi per consentire il rilevamento di attività locomotoria. Gli animali iniettati di soluzione salina esplorano attivamente il nuovo ambiente, e l’attività locomotoria è quantificata su un arco di tempo di 40 o 90 minuti dal numero di volte che l’animale interrompe il fascio di luce. Il comportamento esplorativo diminuisce nel tempo negli animali a iniezione di soluzione salina mentre esplorano completamente lo stabulario. In nove giorni successivi (i dati per quattro giorni rappresentativi sono indicati in ogni colonna), gli animali vengono iniettati con nicotina (1,5 o 2,0 mg / kg, come indicato) e immediatamente introdotto nella scatola di misura. In questo paradigma, l’iniezione di nicotina si traduce in una rapida soppressione dell’attività locomotoria, seguita da un graduale recupero del comportamento esplorativo nel corso del tempo del saggio. I dati qui sono mostrati come media più/meno s.e.m.DOI:
http://dx.doi.org/10.7554/eLife.24771.006
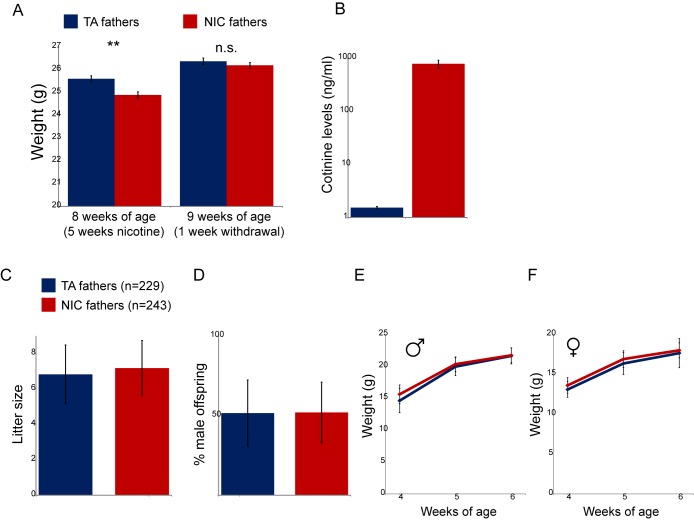
Figura 1-figure supplement 1.2. Effetti fisiologici dell’esposizione alla nicotina sui maschi trattati.(A) Peso dei maschi soggetti a 5 settimane di esposizione alla nicotina (NIC) o soluzione di controllo (TA). I dati sono mostrati per gli animali alla fine di 5 settimane di esposizione alla nicotina (** indica p<0,01), e dopo una settimana di astinenza (n.s.: non significativo), come indicato.(B) Livelli ematici di cotinina, un metabolita relativamente longevo della nicotina, nei maschi (a 8 settimane di età, dopo 5 settimane di trattamento con nicotina/controllo) che consumano soluzioni di controllo o di nicotina.(C) Dimensione media della cucciolata per la prole di maschi di controllo e trattati con nicotina. I dati mostrano la media più/meno s.e.m.(D) Rapporto medio tra i sessi per la prole di controllo e i maschi trattati con nicotina. I dati mostrano la media più/meno s.e.m.(E- F) Pesi medi per la prole maschio (E) e femmina (F)TA e NIC a 4, 5 e 6 settimane di età. I dati sono indicati come media più/meno S.D.DOI:
http://dx.doi.org/10.7554/eLife.24771.004
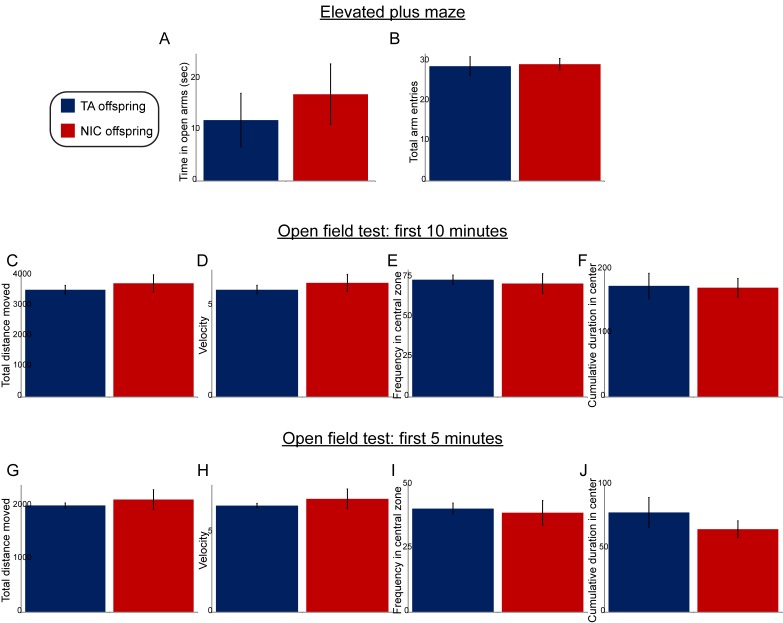
Figura 1-figure supplement 2.L’esposizione paterna alla nicotina non influisce sui comportamenti ansiosi della prole.(A-B) I dati sono mostrati per elevate prestazioni più labirinto più – il tempo trascorso a braccia aperte (A), o ingressi totali nelle braccia aperte (B) – per la prole TA (n = 7) e la prole NIC (n = 11).(C- J) Prestazioni di prova in campo aperto, indicate per i primi 10 min (C- F) o i primi 5 min (G- J) successivi all’introduzione dell’animale nello stabulario. I pannelli mostrano la distanza totale spostata(C,G), la velocità(D,H), la frazione di tempo trascorso al centro dello stabulario a campo aperto(E,I) e il tempo cumulativo trascorso nella zona centrale(F,J). Tutti i dati mostrano una media +/- s.e.m. Nessuna delle differenze tra la prole TA e la prole NIC è statisticamente significativa.DOI:
http://dx.doi.org/10.7554/eLife.24771.005

Figura 1-figure supplement 3.4. Nessun effetto significativo dell’esposizione paterna alla nicotina sulla risposta locomotoria della prole alla nicotina.Per ogni colonna, la prole di controllo e i maschi trattati con nicotina (TA e NIC, rispettivamente) sono stati sottoposti a un test di attività locomotoria come segue. Gli animali sono stati prima acclimatati a iniezioni saline intraperitoneali una volta al giorno per tre giorni. Il terzo giorno (linea di base), la prole è stata iniettata con soluzione fisiologica, poi collocata in un nuovo ambiente – una scatola dotata di fotodiodi a infrarossi per consentire il rilevamento di attività locomotoria. Gli animali iniettati di soluzione salina esplorano attivamente il nuovo ambiente, e l’attività locomotoria è quantificata su un arco di tempo di 40 o 90 minuti dal numero di volte che l’animale interrompe il fascio di luce. Il comportamento esplorativo diminuisce nel tempo negli animali a iniezione di soluzione salina mentre esplorano completamente lo stabulario. In nove giorni successivi (i dati per quattro giorni rappresentativi sono riportati in ogni colonna), gli animali vengono iniettati con nicotina (1,5 o 2,0 mg/kg, come indicato) e immediatamente introdotti nella scatola di misurazione. In questo paradigma, l’iniezione di nicotina si traduce in una rapida soppressione dell’attività locomotoria, seguita da un graduale recupero del comportamento esplorativo nel corso del tempo del saggio. I dati qui sono mostrati come media più/meno s.e.m.DOI:
http://dx.doi.org/10.7554/eLife.24771.006
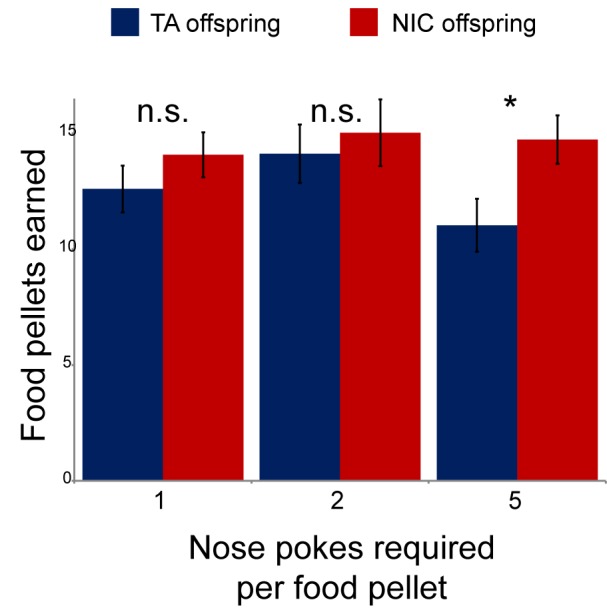
Figura 2-figure supplement 1.L’esperienza paterna influisce sulla tossicità della nicotina, ma non sull’autosomministrazione, nella prole.la prole dei padri esposti alla nicotina mostra una protezione significativa dalla tossicità della nicotina.la prole dei padri esposti alla nicotina mostra una protezione significativa dalla tossicità della nicotina.modesto effetto dell’esposizione paterna alla nicotina sulla formazione alimentare.(A) L’esposizione paterna alla nicotina non influisce sull’autosomministrazione della nicotina nella prole. Ogni giorno, un topo addestrato ad autosomministrare la nicotina (Materiali e metodi) è stato collegato all’apparato di autosomministrazione per un’ora, con la dose di nicotina somministrata tramite cannula per ogni corretta puntura del naso che si è scatenata ogni 4-8 giorni, come indicato. La nicotina totale autosomministrabile viene mostrata per ogni giorno del protocollo come media e s.e.m. Si noti che il numero di animali partecipanti alla prova è diminuito nel tempo a causa della rimozione dal protocollo (catetere ostruito) o della morte – la n elencata rappresenta tutti gli animali che sono rimasti sul protocollo fino alla morte.(B) I discendenti di padri esposti alla nicotina mostrano una protezione significativa dalla tossicità della nicotina. La curva di sopravvivenza è mostrata per tutti gli animali sul protocollo di autosomministrazione (i dati sottostanti sono forniti in Figura 2 dati fonte 1). La progenie esposta alla nicotina ha mostrato un significativo aumento della sopravvivenza durante il corso del test rispetto alla progenie di controllo (curva di sopravvivenza Kaplan-Meyer, p<0.0001 sia per il test Log-rank che per il test Gehan-Breslow-Wilcoxon).DOI:
http://dx.doi.org/10.7554/eLife.24771.00710.7554/eLife.24771.008Cifra dati a 2 fonti 1.I figli di padri esposti alla nicotina mostrano una protezione significativa dalla tossicità della nicotina.Curva di sopravvivenza per tutti gli animali sul protocollo di autosomministrazione della nicotina.DOI:http://dx.doi.org/10.7554/eLife.24771.008Curva di sopravvivenza per tutti gli animali sul protocollo di autosomministrazione della nicotina.DOI:
http://dx.doi.org/10.7554/eLife.24771.008Curva di sopravvivenza per tutti gli animali sul protocollo di autosomministrazione della nicotina.DOI:
http://dx.doi.org/10.7554/eLife.24771.008A seguito dell’impianto chirurgico di una linea centrale, i figli di TA e NIC sono stati autorizzati a guarire per 3 giorni. Gli animali sono stati poi sottoposti a restrizione calorica (80% della dieta giornaliera w/w rispetto agli animali che si nutrono ad libitum), collocati in una scatola di autosomministrazione con due pulsanti, uno dei quali era contrassegnato da una piccola luce. Gli animali sono stati poi forniti di pellet di saccarosio in risposta ad un punch al naso sul pulsante acceso – per 3 giorni è stato fornito un pellet a seguito di ogni punch al naso corretto, poi per un altro giorno sono stati richiesti due punch al naso per un pellet, e infine cinque punch al naso sono stati richiesti per un pellet alimentare per 3 giorni. Le barre qui mostrano il numero di pellet alimentari guadagnati in 1 ora per la prole TA e NIC – la prole NIC ha guadagnato moderatamente più pellet di saccarosio nel regime di ricompensa finale rispetto alla prole TA (p=0,03). Questa formazione alimentare migliorata ha portato al primo giorno di autosomministrazione della nicotina(Figura 2A), quando gli animali NIC si autosomministravano un po’ più di nicotina rispetto agli animali AT, ma questa differenza persisteva solo per il primo giorno.DOI:
http://dx.doi.org/10.7554/eLife.24771.009

Figura 2-figure supplement 1.2. Modesto effetto dell’esposizione paterna alla nicotina sull’allenamento dietetico.A seguito dell’impianto chirurgico di una linea centrale, la TA e la discendenza NIC sono stati autorizzati a recuperare per 3 giorni. Gli animali sono stati poi sottoposti a restrizione calorica (80% della dieta giornaliera rispetto agli animali che si nutrono ad libitum), collocati in una scatola per l’autosomministrazione con due pulsanti, uno dei quali era contrassegnato da una piccola luce. Gli animali sono stati poi forniti di pellet di saccarosio in risposta ad un punch al naso sul pulsante acceso – per 3 giorni è stato fornito un pellet a seguito di ogni punch al naso corretto, poi per un altro giorno sono stati richiesti due punch al naso per un pellet, e infine cinque punch al naso sono stati richiesti per un pellet alimentare per 3 giorni. Le barre qui mostrano il numero di pellet alimentari guadagnati in 1 ora per la prole TA e NIC – la prole NIC ha guadagnato moderatamente più pellet di saccarosio nel regime di ricompensa finale rispetto alla prole TA (p=0,03). Questa formazione alimentare migliorata ha portato al primo giorno di autosomministrazione della nicotina(Figura 2A), quando gli animali NIC si autosomministravano un po’ più di nicotina rispetto agli animali AT, ma questa differenza persisteva solo per il primo giorno.DOI:
http://dx.doi.org/10.7554/eLife.24771.009
I discendenti di maschi trattati con nicotina presentano una maggiore resistenza alla tossicità della nicotina
Ciononostante, un chiaro fenotipo è emerso serendipidamente dal paradigma SA. Abbiamo scoperto che nel nostro background di ceppo, il crescente programma di dosaggio della nicotina di SA ha portato alla morte di quasi tutti gli animali testati alle dosi più alte utilizzate. Sorprendentemente, la prole NIC è sopravvissuta per molti più giorni, in media, rispetto alla prole TA(Figura 2B). Questa differenza di sopravvivenza è stata molto significativa (Gehan-Breslow-Wilcoxon p<0,0001). Poiché non c’è stata alcuna differenza nei livelli giornalieri di nicotina somministrati da entrambi i gruppi(Figura 2A), questo risultato suggerisce che l’esposizione paterna alla nicotina può proteggere la prole dalla tossicità della nicotina.
Poiché la TA e la prole NIC mostrano differenze nella loro resistenza a dosi letali di nicotina nonostante non ci sia differenza nel livello giornaliero di nicotina consumata, abbiamo chiesto se l’effetto dell’esposizione paterna alla nicotina sulla sopravvivenza della prole può essere ricapitolato usando una sfida di nicotina a dose singola, piuttosto che il laborioso protocollo di autosomministrazione descritto sopra. Questa sfida alla nicotina è stata eseguita usando due paradigmi distinti. In primo luogo, abbiamo semplicemente sfidato la prole del controllo o i padri della nicotina con un’iniezione di nicotina a dose singola – questi animali “ingenui” non avevano avuto in precedenza alcuna esposizione diretta alla nicotina. Inoltre, abbiamo ragionato che, poiché gli animali nel paradigma dell’autosomministrazione consumavano nicotina per diverse settimane prima dell’eventuale esposizione a livelli letali del farmaco(Figura 2B), ci si aspetterebbe che questo alterasse sostanzialmente la biologia correlata alla nicotina nell’animale testato. Abbiamo quindi anche sottoposto la prole TA e NIC a una settimana di nicotina cronica a basso dosaggio (fornita nell’acqua potabile) – ci riferiamo a questi animali come la coorte ‘cronica’ – poi abbiamo sfidato questi animali con un’iniezione di una singola dose di nicotina LD50.
Come mostrato nella Figura 3A, la naïve TA e la progenie NIC non hanno mostrato alcuna differenza significativa nella suscettibilità ad un’iniezione di nicotina tossica, indicando che l’esposizione paterna alla nicotina non programma uno stato costitutivamente resistente alla nicotina. Al contrario, e coerentemente con i risultati del test di autosomministrazione, la prole maschile (ma non femminile) dei padri esposti alla nicotina è diventata significativamente più tollerante a una sfida letale alla nicotina rispetto alla prole di controllo(Figura 3B), ma solo una volta che si è acclimatata a una settimana di nicotina cronica. Presi insieme, questi dati dimostrano che la prole maschio dei padri esposti alla nicotina mostra una maggiore capacità di sviluppare tolleranza alle dosi tossiche di nicotina, ma che questa tolleranza è rivelata solo dopo una precedente esposizione a livelli subletali di nicotina.10.7554/eLife.24771.010Figure 3.Paternally-induced protection from nicotine toxicity is primed by nicotine exposure in offspring.(A) Sopravvivenza della prole TA o NIC dopo una singola iniezione di nicotina alla dose indicata. Sopra ogni barra, la frazione mostra il numero di animali sopravvissuti rispetto al numero di animali iniettati. Per tutte e quattro le dosi testate, non c’è stata alcuna differenza significativa di tossicità tra la progenie TA e NIC (p>0,7 in tutte e quattro le dosi per i maschi, p>0,8 per le femmine).(B) Sopravvivenza della prole TA e NIC dopo una singola iniezione di nicotina a circa la LD50 per gli animali ingenui in (A)– 7,2 mg / kg per la prole maschio, mostrato nel pannello superiore, 5,04 mg / kg per le femmine, mostrato nel pannello inferiore. Qui, la prole è stata acclimatata alla nicotina cronica nella loro acqua potabile per 6 giorni, con la sfida nicotina è stata somministrata 24 ore dopo l’ultimo giorno di consumo di nicotina.DOI:http://dx.doi.org/10.7554/eLife.24771.010
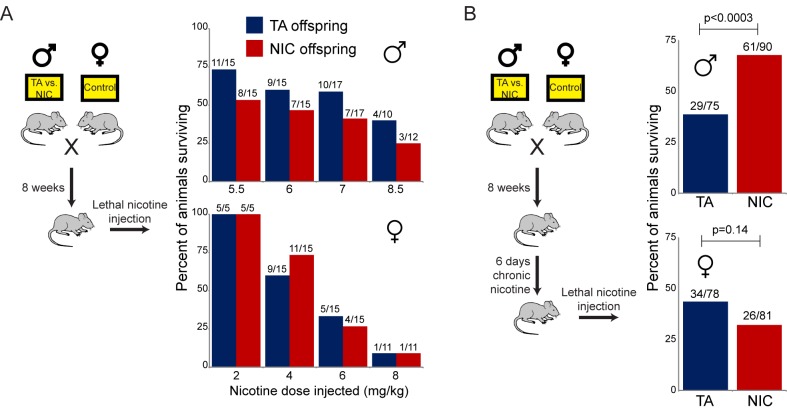
Figura 3.La protezione indotta dalla paternale dalla tossicità della nicotina è innescata dall’esposizione alla nicotina nella prole.(A) Sopravvivenza della prole TA o NIC dopo una singola iniezione di nicotina alla dose indicata. Sopra ogni barra, la frazione mostra il numero di animali sopravvissuti rispetto al numero di animali iniettati. Per tutte e quattro le dosi testate, non c’è stata alcuna differenza significativa di tossicità tra la progenie TA e NIC (p>0,7 in tutte e quattro le dosi per i maschi, p>0,8 per le femmine).(B) Sopravvivenza della prole TA e NIC dopo una singola iniezione di nicotina a circa la LD50 per gli animali ingenui in (A)– 7,2 mg / kg per la prole maschio, mostrato nel pannello superiore, 5,04 mg / kg per le femmine, mostrato nel pannello inferiore. Qui, la prole è stata acclimatata alla nicotina cronica nella loro acqua potabile per 6 giorni, con la sfida nicotina è stata somministrata 24 ore dopo l’ultimo giorno di consumo di nicotina.DOI:
http://dx.doi.org/10.7554/eLife.24771.010
L’esposizione paterna alla nicotina influisce sulla clearance xenobiotica nella prole
Qual è la base fisiologica della maggiore resistenza alla tossicità della nicotina osservata nella prole NIC rispetto alla prole TA? Le dosi letali di nicotina inducono convulsioni che hanno origine nell’ippocampo(Fonck et al., 2003). La resistenza a tali convulsioni potrebbe derivare da meccanismi di resistenza altamente specifici come il downregulation dei recettori nicotinici dell’acetilcolina nell’ippocampo, o da meccanismi di resistenza relativamente aspecifici come una maggiore disintossicazione degli xenobiotici nel fegato. Anche se non possiamo escludere definitivamente una base neurale per l’aumentata resistenza alla nicotina osservata nella prole NIC, diverse linee di prova – tra cui l’analisi estesa RNA-Seq dell’ippocampo isolato – sostengono contro questa resistenza derivante da una fisiologia neurale alterata (Figura 4-figuresupplement 1, file supplementare 1).
In contrasto con la mancanza di cambiamenti molecolari rilevanti osservati nel cervello della prole NIC, abbiamo scoperto un effetto significativo dell’esposizione paterna alla nicotina sulla disintossicazione epatica della nicotina nella prole. Come mostrato nella Figura 4A, la prole NIC acclimatata alla nicotina mostra livelli significativamente più elevati di cotinina del metabolita della nicotina a lunga vita in punti temporali precedenti dopo l’iniezione di nicotina rispetto alla prole TA. Questo risultato è coerente con il miglioramento della clearance della nicotina alla base del fenotipo di resistenza alla nicotina mostrato da questi animali, suggerendo che l’esposizione paterna alla nicotina programma uno stato di maggiore tolleranza metabolica nella prole.10.7554/eLife.24771.011Figure 4.Paternal esposizione alla nicotina induce una risposta protettiva esagerata agli xenobiotici.(A) L’esposizione paterna alla nicotina migliora il metabolismo della nicotina nella prole. Maschio TA e la prole NIC sono stati acclimatati alla nicotina per 6 giorni, poi 24 ore dopo sono stati iniettati con 1,5 mg / kg di nicotina. I livelli sierici del metabolita della nicotina a lunga vita cotinina sono stati misurati nei tempi indicati dopo l’iniezione di nicotina, con significativamente (p<0,0002, t-test con correzione Holm-Sidak) elevati livelli di cotinina che sono stati osservati al primo punto temporale analizzato, indicando una maggiore clearance della nicotina nella prole NIC.(B) Schema di epatocita RNA-Seq esperimento.(C) Cluster di epatociti RNA-Seq dataset di epatociti. Per ogni gruppo di trattamento paterno (TA o NIC), i dati sono mostrati per dieci singoli figli maschi provenienti da dieci cucciolate separate, con epatociti di cinque animali anche in coltura per tempi variabili (da 0 a 21 ore) dopo l’isolamento. I dati sono z punteggio normalizzato per ogni punto di tempo di coltura. La mappa termica mostra 60 geni (filtrati per l’espressione media >25 ppm) che cambiano con un valore multiplo di p corretto per ipotesi<0,1. I dati sottostanti sono forniti in Figura 4 dati fonte 1.(D) I geni upregolati nella discendenza NIC codificano gli enzimi coinvolti in tutte e tre le fasi del metabolismo xenobiotico, come indicato.(E) Categorie di Ontologia Gene selezionato arricchito tra i geni upregulated (corretto p<0,1) in epatociti NIC.(F) Copertura ATAC-Seq per TA e epatociti NIC, come indicato, in Nr1i3. Si veda anche la Figura 4-figure supplement 3.DOI:http://dx.doi.org/10.7554/eLife.24771.01110.7554/eLife.24771.012Figure4-source data 1.Cluster di epatociti RNA-Seq dataset.RNA-Seq dati per gli epatociti ottenuti dalla discendenza TA e NIC, mostrando 60 geni (filtrati per l’espressione media >25 ppm) che cambiano con un multiplo ipotesi-corretta p valore <0.1. I dati sono z punteggio normalizzato per ogni punto temporale della cultura.DOI:http://dx.doi.org/10.7554/eLife.24771.01210.7554/eLife.24771.013Figuresupplemento a 4 cifre 1.La nicotina paterna non ha effetti significativi sulla regolazione genica ippocampale della prole o attività neurale. (A-B) RNA-Seq di ippocampo isolato dalla prole TA e NIC. Scatterplot mostrano l’abbondanza media di mRNA (tpm minimo di 10), con l’asse x che mostra la media per la prole TA e l’asse y che mostra la media per la prole NIC.(A) mostra i dati per gli animali dell’AT e della NIC che non avevano sperimentato la nicotina (“naïve”), (B) mostrai dati per gli animali forniti di nicotina cronica per 6 giorni. Non ci sono effetti significativi dell’esposizione paterna alla nicotina su qualsiasi mRNA in entrambe le condizioni. Risultati simili sono stati ottenuti in studi preliminari della zona tegmentale ventrale, nucleus accumbens, e la corteccia prefrontale (non mostrato). È importante notare che, mentre recenti rapporti documentano un aumento dell’abbondanza di mRNA Igf2 nell’ippocampo della prole maschio di 8 settimane di età di padri stressati(Short et al., 2016), non abbiamo osservato alcun cambiamento significativo nei livelli di Igf2 nella prole NIC (vedi file supplementare 1), fornendo un altro argomento contro l’ipotesi che il nostro paradigma di esposizione paterna alla nicotina colpisce la prole attraverso una risposta paterna allo stress.(C-D) Il trattamento paterno con nicotina non influisce sull’attività neurale della prole nell’ippocampo. Immagini rappresentative che mostrano la colorazione c-fos come proxy per l’attività neurale nell’ippocampo isolato dalla prole TA(C) e NIC(D). Qui, gli animali sono stati messi su nicotina cronica (200 µg/ml nicotina libera base) per sei giorni. Dopo 24 ore senza nicotina, gli animali sono stati iniettati con 1,5 mg / kg di nicotina libera base. Il tessuto è stato raccolto 90 min dopo l’iniezione.(E) Quantificazione dei dati di colorazione c-fos. L’asse Y mostra il numero di neuroni c-fos-positivi nel giro dentato per la prole nicotina iniettata TA (n = 12), e NIC (n = 13). Diverse linee di prova sostengono quindi contro la resistenza ai farmaci della prole NIC derivante dalla fisiologia neurale alterata. In primo luogo, il fatto che gli animali acclimatati ai farmaci mostrano una maggiore resistenza sia alla nicotina che alla tossicità della cocaina(Figure 3 e 5) esclude meccanismi di downregulation o desensibilizzazione dei recettori dell’acetilcolina nicotinica o del recettore della dopamina. In secondo luogo, l’analisi RNA-Seq di diverse regioni cerebrali – ippocampo, area tegmentale ventrale, accumbens nucleo e corteccia prefrontale – ha rivelato effetti minimi di esposizione paterna alla nicotina sul trascrittoma. Infine, non abbiamo trovato differenze significative nei modelli di colorazione del marcatore di attività c-fos nell’ippocampo della prole TA e NIC. Così, mentre non possiamo escludere definitivamente una base neurale per i fenotipi osservati nella prole NIC, non abbiamo trovato alcuna prova a sostegno di tale ipotesi.DOI:http://dx.doi.org/10.7554/eLife.24771.01310.7554/eLife.24771.014Figuresupplemento a 4 cifre 2.L’esposizione paterna alla nicotina colpisce fenotipi multipli nella prole. (A-B) La tolleranza al glucosio (A) e la tolleranza all’insulina (B) sono significativamente alterate nella prole NIC rispetto alla prole TA. I livelli plasmatici di glucosio sono mostrati per sei maschi di discendenza NIC o TA in tempi diversi dopo un bolo di glucosio di 2 g/kg a 7 settimane di età(A), o un bolo di insulina di 0,75 U/kg a 10 settimane di età(B). * e ** rappresentano valori p di <0,05 e <0,01, rispettivamente (test t).(C) dati q-RT-PCR per i geni indicati. In ogni caso, il livello di espressione (dopo la normalizzazione ad Actb e Gapdh) è tracciato rispetto al livello di espressione medio per 4 fegati TA (n = 6 fegati NIC), con barre che mostrano la media e s.e.m. DOI:http://dx.doi.org/10.7554/eLife.24771.01410.7554/eLife.24771.015Figure 4-figure supplement 3.Global differences in hepatocyte chromatin architecture between TA and NIC offspring.Aggregated ATAC-Seq data for hepatocytes isolated from TA and NIC offspring (n = 4 animali ciascuno, con campioni trattati con desametasone e non trattati per ogni animale).(A) Differenze di scala multimegabasica nel paesaggio di accessibilità degli epatociti TA e NIC. I due pannelli superiori mostrano i dati ATAC-Seq per la discendenza NIC e TA per il cromosoma 6, insieme a un punteggio medio NIC-TA, seguito dalla densità genica. Per il cromosoma 7, sono mostrati solo NIC-TA e densità genica. Le caselle rosse evidenziano un sottoinsieme di regioni genomiche a bassa densità genica in cui gli epatociti TA mostrano un segnale ATAC-Seq maggiore rispetto agli epatociti NIC. Al contrario, le regioni a densità genica generalmente mostrano un segnale ATAC più elevato negli epatociti NIC (non evidenziato). La base meccanicistica di questa differenza globale non è chiara – non sembra riflettere la contaminazione dei campioni di ATAC con cellule morte, per esempio, in quanto questi campioni (da animali nicotina-naïve) non differivano in vitalità, e la placcatura degli epatociti seleziona anche efficacemente contro le cellule morte. Poiché le distribuzioni di lunghezza dei frammenti erano coerenti da una biblioteca all’altra, sembra anche improbabile che ci fossero grosse differenze nella concentrazione o nell’attività del Tn5 aggiunto. Tuttavia, mentre questa differenza potrebbe riflettere una biologia significativa, come ad esempio una differenza globale nella condensazione dell’eterocromatina, le differenze globali in qualsiasi saggio a livello genomico dovrebbero naturalmente essere viste con scetticismo.(B) I dati ATAC-Seq per 500 bp che circondano tutti i siti di inizio trascrizione annotati (TSS), ordinati da alta a bassa intensità media del segnale ATAC.(C) L’aumento del segnale ATAC in epatociti NIC viene mostrato per tutti i TSS, o siti di rilegatura RXRA o LXRB, come indicato.(D- H) Esempi di loci che mostrano una maggiore accessibilità della cromatina nella discendenza NIC, rispetto alla discendenza TA.(D- E) mostrano tracce ATAC-Seq in cui i dati TA e NIC sono impostati sulla stessa gamma verticale, come nella Figura 4F. Per i pannelli F-H, gli assi y sono impostati indipendentemente per i set di dati TA e NIC, correggendo visivamente le differenze globali tra i set di dati TA e NIC. In questi pannelli, un sottoinsieme di picchi significativamente arricchiti di NIC(file supplementare 3) sono indicati con delle frecce.DOI:http://dx.doi.org/10.7554/eLife.24771.015
Qual è la base molecolare per la disintossicazione da nicotina potenziata osservata nella prole NIC? Poiché il fegato è il sito primario della nicotina e di altri clearance xenobiotici nei mammiferi, abbiamo studiato i cambiamenti nell’abbondanza di mRNA negli epatociti isolati dalla prole TA e NIC(Figura 4B-C, file supplementare 2). L’esposizione paterna alla nicotina in modo significativo (regolato p<0,05) ha influenzato i livelli di espressione di 51 geni, con i geni upregulated essere significativamente arricchito per coloro che sono coinvolti nel metabolismo lipidico (p = 3,9e-14), catabolismo aminoacidico (p = 6,6e-8), e varie annotazioni mitocondriali tra cui membrana mitocondriale (p = 1,9e-7) (Figura4D-E, Figura 4-figure supplemento 2A-B). In particolare, data la resistenza alla nicotina osservata a livello organismico, anche gli epatociti NIC hanno mostrato una maggiore espressione dei geni coinvolti nel metabolismo dei farmaci (p=4.3e-6), con geni upregolati, tra cui gli enzimi di disintossicazione della “Fase I” (Cyp1a2,Cyp2c68) e della “Fase II” (Ugt2a3, Ugt2b1,Sult1d1, e Sult1a1 ), ‘trasportatori a membrana di fase III’ (Slco1a4), così come i geni che codificano i recettori degli ormoni nucleari xenobiologici CAR e PXR (Nr1h3e Nr1i2 ) (Figura 4C-D). Inoltre, il citocromo primario coinvolto nella clearance nicotina nei roditori, Cyp2a5, è stato upregulated ~ 2 volte in media in epatociti NIC. Anche se questa upregolazione non è stata significativa (corretto p = 0,2) nel set di dati a livello genomico a causa della variabilità campione per campione in espressione di questo gene, abbiamo convalidato upregolazione di Cyp2a5 in ulteriori fegati intatti (n = 6 NIC, n = 4 TA, p<0,01) da q-RT-PCR (Figura 4-figuresupplemento 2C).
Questi studi di espressione genica rivelano quindi che, rispetto agli epatociti TA, gli epatociti NIC mostrano una derepressione generale dei geni bersaglio per una vasta gamma di recettori ormonali nucleari. Per indagare le basi meccanicistiche di questa derepressione, abbiamo caratterizzato il genoma della cromatina aperta a livello genomico negli epatociti TA e NIC (n = 8 campioni ciascuno) utilizzando ATAC-Seq (Buenrostroet al., 2015). Il nostro dataset ATAC-Seq ha mostrato le caratteristiche previste, come forti picchi di accessibilità rispetto ai promotori e altri elementi normativi(Figura 4-figure supplement 3). Confrontando i dataset di TA e NIC, abbiamo osservato una differenza globale coerente nell’accessibilità complessiva della cromatina – i picchi normalizzati di ATAC agli elementi regolatori erano quasi 2 volte più alti negli epatociti NIC rispetto agli epatociti TA, mentre gli epatociti TA mostravano un background di trasposizione costantemente più alto in tutte le regioni del genoma lontane dagli elementi regolatori (Figura 4-figure supplement 3A-C). Qualunque sia la base di questo cambiamento globale nell’accessibilità della cromatina, abbiamo inoltre identificato 1861 picchi di accessibilità della cromatina(Figura 4F, Figura 4-figure supplement 3D-H, Supplementary file 3) che differiscono significativamente tra gli epatociti TA e quelli NIC dopo aver corretto la differenza globale di altezza dei picchi tra questi campioni. Coerentemente con le variazioni dell’abbondanza di mRNA osservate negli epatociti, questi picchi sono stati significativamente arricchiti vicino ai geni coinvolti nel metabolismo lipidico (p=2,8e-18) e nel metabolismo xenobiotico (p=1,3e-6), insieme a molte categorie GO correlate. Concludiamo che una storia di esposizione paterna ai farmaci può influenzare il paesaggio della cromatina degli epatociti nella prole, con un conseguente ampio aumento dell’accessibilità agli elementi regolatori coinvolti nel metabolismo e nella disintossicazione.
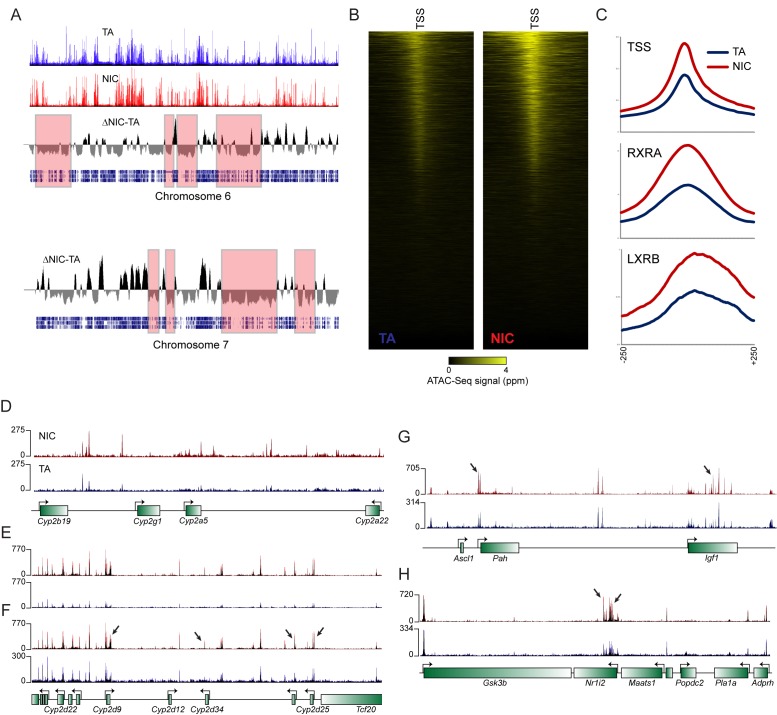
Figura 4-figure supplement 3.L’esposizione paterna alla nicotina induce una risposta protettiva esagerata agli xenobiotici.cluster di dati RNA-Seq dell’epatociti.cluster di dati RNA-Seq dell’epatociti.la nicotina paterna non ha effetti significativi sulla regolazione del gene ippocampale della prole o sull’attività neurale.l’esposizione paterna alla nicotina influisce su fenotipi multipli nella prole.differenze globali nell’architettura della cromatina degli epatociti tra la prole TA e la prole NIC.(A) L’esposizione paterna alla nicotina migliora il metabolismo della nicotina nella prole. Maschio TA e la prole NIC sono stati acclimatati alla nicotina per 6 giorni, poi 24 ore dopo sono stati iniettati con 1,5 mg / kg di nicotina. I livelli sierici del metabolita della nicotina a lunga vita cotinina sono stati misurati nei tempi indicati dopo l’iniezione di nicotina, con significativamente (p<0,0002, t-test con correzione Holm-Sidak) elevati livelli di cotinina che sono stati osservati al primo punto temporale analizzato, indicando una maggiore clearance della nicotina nella prole NIC.(B) Schema di epatocita RNA-Seq esperimento.(C) Cluster di epatociti RNA-Seq dataset di epatociti. Per ogni gruppo di trattamento paterno (TA o NIC), i dati sono mostrati per dieci singoli figli maschi provenienti da dieci cucciolate separate, con epatociti di cinque animali anche in coltura per tempi variabili (da 0 a 21 ore) dopo l’isolamento. I dati sono z punteggio normalizzato per ogni punto di tempo di coltura. La mappa termica mostra 60 geni (filtrati per l’espressione media >25 ppm) che cambiano con un valore multiplo di p corretto per ipotesi<0,1. I dati sottostanti sono forniti in Figura 4 dati fonte 1.(D) I geni upregolati nella discendenza NIC codificano gli enzimi coinvolti in tutte e tre le fasi del metabolismo xenobiotico, come indicato.(E) Categorie di Ontologia Gene selezionato arricchito tra i geni upregulated (corretto p<0,1) in epatociti NIC.(F) Copertura ATAC-Seq per TA e epatociti NIC, come indicato, in Nr1i3. Vedi anche la figura 4-figure supplement 3.DOI:
http://dx.doi.org/10.7554/eLife.24771.01110.7554/eLife.24771.012Cifra dati a 4 fonti 1.Cluster di dati RNA-Seq per epatociti ottenuti da discendenti TA e NIC, mostrando 60 geni (filtrati per un’espressione media >25 ppm) che cambiano con un valore p multiplo di p corretto per ipotesi <0,1. I dati sono z punteggio normalizzato per ogni punto temporale della cultura.DOI:http://dx.doi.org/10.7554/eLife.24771.012Dati RNA-Seq per epatociti ottenuti da discendenti TA e NIC, che mostrano 60 geni (filtrati per un’espressione media >25 ppm) che cambiano con un valore p multiplo di ipotesi corrette <0,1. I dati sono z punteggio normalizzato per ogni punto temporale della cultura.DOI:
http://dx.doi.org/10.7554/eLife.24771.012Dati RNA-Seq per epatociti ottenuti da discendenti TA e NIC, che mostrano 60 geni (filtrati per un’espressione media >25 ppm) che cambiano con un valore p multiplo di ipotesi corrette <0,1. I dati sono z punteggio normalizzato per ogni punto temporale della cultura.DOI:
http://dx.doi.org/10.7554/eLife.24771.012(A-B) RNA-Seq dell’ippocampo isolato dalla discendenza TA e NIC. Gli scatterplot mostrano l’abbondanza media di mRNA (tpm minimo di 10), con l’asse x che mostra la media per la prole TA e l’asse y che mostra la media per la prole NIC.(A) mostra i dati per gli animali dell’AT e della NIC che non avevano sperimentato la nicotina (“naïve”), (B) mostrai dati per gli animali forniti di nicotina cronica per 6 giorni. Non ci sono effetti significativi dell’esposizione paterna alla nicotina su qualsiasi mRNA in entrambe le condizioni. Risultati simili sono stati ottenuti in studi preliminari dell’area tegmentale ventrale, nucleus accumbens, e la corteccia prefrontale (non mostrato). È importante notare che, mentre recenti rapporti documentano un aumento dell’abbondanza di mRNA Igf2 nell’ippocampo della prole maschio di 8 settimane di età di padri stressati(Short et al., 2016), non abbiamo osservato alcun cambiamento significativo nei livelli di Igf2 nella prole NIC (vedi file supplementare 1), fornendo un altro argomento contro l’ipotesi che il nostro paradigma di esposizione paterna alla nicotina colpisce la prole attraverso una risposta paterna allo stress.(C-D) Il trattamento paterno con nicotina non influisce sull’attività neurale della prole nell’ippocampo. Immagini rappresentative che mostrano la colorazione c-fos come proxy per l’attività neurale nell’ippocampo isolato dalla prole TA(C) e NIC(D). Qui, gli animali sono stati messi su nicotina cronica (200 µg/ml nicotina libera base) per sei giorni. Dopo 24 ore senza nicotina, gli animali sono stati iniettati con 1,5 mg / kg di nicotina libera base. Il tessuto è stato raccolto 90 min dopo l’iniezione.(E) Quantificazione dei dati di colorazione c-fos. L’asse Y mostra il numero di neuroni c-fos-positivi nel giro dentato per la prole nicotina iniettata TA (n = 12), e NIC (n = 13). Diverse linee di prova sostengono quindi contro la resistenza ai farmaci della prole NIC derivante dalla fisiologia neurale alterata. In primo luogo, il fatto che gli animali acclimatati ai farmaci mostrano una maggiore resistenza sia alla nicotina che alla tossicità della cocaina(Figure 3 e 5) esclude meccanismi di downregulation o desensibilizzazione dei recettori dell’acetilcolina nicotinica o del recettore della dopamina. In secondo luogo, l’analisi RNA-Seq di diverse regioni cerebrali – ippocampo, area tegmentale ventrale, accumbens nucleo e corteccia prefrontale – ha rivelato effetti minimi di esposizione paterna alla nicotina sul trascrittoma. Infine, non abbiamo trovato differenze significative nei modelli di colorazione del marcatore di attività c-fos nell’ippocampo della prole TA e NIC. Così, mentre non possiamo escludere definitivamente una base neurale per i fenotipi osservati nella prole NIC, non abbiamo trovato alcuna prova a sostegno di tale ipotesi.DOI:
http://dx.doi.org/10.7554/eLife.24771.013(A-B) La tolleranza alglucosio(A) e la tolleranza all’insulina (B) sono significativamente alterate nella prole NIC rispetto alla prole TA. I livelli plasmatici di glucosio sono mostrati per sei figli maschi NIC o TA in tempi diversi dopo un bolo di glucosio di 2 g/kg a 7 settimane di età(A), o un bolo di insulina di 0,75 U/kg a 10 settimane di età(B). * e ** rappresentano valori p di <0,05 e <0,01, rispettivamente (test t).(C) dati q-RT-PCR per i geni indicati. In ogni caso, il livello di espressione (dopo la normalizzazione ad Actb e Gapdh) è tracciato rispetto al livello di espressione medio per 4 fegati TA (n = 6 fegati NIC), con barre che mostrano la media e s.e.m.DOI:
http://dx.doi.org/10.7554/eLife.24771.014Dati aggregati ATAC-Seq per gli epatociti isolati dalla discendenza TA e NIC (n = 4 animali ciascuno, con campioni desametati e non trattati per ogni animale).(A) Differenze di scala multimegabasica nel paesaggio di accessibilità degli epatociti TA e NIC. I due pannelli superiori mostrano i dati ATAC-Seq per la discendenza NIC e TA per il cromosoma 6, insieme a un punteggio medio NIC-TA, seguito dalla densità genica. Per il cromosoma 7, sono mostrati solo NIC-TA e densità genica. Le caselle rosse evidenziano un sottoinsieme di regioni genomiche a bassa densità genica in cui gli epatociti TA mostrano un segnale ATAC-Seq maggiore rispetto agli epatociti NIC. Al contrario, le regioni a densità genica generalmente mostrano un segnale ATAC più elevato negli epatociti NIC (non evidenziato). La base meccanicistica di questa differenza globale non è chiara – non sembra riflettere la contaminazione dei campioni di ATAC con cellule morte, per esempio, in quanto questi campioni (da animali nicotina-naïve) non differivano in vitalità, e la placcatura degli epatociti seleziona anche efficacemente contro le cellule morte. Poiché le distribuzioni di lunghezza dei frammenti erano coerenti da una biblioteca all’altra, sembra anche improbabile che ci fossero grosse differenze nella concentrazione o nell’attività del Tn5 aggiunto. Tuttavia, mentre questa differenza potrebbe riflettere una biologia significativa, come ad esempio una differenza globale nella condensazione dell’eterocromatina, le differenze globali in qualsiasi saggio a livello genomico dovrebbero naturalmente essere viste con scetticismo.(B) I dati ATAC-Seq per 500 bp che circondano tutti i siti di inizio trascrizione annotati (TSS), ordinati da alta a bassa intensità media del segnale ATAC.(C) L’aumento del segnale ATAC in epatociti NIC viene mostrato per tutti i TSS, o siti di rilegatura RXRA o LXRB, come indicato.(D- H) Esempi di loci che mostrano una maggiore accessibilità della cromatina nella discendenza NIC, rispetto alla discendenza TA.(D- E) mostrano tracce ATAC-Seq in cui i dati TA e NIC sono impostati sulla stessa gamma verticale, come nella Figura 4F. Per i pannelli F-H, gli assi y sono impostati indipendentemente per i set di dati TA e NIC, correggendo visivamente le differenze globali tra i set di dati TA e NIC. In questi pannelli, un sottoinsieme di picchi significativamente arricchiti di NIC(file supplementare 3) sono indicati con delle frecce.DOI:
http://dx.doi.org/10.7554/eLife.24771.015
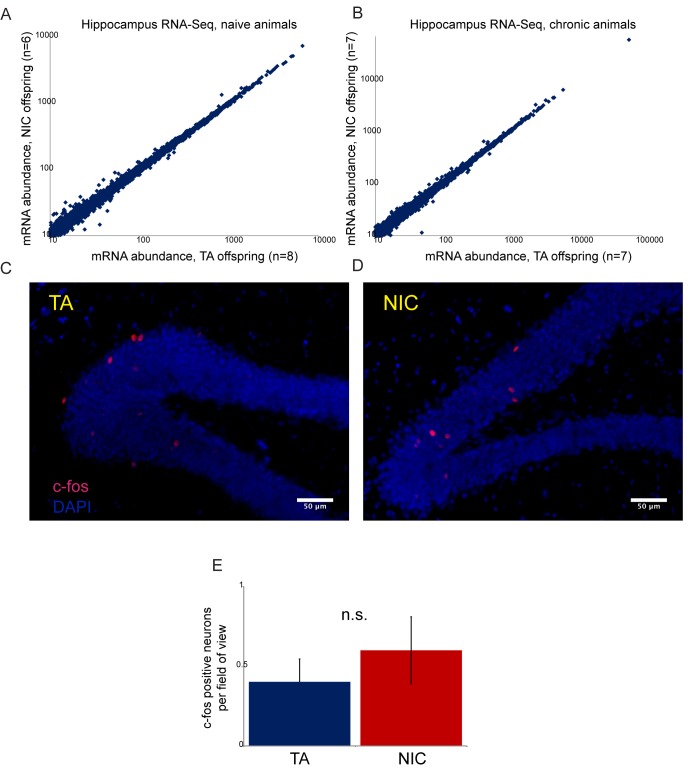
Figura 4-figure supplement 1.La nicotina paterna non ha effetti significativi sulla regolazione del gene ippocampale della prole o sull’attività neurale.(A-B) RNA-Seq dell’ippocampo isolato dalla prole TA e NIC. Scatterplot mostrano l’abbondanza media di mRNA (tpm minimo di 10), con l’asse x che mostra la media per la prole TA e l’asse y che mostra la media per la prole NIC.(A) mostra i dati per gli animali dell’AT e della NIC che non avevano sperimentato la nicotina (“naïve”), (B) mostrai dati per gli animali forniti di nicotina cronica per 6 giorni. Non ci sono effetti significativi dell’esposizione paterna alla nicotina su qualsiasi mRNA in entrambe le condizioni. Risultati simili sono stati ottenuti in studi preliminari della zona tegmentale ventrale, nucleus accumbens, e la corteccia prefrontale (non mostrato). È importante notare che, mentre recenti rapporti documentano un aumento dell’abbondanza di mRNA Igf2 nell’ippocampo della prole maschio di 8 settimane di età di padri stressati(Short et al., 2016), non abbiamo osservato alcun cambiamento significativo nei livelli di Igf2 nella prole NIC (vedi file supplementare 1), fornendo un altro argomento contro l’ipotesi che il nostro paradigma di esposizione paterna alla nicotina colpisce la prole attraverso una risposta paterna allo stress.(C-D) Il trattamento paterno con nicotina non influisce sull’attività neurale della prole nell’ippocampo. Immagini rappresentative che mostrano la colorazione c-fos come proxy per l’attività neurale nell’ippocampo isolato dalla prole TA(C) e NIC(D). Qui, gli animali sono stati messi su nicotina cronica (200 µg/ml nicotina libera base) per sei giorni. Dopo 24 ore senza nicotina, gli animali sono stati iniettati con 1,5 mg / kg di nicotina libera base. Il tessuto è stato raccolto 90 min dopo l’iniezione.(E) Quantificazione dei dati di colorazione c-fos. L’asse Y mostra il numero di neuroni c-fos-positivi nel giro dentato per la prole nicotina iniettata TA (n = 12), e NIC (n = 13). Diverse linee di prova sostengono quindi contro la resistenza ai farmaci della prole NIC derivante dalla fisiologia neurale alterata. In primo luogo, il fatto che gli animali acclimatati ai farmaci mostrano una maggiore resistenza sia alla nicotina che alla tossicità della cocaina(Figure 3 e 5) esclude meccanismi di downregulation o desensibilizzazione dei recettori dell’acetilcolina nicotinica o del recettore della dopamina. In secondo luogo, l’analisi RNA-Seq di diverse regioni cerebrali – ippocampo, area tegmentale ventrale, accumbens nucleo e corteccia prefrontale – ha rivelato effetti minimi di esposizione paterna alla nicotina sul trascrittoma. Infine, non abbiamo trovato differenze significative nei modelli di colorazione del marcatore di attività c-fos nell’ippocampo della prole TA e NIC. Così, mentre non possiamo escludere definitivamente una base neurale per i fenotipi osservati nella prole NIC, non abbiamo trovato alcuna prova a sostegno di tale ipotesi.DOI:
http://dx.doi.org/10.7554/eLife.24771.013
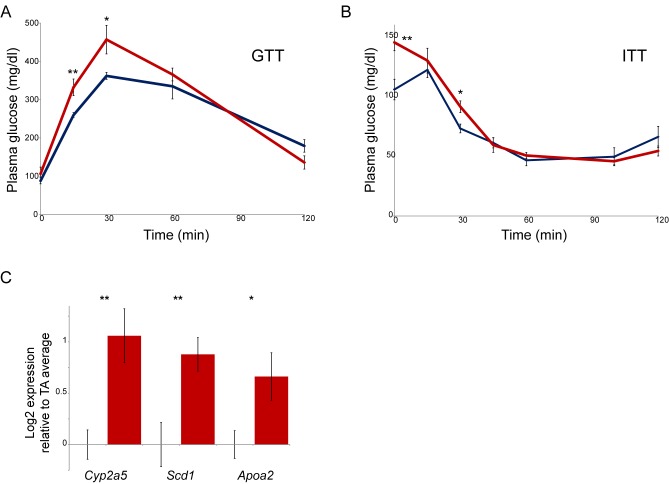
Figura 4-figure supplement 2.L’esposizione paterna alla nicotina colpisce più fenotipi nella prole.(A-B) La tolleranza alglucosio(A) e la tolleranza all’insulina (B) sono significativamente alterate nella prole NIC rispetto alla prole TA. I livelli plasmatici di glucosio sono mostrati per sei maschi di discendenza NIC o TA in tempi diversi dopo un bolo di glucosio di 2 g/kg a 7 settimane di età(A), o un bolo di insulina di 0,75 U/kg a 10 settimane di età(B). * e ** rappresentano valori p di <0,05 e <0,01, rispettivamente (test t).(C) dati q-RT-PCR per i geni indicati. In ogni caso, il livello di espressione (dopo la normalizzazione ad Actb e Gapdh) è tracciato rispetto al livello di espressione medio per 4 fegati TA (n = 6 fegati NIC), con barre che indicano la media e s.e.m.DOI:
http://dx.doi.org/10.7554/eLife.24771.014

Figura 4-figure supplement 3.Differenze globali nell’architettura della cromatina epatocitica tra i discendenti di TA e NIC.4. Dati aggregati ATAC-Seq per gli epatociti isolati dalla discendenza TA e NIC (n = 4 animali ciascuno, con campioni trattati con desametasone e non trattati per ogni animale).(A) Differenze di scala multimegabasica nel paesaggio di accessibilità degli epatociti TA e NIC. I due pannelli superiori mostrano i dati ATAC-Seq per la discendenza NIC e TA per il cromosoma 6, insieme a un punteggio medio NIC-TA, seguito dalla densità genica. Per il cromosoma 7, sono mostrati solo NIC-TA e densità genica. Le caselle rosse evidenziano un sottoinsieme di regioni genomiche a bassa densità genica in cui gli epatociti TA mostrano un segnale ATAC-Seq maggiore rispetto agli epatociti NIC. Al contrario, le regioni a densità genica generalmente mostrano un segnale ATAC più elevato negli epatociti NIC (non evidenziato). La base meccanicistica di questa differenza globale non è chiara – non sembra riflettere la contaminazione dei campioni di ATAC con cellule morte, per esempio, in quanto questi campioni (da animali nicotina-naïve) non differivano in vitalità, e la placcatura degli epatociti seleziona anche efficacemente contro le cellule morte. Poiché le distribuzioni di lunghezza dei frammenti erano coerenti da una biblioteca all’altra, sembra anche improbabile che ci fossero grosse differenze nella concentrazione o nell’attività del Tn5 aggiunto. Tuttavia, mentre questa differenza potrebbe riflettere una biologia significativa, come ad esempio una differenza globale nella condensazione dell’eterocromatina, le differenze globali in qualsiasi saggio a livello genomico dovrebbero naturalmente essere viste con scetticismo.(B) I dati ATAC-Seq per 500 bp che circondano tutti i siti di inizio trascrizione annotati (TSS), ordinati da alta a bassa intensità media del segnale ATAC.(C) L’aumento del segnale ATAC in epatociti NIC viene mostrato per tutti i TSS, o siti di rilegatura RXRA o LXRB, come indicato.(D- H) Esempi di loci che mostrano una maggiore accessibilità della cromatina nella discendenza NIC, rispetto alla discendenza TA.(D- E) mostrano tracce ATAC-Seq in cui i dati TA e NIC sono impostati sulla stessa gamma verticale, come nella Figura 4F. Per i pannelli F-H, gli assi y sono impostati indipendentemente per i set di dati TA e NIC, correggendo visivamente le differenze globali tra i set di dati TA e NIC. In questi pannelli, un sottoinsieme di picchi significativamente arricchiti di NIC(file supplementare 3) sono indicati con delle frecce.DOI:
http://dx.doi.org/10.7554/eLife.24771.015
L’aumento della resistenza allo xenobiotico nella prole NIC non è specifico per la nicotina
È importante notare che il programma di espressione genica osservato negli epatociti isolati comprende un’ampia varietà di geni associati al metabolismo dei farmaci, la maggior parte dei quali non sono specifici per l’eliminazione della nicotina. Per testare l’ipotesi che lo stato di resistenza alla nicotina della prole NIC rifletta una risposta xenobiotica generale, piuttosto che una via di disintossicazione specifica della nicotina, abbiamo chiesto se la prole NIC mostra anche una maggiore resistenza ad un’altra sfida tossica, la cocaina. Poiché la cocaina e la nicotina operano attraverso percorsi molecolari distinti – la cocaina impedisce la ricaptazione della dopamina alla fessura sinaptica legandosi e bloccando il trasportatore della dopamina, mentre la nicotina attiva e desensibilizza i recettori nicotinici dell’acetilcolina – una scoperta di una maggiore tolleranza alla cocaina sarebbe fortemente contraria alla prole NIC che mostra effetti epigenetici specifici sul recettore molecolare diretto della nicotina.
Abbiamo prima valutato la tossicità della cocaina in animali “ingenui” che non erano stati precedentemente esposti direttamente alla nicotina o alla cocaina. Analogamente alle nostre scoperte sulla tossicità della nicotina(Figura 3A), gli animali naïve NIC e TA non hanno mostrato differenze significative nella loro resistenza alla tossicità della cocaina (Figura 5A). Tuttavia, poiché la maggiore capacità della progenie NIC di sopravvivere ai livelli tossici di nicotina è stata rivelata solo dopo la pre-esposizione di questi animali a dosi subletali di nicotina(Figura 3B), abbiamo poi cercato di determinare se l’acclimatazione della progenie NIC alla cocaina potesse indurre uno stato di resistenza alla cocaina. Per rispondere a questa domanda, l’AT e la progenie NIC sono state trattate cronicamente con dosi subletali di cocaina – due volte al giorno iniezioni di 15 mg/kg di cocaina per cinque giorni – prima della sfida con una dose tossica di cocaina. Sorprendentemente, questo protocollo di acclimatazione ha portato ad una maggiore resistenza alla tossicità della cocaina nella prole NIC, rispetto ai controlli TA(Figura 5B), rivelando che la prole NIC sono iper-responsabile agli xenobiotici multipli.10.7554/eLife.24771.016Figure 5.NIC prole sono protetti da xenobiotici multipli.(A) L’esposizione paterna alla nicotina non influenza la suscettibilità della prole nativa della droga alla tossicità della cocaina. Maschio TA e la prole NIC sono stati iniettati con una singola dose di 100 mg / kg di cocaina. La sopravvivenza è mostrata come in Figura 3.(B) L’acclimatazione della prole TA e NIC alla nicotina o alla cocaina rivela l’effetto protettivo dell’esposizione paterna alla nicotina sulla resistenza alla cocaina della prole. Come in(A), per la prole maschile acclimatata alla nicotina cronica (200 µg/mL di nicotina libera in acqua potabile per sei giorni) o alla cocaina (due iniezioni al giorno con 15 mg/kg di cocaina per cinque giorni). Ventiquattro ore dopo l’esposizione finale alla droga, gli animali sono stati iniettati con una singola dose di 100 mg / kg di cocaina.(C) L’acclimatazione della cocaina induce resistenza alla nicotina nella prole NIC. Qui, maschio TA e la prole NIC sono stati acclimatati a iniezioni di cocaina (due volte al giorno, 15 mg / kg) per cinque giorni. Ventiquattro ore dopo l’iniezione finale di cocaina, gli animali sono stati iniettati con 7,2 mg / kg di nicotina.DOI:http://dx.doi.org/10.7554/eLife.24771.016
Abbiamo poi chiesto se il processo di acclimatazione a dosi subletali di nicotina o cocaina induce uno stato di resistenza alla droga nella prole NIC. In altre parole, la pre-acclimatazione della prole NIC a diverse molecole induce una resistenza specifica al farmaco a cui gli animali sono stati esposti, o le esposizioni croniche a più farmaci distinti inducono tutti uno stato comune di resistenza xenobiotica generale? Per distinguere queste possibilità, abbiamo pre-acclimato la prole TA e NIC alla nicotina o alla cocaina, poi abbiamo sfidato gli animali acclimatati con una dose letale del farmaco a cui non erano ancora stati esposti. Coerentemente con l’ipotesi che l’acclimatazione alla droga induce una risposta xenobiotica generale, abbiamo trovato che la pre-acclimatazione alla nicotina induceva un fenotipo resistente alla cocaina nella prole NIC, e, al contrario, che la cocaina cronica poteva indurre resistenza alla nicotina(Figura 5B-C). Insieme, questi dati suggeriscono che l’esposizione paterna alla nicotina programma uno stato di iper-responsabilità nella prole maschile in cui l’esposizione cronica allo xenobiotico si traduce in una resistenza generalizzata alle tossine.
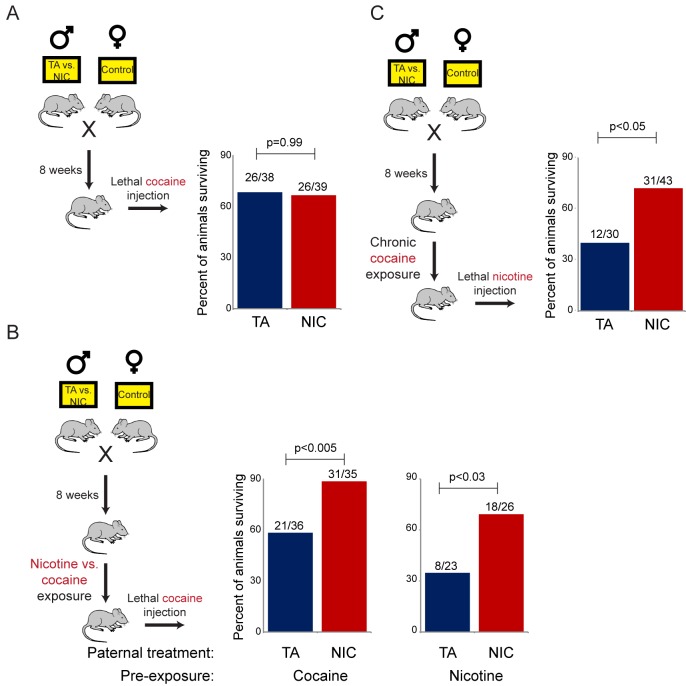
Figura 5.Figura 5. La prole NIC è protetta da xenobiotici multipli.(A) L’esposizione paterna alla nicotina non influisce sulla suscettibilità della prole nativa alla tossicità della cocaina. TA maschile e la prole NIC sono stati iniettati con una singola dose di 100 mg / kg di cocaina. La sopravvivenza è mostrata come in Figura 3.(B) L’acclimatazione della prole TA e NIC alla nicotina o alla cocaina rivela l’effetto protettivo dell’esposizione paterna alla nicotina sulla resistenza alla cocaina della prole. Come in(A), per la prole maschile acclimatata alla nicotina cronica (200 µg/mL di nicotina libera in acqua potabile per sei giorni) o alla cocaina (due iniezioni al giorno con 15 mg/kg di cocaina per cinque giorni). Ventiquattro ore dopo l’esposizione finale alla droga, gli animali sono stati iniettati con una singola dose di 100 mg / kg di cocaina.(C) L’acclimatazione della cocaina induce resistenza alla nicotina nella prole NIC. Qui, maschio TA e la prole NIC sono stati acclimatati a iniezioni di cocaina (due volte al giorno, 15 mg / kg) per cinque giorni. Ventiquattro ore dopo l’iniezione finale di cocaina, gli animali sono stati iniettati con 7,2 mg / kg di nicotina.DOI:
http://dx.doi.org/10.7554/eLife.24771.016
La resistenza ai farmaci è indotta da molteplici esposizioni paterne ai farmaci
La rivelazione che la resistenza alla nicotina nella prole NIC riflette un programma di resistenza xenobiotica piuttosto generico(Figure 4C-D e 5) solleva la questione di quale aspetto del paradigma di esposizione paterna alla nicotina sia responsabile della programmazione del fenotipo della prole. Il paradigma di esposizione alla nicotina qui utilizzato induce la segnalazione del recettore nicotinico dell’acetilcolina (nAChR), con diverse conseguenze fisiologiche: (1) dipendenza dalla nicotina, (2) ridotto apporto calorico, e (3) ritiro fisiologico risultante dalla rimozione della nicotina per l’ultima settimana prima dell’accoppiamento. Per studiare il ruolo della segnalazione dei nAChR nell’induzione paterna della resistenza alla droga della prole, abbiamo fatto uso di mecamilamina, un antagonista non selettivo e non competitivo dei nAChR che attraversa prontamente la barriera emato-encefalica.
I topi maschi sono stati forniti con 2,0 mg/kg/giorno di mecamilamina tramite una pompa per infusione impiantata chirurgicamente, e i topi trattati con mecamilamina sono stati divisi in nicotina o acqua potabile TA, come nel nostro paradigma di esposizione primaria alla nicotina. Studi hanno precedentemente dimostrato che la somministrazione di mecamilamina previene le risposte fisiologiche note alla nicotina come l’anoressia indotta dalla nicotina(Mineur et al., 2011), l’ipotermia e gli effetti locomotori(Tapper et al., 2004), e il rinforzo della nicotina(Corrigall and Coen, 1989). I figli maschi di questi padri sono stati poi acclimatati alla nicotina per 6 giorni, poi sottoposti a una sfida di nicotina tossica, come nelle Figure 3 e 5. Sorprendentemente, i topi maschi trattati contemporaneamente con la nicotina e la sua progenie antagonista con la stessa resistenza alla nicotina potenziata vista nella progenie NIC(Figura 6). È importante notare che questa scoperta esclude rigorosamente la possibilità che il nostro paradigma di esposizione alla nicotina induca effetti paterni sulla prole come conseguenza dello stress da astinenza da nicotina imposto nella settimana prima dell’accoppiamento.10.7554/eLife.24771.017Figure 6.Offspring drug resistance è indotta da un antagonista della nicotina.qui, abbiamo modificato il paradigma di esposizione paterna impiantando pompe per fornire l’antagonista della nicotina mecamilamina ai topi maschi. I topi trattati con mecamilamina sono stati forniti con nicotina o soluzione di controllo per quattro settimane, poi accoppiati per controllare le femmine. La prole maschile è stata acclimatata alla nicotina cronica per sei giorni e poi è stata sottoposta a una sfida di nicotina tossica, e la sopravvivenza è mostrata come nelle Figure 3 e 5. I dati per gli animali senza mecamilamina sono riprodotti dalla Figura 3B. Si noti che l’esposizione simultanea di mecamilamina e nicotina ha avuto un effetto protettivo sulla prole, e anche la mecamilamina da sola è stata in grado di indurre modestamente la resistenza alla nicotina nella generazione successiva.DOI:http://dx.doi.org/10.7554/eLife.24771.017
Inoltre, la resistenza ai farmaci osservata nella prole nicotina+mecamilamina sostiene fortemente che questo effetto paterno non richiede nemmeno la segnalazione della nicotina nei padri trattati, suggerendo invece che l’effetto paterno è forse indotto semplicemente dall’esposizione agli xenobiotici. Coerentemente con questa ipotesi, l’esposizione alla mecamilamina da sola ha anche indotto resistenza ai farmaci nella generazione successiva, anche se questo effetto non era così robusto come quello indotto dalla nicotina o dalla nicotina+mecamilamina(Figura 6). Insieme, questi dati dimostrano che la resistenza ai farmaci nei figli può essere indotta dall’esposizione paterna sia agli agonisti nAChR che agli antagonisti nAChR, sostenendo che l’esposizione paterna allo xenobiotico è probabilmente la caratteristica rilevante del nostro paradigma di esposizione alla nicotina.
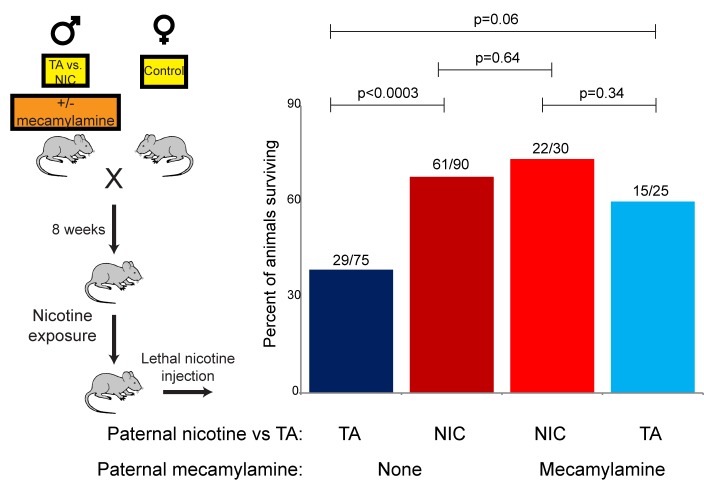
Figura 6.La resistenza ai farmaci della prole è indotta da un antagonista della nicotina.Qui, abbiamo modificato il paradigma di esposizione paterna impiantando pompe per somministrare l’antagonista della nicotina mecamilamina ai topi maschi. I topi trattati con mecamilamina sono stati forniti con nicotina o soluzione di controllo per quattro settimane, poi accoppiati per controllare le femmine. La prole maschile è stata acclimatata alla nicotina cronica per sei giorni e poi è stata sottoposta a una sfida di nicotina tossica, e la sopravvivenza è mostrata come nelle Figure 3 e 5. I dati per gli animali senza mecamilamina sono riprodotti dalla Figura 3B. Si noti che l’esposizione simultanea di mecamilamina e nicotina ha avuto un effetto protettivo sulla prole, e anche la mecamilamina da sola è stata in grado di indurre modestamente la resistenza alla nicotina nella generazione successiva.DOI:
http://dx.doi.org/10.7554/eLife.24771.017
Risparmio relativo di epatociti a seguito di trattamenti farmacologici nella prole NIC
Infine, abbiamo cercato di capire il requisito dell’acclimatazione ai farmaci nel rivelare la resistenza ai farmaci dell’organismo nella prole NIC. Curiosamente, il relativo upregulation relativo dei geni di elaborazione xenobiotici (XPGs) nella prole NIC è stato osservato in epatociti e fegati isolati da animali “ingenui” che non erano stati esposti a nicotina o cocaina (Figura 4),ma una maggiore resistenza alle tossine è stata osservata solo in animali che sono stati prima acclimatati a uno di questi farmaci (Figure 3e 5). Per testare l’ipotesi che l’upregulation XPG potrebbe essere ancora più forte negli epatociti NIC dopo l’esposizione alla droga, ci siamo proposti di caratterizzare i cambiamenti di espressione genica nella prole acclimata alla nicotina o alla cocaina. Tuttavia, nel tentativo di isolare gli epatociti dalla prole acclimatata alla TA e alla NIC per l’analisi dell’RNA-Seq, abbiamo notato un recupero molto più scarso di epatociti dalla TA rispetto alla prole NIC (non mostrato), suggerendo la possibilità che gli animali NIC possano essere protetti dall’epatotossicità indotta dalla droga. Pertanto, per quantificare la vitalità cellulare in vivo, abbiamo adottato un approccio istochimico per valutare l’apoptosi nei fegati da TA e dalla progenie NIC acclimatata ai farmaci. Coerentemente con il recupero relativamente scarso di epatociti da animali AT, abbiamo osservato una sostanziale morte degli epatociti nei fegati di animali esposti alla cocaina(Figura 7A). È importante notare che, mentre l’apoptosi degli epatociti e la necrosi erano estremamente comuni nei fegati della prole esposta alla cocaina, la prole NIC era significativamente protetta da tale tossicità della cocaina(Figura 7). Concludiamo che l’upregulation di XPG nella prole ingenua NIC non è sufficiente a proteggere significativamente gli animali da una sfida letale di nicotina o cocaina, ma che questa upregulation può proteggere gli epatociti da dosi subletali di questi farmaci. Dopo una settimana di esposizione cronica alle tossine, la prole TA rimane con una funzione epatica sostanzialmente ridotta, mentre la prole NIC mantiene un numero maggiore di epatociti funzionali. Si ipotizza che questa maggiore capacità funzionale degli epatociti, così come l’upregulation di XPGs in epatociti(Figura 4), possono entrambi servire a proteggere l’animale da una singola dose tossica di xenobiotic.10.7554/eLife.24771.018Figure 7.NIC prole mostra un relativo risparmio di epatociti a seguito di esposizione cronica alla droga.(A-B) Effetti del trattamento cronico di cocaina sulla vitalità degli epatociti. Due sezioni rappresentative sono mostrate per i fegati macchiati di TUNEL dalla prole TA(A) e NIC(B) dopo cinque giorni di iniezioni di cocaina (due volte al giorno, 15 mg/kg). L’apoptosi centrilobulare prominente si osserva nella prole di TA, ma è quasi completamente assente nella prole di NIC.(C- D) Quantificazione dei dati di colorazione TUNEL.(C) mostra il numero medio (più/meno s.e.m.) di regioni centrilobulari TUNEL+ per vetrino (la colorazione di >25% della circonferenza della vena centrale è stata contata come TUNEL+, ed è stata valutata a cinque livelli diversi per ciascun lobo epatico I-IV) per quattro singoli figli di TA (blu) e NIC (rosso), trattati come in (A- B).(D) mostra i dati per tutti i singoli vetrini come punti, con boxplot che mostra la mediana, una deviazione standard, e 5°/95° percentile per gli 80 punti di dati.DOI:http://dx.doi.org/10.7554/eLife.24771.018
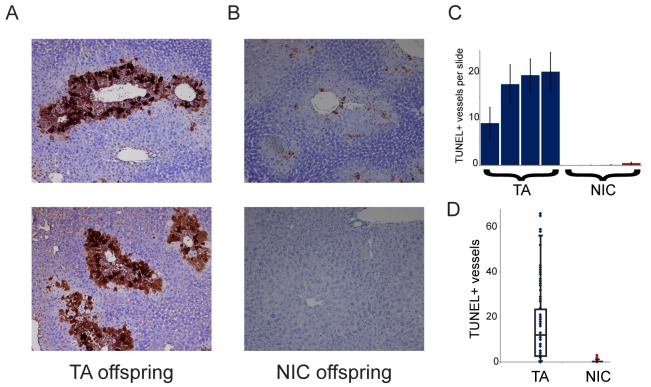
Figura 7.La progenie NIC mostra un relativo risparmio di epatociti a seguito di esposizione cronica ai farmaci.(A-B) Effetti del trattamento con cocaina cronica sulla vitalità degli epatociti. Due sezioni rappresentative sono mostrate per i fegati macchiati di TUNEL dalla prole TA(A) e NIC(B) dopo cinque giorni di iniezioni di cocaina (due volte al giorno, 15 mg/kg). L’apoptosi centrilobulare prominente si osserva nella prole di TA, ma è quasi completamente assente nella prole di NIC.(C- D) Quantificazione dei dati di colorazione TUNEL.(C) mostra il numero medio (più/meno s.e.m.) di regioni centrilobulari TUNEL+ per vetrino (la colorazione di >25% della circonferenza della vena centrale è stata contata come TUNEL+, ed è stata valutata a cinque livelli diversi per ciascun lobo epatico I-IV) per quattro singoli figli di TA (blu) e NIC (rosso), trattati come in (A- B).(D) mostra i dati per tutti i singoli vetrini come punti, con boxplot che mostra la mediana, una deviazione standard, e 5°/95° percentile per gli 80 punti di dati.DOI:
http://dx.doi.org/10.7554/eLife.24771.018
Discussione
Qui riportiamo un nuovo paradigma per gli effetti intergenerazionali dell’ambiente paterno sul fenotipo della prole, basato sulla somministrazione di nicotina paterna. I nostri dati rivelano che l’esposizione paterna alla nicotina programma uno stato di resistenza alla nicotina nella prole, ma, sorprendentemente, né il meccanismo di rilevamento paterno né la risposta della prole sono specifici per la nicotina.
L’esposizione paterna alla nicotina induce un insieme pleiotropico non specifico di fenotipi nella prole
L’uso della nicotina, una piccola molecola ben caratterizzata che agisce in vivo legandosi a specifici recettori, in quanto l’esposizione paterna incitante ci ha permesso di interrogare rigorosamente la specificità della risposta della prole. È importante notare che la maggiore sopravvivenza della tossina vista nella prole non è specifica per la droga a cui i padri sono stati esposti – la prole NIC era iper resistente sia alla nicotina che alle sfide della cocaina – dimostrando che il nostro paradigma di esposizione paterna non si traduce nella trasmissione di un fenotipo specifico della nicotina alla progenie (almeno per la tossicità, gli effetti locomotori e il comportamento di ricompensa). Meccanisticamente, la resistenza ai farmaci osservata nella prole NIC deriva presumibilmente dal miglioramento della clearance del farmaco epatico osservato in questi animali(Figura 4A). Coerentemente con questo aumento della clearance della nicotina, epatociti isolati esposto upregulation upregulation di una varietà di geni xenobiotici di elaborazione (XPGs) accompagnato da una maggiore accessibilità cromatina a regioni di regolamentazione pertinenti. Una varietà di XPGs sono indotti negli epatociti NIC oltre a quelli noti per avere un ruolo nella clearance della nicotina(Figura 4C), suggerendo che la progenie NIC può rivelarsi resistente a molte tossine oltre alle due testate in questo studio.
Oltre alla significativa derepressione dei geni della risposta xenobiotica osservata nella prole NIC, notiamo che gli effetti più significativi della nicotina paterna sull’espressione genica degli epatociti della prole si sono verificati in corrispondenza dei geni metabolici(Figura 4C,E). Questa scoperta ha suggerito che la prole NIC potrebbe anche presentare alterazioni metaboliche, oltre ai cambiamenti documentati nella resistenza xenobiotica. Alterazioni nel controllo del glucosio e del metabolismo lipidico sono comunemente osservate negli studi sull’effetto paterno, osservate non solo nei paradigmi alimentari, ma anche in alcuni studi sull’effetto paterno dello stress e delle tossine(Rando e Simmons, 2015), suggerendo che più stimoli distinti sperimentati dai maschi potrebbero in qualche modo influenzare in modo convergente i tratti metabolici nella prole. Come un fenotipo metabolico dettagliato della prole NIC è oltre l’ambito di questo studio, abbiamo scelto qui di concentrarsi semplicemente sul fenotipo più comune osservato in altri esperimenti di effetto paterno, saggiando il glucosio e la tolleranza all’insulina nella prole TA e NIC(Figura 4-figure supplement 2A-B). Coerentemente con la capacità di più ambienti paterni di alterare il controllo del glucosio nella prole, abbiamo osservato che la prole NIC ha mostrato una significativa riduzione della clearance di un bolo di glucosio, così come una risposta moderatamente ridotta all’insulina.
Presi insieme, i nostri dati rivelano (1) che l’esposizione paterna alla nicotina induce un insieme pleiotropico di fenotipi nella prole maschile, e (2) che i fenotipi indotti nella prole non sono specifici per la nicotina. Sarà di grande interesse per gli studi futuri interrogare un’ampia varietà di fenotipi nella prole dei maschi soggetti a una vasta gamma di paradigmi di esposizione – tra cui lo stress, il trattamento della nicotina e varie diete – per identificare fenotipi comuni e divergenti indotti da paradigmi di esposizione paterna distinti.
La programmazione paterna della resistenza alla droga della prole è limitata alla prole maschio
Una caratteristica curiosa di molti, ma non di tutti i paradigmi di effetti paterni riportati nei mammiferi è che gli effetti fenotipici spesso si manifestano preferibilmente nella prole di un genere. Ad esempio, mentre la sconfitta sociale paterna è stata segnalata per influenzare il comportamento ansiogeno nella prole sia maschile che femminile, l’attività locomotoria e la preferenza per il saccarosio sono stati alterati solo nella prole maschile(Dietz et al., 2011). Qui, troviamo che l’esposizione paterna alla nicotina influisce solo sulla resistenza ai farmaci nella prole maschile, sollevando ancora una volta la questione irrisolta del perché gli ambienti paterni inducono risultati specifici di genere nella prole. Qui, consideriamo tre potenziali spiegazioni per questo fenomeno.
In primo luogo, un sottoinsieme di portatori di informazioni epigenetiche – la metilazione della citosina e il confezionamento della cromatina – sono associati in cis con un locus genomico specifico, il che significa che i cambiamenti epigenetici che si verificano sui cromosomi sessuali influenzano solo la progenie che eredita quel cromosoma. Quindi, è plausibile che l’esposizione alla nicotina influisca sulla modificazione epigenetica del cromosoma Y per programmare la resistenza ai farmaci nella prole maschile (o, meno semplicemente, che i segni epigenetici sul cromosoma X sopprimono un fenotipo autosomico o un piccolo fenotipo diretto da RNA che altrimenti influenzerebbe sia la progenie maschile che quella femminile). In secondo luogo, la compensazione del dosaggio del cromosoma X nei mammiferi avviene tramite il silenziamento di uno dei due cromosomi X nelle femmine. Il cromosoma X inattivo potrebbe quindi agire come un ‘lavandino’ per il meccanismo di silenziamento epigenetico nelle femmine (Blewittet al., 2005), in modo tale che i livelli effettivi di questo meccanismo disponibile per la regolazione del gene autosomico potrebbero differire tra maschi e femmine. In questo scenario, la trasmissione paterna di un locus autosomico segnato epigeneticamente, o RNA, potrebbe causare effetti differenziali nello sviluppo della prole maschio vs. femmina sulla base delle differenze nei livelli disponibili di macchinari epigenetici effettori. Infine, notiamo che un tema emergente in molti paradigmi di effetto paterno è che i cambiamenti fenotipici osservati nella prole sono noti per essere regolati da vari recettori ormonali nucleari (NHRs). Ad esempio, i fenotipi descritti nei paradigmi di stress paterno sono correlati alla segnalazione dei recettori dei glucocorticoidi, mentre i cambiamenti di espressione genica metabolica derivanti dagli interventi dietetici paterni mostrano una significativa sovrapposizione con i geni regolati da NHRs come PPARα (Caroneet al., 2010). Qui, troviamo che l’esposizione paterna alla nicotina influisce sull’espressione epatica di molti target di NHR metaboliche, così come le NHR xenobiotiche-reattive CAR e PXR(Figura 4). Poiché gli ormoni sessuali agiscono anche attraverso la segnalazione di NHR – recettore degli androgeni e recettore degli estrogeni – ipotizziamo che i livelli o l’attività dei coattivatori o dei corepressori di NHR possano differire nella progenie maschile o femminile, con conseguente alterazione della penetrazione o dell’entità degli effetti paterni sulla regolazione genica mediata da NHR.
La resistenza ai farmaci della prole è rivelata dalla pre-esposizione agli xenobiotici
Una caratteristica cruciale della resistenza ai farmaci esibita dalla prole NIC è che lo stato resistente alle tossine è rivelato solo dalla pre-esposizione di questi animali agli xenobiotici. Questo requisito per la pre-esposizione/acclimatazione ai farmaci sottolinea il ruolo chiave dell’ambiente della prole nella manifestazione di un fenotipo epigeneticamente “riprogrammato”. In altre parole, lo sviluppo del fenotipo di un animale comporta qui un’interazione tra le condizioni ambientali in due generazioni consecutive (vedi (Rodgerset al., 2013; Zeybel et al., 2012) per esempi simili) – come per gli effetti ambientali del gene X, anche i segni epigenetici hanno effetti dipendenti dal contesto sul fenotipo dell’organismo.
Qual è il meccanismo con cui l’esposizione a bassi livelli di droga aumenta la sopravvivenza della prole NIC? Gli epatociti NIC mostrano una derepressione dei geni della risposta xenobiotica anche prima dell’esposizione a qualsiasi droga, eppure questi animali nani da droga non sono più resistenti alla nicotina o alla tossicità della cocaina di quanto lo siano gli animali di controllo (Figure3A e 5A). Invece, il metabolismo xenobiotico potenziato nei fegati NIC sembra proteggere gli epatociti suscettibili dalla tossicità durante un corso di esposizione subletale ai farmaci(Figura 7). La perdita di epatociti in animali TA esposti ai farmaci spiega presumibilmente perché meno del 50% di questi animali sopravvive a una dose di nicotina o cocaina LD50 – calcolata usando animali nani da droga – con la conservazione della capacità epatica nella prole NIC impedendo questa degradazione nella sopravvivenza. Detto questo, non solo la prole NIC acclimatata alla droga conserva semplicemente la sua sopravvivenza di fronte a una dose di queste droghe LD50, ma mostra una sopravvivenza drammaticamente migliorata, dato che più della metà di questi animali sopravvive a questa sfida. Dobbiamo ancora scoprire la base meccanicistica di questo miglioramento della sopravvivenza, in quanto l’analisi RNA-Seq degli epatociti isolati da animali acclimatati ai farmaci non rivela un’ulteriore upregolazione degli XPG rispetto a quella documentata per gli epatociti ingenui (non mostrata). Studi futuri indagheranno se l’acclimatazione dei farmaci potrebbe (1) influenzare l’abbondanza di mRNA in un sottoinsieme limitato di epatociti (che sarebbe diluito in esperimenti di coltura di fegato intero o epatociti), (2) influenzare l’abbondanza di mRNA solo transitoriamente durante l’esposizione al farmaco (e non negli epatociti in coltura), lasciando dietro di sé livelli più elevati di proteine codificate senza una firma mRNA-Seq, o (3) influenzare il metabolismo xenobiotico non a livello di abbondanza di mRNA, ma post-trascrizionale.
Come viene percepita la nicotina nei maschi esposti?
La risposta pleiotropica osservata nella prole esposta alla nicotina solleva la questione di come la nicotina viene percepita nella generazione paterna in questo sistema. Una domanda chiave a questo proposito è se lo stress sperimentato dai maschi esposti alla nicotina possa essere responsabile dell’induzione del fenotipo della prole, poiché è noto che una varietà di paradigmi di esposizione allo stress paterno – tra cui la separazione materna precoce, lo stress da sconfitta sociale e lo stress cronico variabile di basso livello – influenzano molteplici fenotipi nella prole, dal controllo del glucosio ai comportamenti correlati all’ansia (Bale,2015). Anche se non abbiamo formalmente escluso un ruolo per lo stress paterno nel nostro sistema – sarà naturalmente interessante analizzare la resistenza alla nicotina della prole in paradigmi di stress paterno ben studiati – due scoperte sostengono fortemente contro questo effetto paterno derivante da una risposta generale allo stress. In primo luogo, l’esposizione cronica all’antagonista dei recettori nicotinici mecamilamina, che blocca la dipendenza dalla nicotina nei padri trattati con nicotina, non interferisce con l’induzione della resistenza xenobiotica nella prole(Figura 6), escludendo così definitivamente un ruolo per lo stress da astinenza paterna nell’induzione di questo fenotipo. Questo primo punto è ulteriormente supportato dalla constatazione che la mecamilamina da sola – che da sola ha poco effetto sull’ansia, sul comportamento locomotorio, o sui sintomi di astinenza fisica nei topi nicotina-naïve (Zhao-Sheaet al., 2013) – è sufficiente per indurre la resistenza allo xenobiotico nella prole. In secondo luogo, a differenza di molteplici paradigmi di stress paterno segnalati, non troviamo alcuna prova che l’esposizione paterna alla nicotina influisce sul comportamento ansioso nella prole(Figura 1-figure supplement 2).
Qual è, quindi, la caratteristica rilevante della nicotina nell’indurre resistenza xenobiotica nella prole? Gli effetti paterni sulla resistenza alle tossine nella prole non hanno richiesto la segnalazione dei recettori nicotinici, poiché sia la nicotina stessa che un antagonista della nicotina sono stati in grado di indurre la risposta protettiva nella prole. Poiché sia l’esposizione alla nicotina che quella alla mecamilamina possono portare alla riduzione della segnalazione della nAChR attraverso la desensibilizzazione o l’antagonismo, rispettivamente, è formalmente possibile che la disattivazione della nAChR sia lo stimolo incitante nella generazione paterna (o, meno probabile, che lo stress chirurgico dell’impianto della pompa per infusione di mecamilamina e il consumo di nicotina, entrambi convergentemente inducano lo stesso effetto nella prole). Tuttavia, siamo favorevoli all’ipotesi più semplice che entrambe queste molecole servano a programmare la resistenza ai farmaci della prole attraverso gli effetti sul rilevamento xenobiotico paterno. Questo modello solleva naturalmente la questione di come viene percepita l’esposizione allo xenobiotico. Poiché una varietà diversificata di xenobiotici può influenzare la regolazione dei geni attraverso l’attivazione delle NHR CAR e PXR, queste NHR rappresentano candidati interessanti per il relativo sensore xenobiotico nei padri.
Qualunque sia la natura del sensore xenobiotico rilevante, una sfida chiave da affrontare è il motivo per cui l’esposizione sperimentale alla nicotina o alla mecamilamina (o, presumibilmente, a molti altri xenobiotici) riprogramma la resistenza ai farmaci della prole rispetto agli animali di controllo, dato che gli animali di controllo sono anche esposti a una moltitudine di piccole molecole anche in condizioni di laboratorio controllate. La nicotina e la mecamilamina inducono in qualche modo un cambiamento di tipo “tutto o niente” in qualche segno epigenetico che non è presente negli spermatozoi di controllo, oppure il livello di attività complessiva di un sensore xenobiotico si traduce in cambiamenti quantitativi nei livelli di qualche segnale continuo presente negli spermatozoi? Nel primo caso, quali aspetti di un determinato paradigma di esposizione sono necessari per indurre alterazioni dell’epigenoma spermatico? Offriamo che un meccanismo interessante per rilevare l’aumento dei livelli di xenobiotici ambientali si baserebbe sul confronto dei cambiamenti nell’attività dei sensori nel corso della vita di un animale. Per esempio, se la segnalazione CAR/PXR all’inizio della vita – forse nell’utero, o all’inizio della vita postnatale – dovesse risultare in un ‘setpoint’ di lunga durata per i livelli di attività CAR/PXR attesi più tardi nella vita, allora l’organismo potrebbe rilevare un aumento dell’esposizione allo xenobiotico più tardi nella vita attraverso cambiamenti nell’attività complessiva CAR/PXR rispetto a questo setpoint. Studi futuri esploreranno la natura del sensore della ‘nicotina’ nella generazione paterna e come le informazioni sulla storia dell’esposizione vengono trasmesse alla prole.
Presi nel loro insieme, i nostri studi definiscono un nuovo paradigma di esposizione paterna basato su una specifica interazione ligneo-recettore, e mostrano che l’esposizione paterna alla nicotina programma la prole per una maggiore resistenza a più tossine distinte. I nostri dati rivelano anche ampi cambiamenti di espressione genica metabolica nella prole NIC, con potenziali implicazioni per la salute metabolica e cardiovascolare della prole. Studi futuri determineranno se l’esposizione paterna alla nicotina influisce sulla prole attraverso segni epigenetici negli spermatozoi (rispetto al liquido seminale, ecc.), e come le informazioni trasmesse per via paterna alterano il corso dello sviluppo per produrre epatociti resistenti allo xenobiotico. Sarà anche interessante estendere questi studi alle popolazioni umane, dove l’emivita più lunga della nicotina potrebbe potenzialmente portare a fenotipi di autosomministrazione non osservati nel modello murino.
Materiali e metodi
Allevamento di animali e trattamenti farmacologici
I topi C57BL/6J (RRID:IMSR_JAX_JAX:000664), di tre settimane, sono stati ottenuti dai laboratori Jackson su base settimanale e ospitati in gruppo (quattro mici/gabbia) in un ciclo luce-buio di 12 ore (dalle 7:00 alle 19:00). Dopo l’arrivo, i maschi sono stati immediatamente messi a contatto con acido tartarico (TA, 375 µg/ml) o nicotina (200 µg/ml di nicotina a base libera) in acqua potabile per cinque settimane consecutive, seguite da un’ulteriore settimana di acqua di rubinetto prima dell’accoppiamento. I maschi esposti alla nicotina e i maschi di controllo sono stati poi autorizzati ad accoppiarsi (per sei giorni) con le femmine di controllo a partire dalla stessa data di spedizione. La progenie F1 dei padri esposti alla nicotina e dei padri di controllo sono stati utilizzati per tutti gli esperimenti riportati, generalmente a otto settimane di età, se non diversamente specificato. Gli animali sono stati mantenuti in loco in conformità con un protocollo IACUC approvato (A-1788).
Saggio locomotore
I maschi F1 dei padri esposti alla nicotina e dei padri di controllo sono stati pre-condizionati alla manipolazione e alle iniezioni di soluzione fisiologica allo 0,9% (100 µl, i.p.) per tre giorni prima dell’inizio dello studio. Per le sessioni di test della nicotina, gli animali sono stati iniettati con nicotina e trasferiti in gabbie individuali collocate all’interno di una cornice a raggi infrarossi (San Diego Instruments). Le sessioni di test sono durate 40 o 90 minuti al giorno per nove giorni consecutivi. L’attività locomotoria è stata definita come il numero di interruzioni del fascio durante una sessione, al termine della quale l’animale ha dovuto attraversare almeno due fasci fotografici dalla posizione originale per poter essere considerato come deambulazione. I risultati sono stati quantificati statisticamente utilizzando t-test non accoppiati con aggiustamenti multipli di confronto (correzione Holm-Sidak).
Test di autosomministrazione della nicotina
L’impianto del catetere microchirurgico è stato eseguito su maschi F1 di 7 settimane di età compresa tra i padri esposti alla nicotina e i padri di controllo. Gli animali sono stati anestetizzati con ketamina (100 mg / kg di peso corporeo) e xilazina (10 mg / kg di peso corporeo) seguita da un’incisione intrascapolare e destra medioclavicolare a livello della guaina carotidea. Preparazione smussata è stato utilizzato per creare un canale sottocutaneo tra le due incisioni. Successivamente, la vena giugulare dextra è stata localizzata e un catetere (2Fr, PV 10 cm, Instech Labs) è stato inserito e spinto delicatamente in avanti nella vena cava superiore, dove è rimasto per la lunghezza dello studio. Il catetere è stato legato alla vena utilizzando Ethibond Excel 4.0. L’estremità distale del catetere è stata collegata ad un pulsante (25 G, VAB, Instech. Labs), che è stato posizionato sottocutaneo in posizione intrascapolare per un facile accesso. Dopo aver verificato che non vi fossero perdite, i siti di incisione sono stati chiusi con Ethibond Excel 4.0. Attraverso il catetere, il topo è stato trattato con eparina (15 U.I., Sigma-Aldrich, St. Louis, MO) e una miscela antibiotica di Ticarcillina (20 mg booster, Sigma-Aldrich) e Amikacin (10 mg/kg BW, Sigma-Aldrich). Gli animali hanno ricevuto Ketoprofene (5 mg/kg BW, Sigma-Aldrich) una volta al giorno durante una fase di recupero di 3 giorni. In seguito, i topi sono stati messi su una dieta di restrizione calorica (85% w / w di consumo regolare 24 ore) tre giorni prima dell’inizio dell’esperimento. Abbiamo precondizionato gli animali su pellets di saccarosio in una sessione di 60 min una volta al giorno per sette giorni consecutivi, per cui gli animali hanno imparato a fare il naso-poke il portale attivo in una camera di auto-somministrazione al fine di ricevere la ricompensa alimentare. Il numero di naso-poke necessari per ottenere un pellet di saccarosio è aumentato a partire da un rapporto fisso di 1:1 (FR1) fino a un rapporto fisso di 5:1 (FR5). Solo gli animali che erano stati condizionati con successo su pellet di saccarosio sono passati alla fase di test, durante la quale hanno somministrato la nicotina a se stessi attraverso il catetere impiantato. La pervietà del catetere è stata verificata quotidianamente mediante aspirazione di sangue e successiva infusione di eparina. Gli animali con cateteri bloccati o dislocati sono stati esclusi dallo studio. Le dosi di nicotina autosomministrati iniziato con 0,03 mg / kg / iniezione per 4 giorni, poi 0,1 mg / kg / iniezione per 8 giorni, 0,25 mg / kg / iniezione per 8 giorni, e 0,4 mg / kg / iniezione per 8 giorni. Il numero di naselli del portale attivo rispetto a quello inattivo, così come il numero di iniezioni somministrate, sono stati registrati e analizzati utilizzando GraphPad Prism 7.0 e test multipli t-test con correzione Holm-Sidak. La sopravvivenza è stata tracciata come curva Kaplan-Meier con livelli di significatività calcolati utilizzando test Chi-quadrato modificati (Log-rank e Gehan-Breslow-Wilcoxon).
Saggio della cotinina
Il sangue di maschi F1 di padri esposti alla nicotina o di padri di controllo è stato raccolto in tubi rivestiti di EDTA dopo l’iniezione di 1,5 mg/kg di nicotina a base libera i.p. a 15 min, 30 min e 45 min dopo l’iniezione. I componenti cellulari sono stati separati dal siero mediante centrifugazione a 12.000 ×g per 10 min. I livelli di cotinina nel siero di F1 cronico sono stati misurati utilizzando un kit ELISA diretto (CalBiotech Inc.). I campioni sono stati eseguiti come due repliche tecniche insieme con una curva standard di cotinina per ogni piastra a 96 pozzetti. L’analisi è stata eseguita utilizzando GraphPad Prism 7.
Saggi di ansia
Il labirinto più elevato consisteva di quattro bracci collegati da un asse centrale (5 × 5 cm) ed era elevato di 45 cm dal pavimento. Due dei bracci contenevano pareti di plastica nera (5 × 30 × 15 cm) mentre gli altri due rimanevano aperti (5 × 30 × 0,25 cm). I topi sono stati collocati singolarmente al centro del labirinto con la testa rivolta verso uno dei bracci aperti e hanno permesso 5 minuti di esplorazione libera. Il numero di ingressi nei bracci aperti e chiusi e il tempo totale trascorso nei bracci aperti e chiusi sono stati misurati dal software MED-PC IV (MED associates, Inc.). Per l’attività in campo aperto, i topi sono stati collocati in un’arena rettangolare in plexiglas (40 × 40 × 30 cm) e l’attività dei topi è stata videoregistrata per 10 minuti. L’attività totale, la velocità e il tempo trascorso nell’area periferica e centrale del campo aperto sono stati analizzati utilizzando il software di tracciamento video (Noldus Ethovision).
cFos colorazione e conta delle cellule
I maschi F1 dei padri esposti alla TA e alla nicotina sono stati trattati come per l’analisi del trascrittoma e gli studi fenotipici. In breve, gli animali hanno ricevuto nicotina nella loro acqua potabile (200 µg/ml di nicotina a base libera) per sei giorni consecutivi a partire da sette settimane dopo il parto. In seguito, i topi sono stati messi su acqua di rubinetto filtrata dalle 12:00 P.M. fino alle 7:00 A.M. del giorno successivo, seguita da una raccolta immediata dei tessuti. Cervelli di altri animali di controllo di otto settimane sono sezionati 90 minuti dopo l’iniezione i.p. di 1,5 mg / kg BW nicotina free-base. Gli animali sono stati anestetizzati con sodio pentobarbital i.p. (200 mg / kg BW) seguita da un’infusione intracardiaca di 10 ml di PBS ghiacciato e 10 ml di paraformaldeide (PFA; 4% w / v in PBS). I cervelli sono stati mantenuti a 4°C in PFA al 4% per 2 ore e poi trasferiti in saccarosio al 30% (p/v in PBS) fino alla preparazione della fetta.
I cervelli sono stati sezionati con un microtomo (Leica) in fette da 25 µm e immersi in una soluzione al 50% di glicerolo, 50% di glicole etilenico (Sigma) per preservare il tessuto. Le fette di cervello sono state conservate a -20°C fino ad ulteriore lavorazione. Utilizzando il metodo di immunocolorazione flottante, le fette sono state lavate con PBS per 5 min, permeabilizzate con 0,5% (v/v) Triton X-100 (Sigma) per 10 min, e bloccate con il 3% di siero d’asino per 30 min. Le fette sono state incubate durante la notte a 4°C con anticorpi contro c-Fos (1:1000, numero di catalogo: sc-52, numero di lotto: D2315, Santa Cruz Biotechnology, Santa Cruz, CA). Dopo i lavaggi con PBS, le fette sono state incubate con anticorpi secondari di Alexa Fluor 594 (1:1000, numero di riferimento: A21207, numero di lotto: 1602780, Life Technologies, Carlsbad, CA). La contro-colorazione è stata effettuata con DAPI attraverso mezzi di montaggio (numero di gatto: H-1200, numero di lotto: ZB0730, Vector, Burlington, CA). Le immagini fluorescenti sono state catturate utilizzando una fotocamera AxioCam MRm (Carl Zeiss, Peabody, MA) collegata ad un microscopio fluorescente invertito Axiovert Zeiss dotato di set di filtri Zeiss 38HE, 49 e 20. Gli obiettivi Zeiss A-p sono stati successivamente elaborati utilizzando la versione 4.8.2 di Axiovision. La quantificazione delle cellule c-Fos-positive è stata effettuata utilizzando ImageJ, con un minimo di 6 fette di cervello ippocampale analizzate per animale.
Raccolta di tessuti per mRNA ippocampale mRNA-Seq
Sette animali F1 maschi di sette settimane di sesso maschile di controllo (TA) e padri esposti alla nicotina sono stati divisi in tre gruppi di trattamento: ingenuo, cronico, e cronico + stimolazione. Topi naïve non sono stati esposti alla nicotina prima della raccolta dei tessuti a 8 settimane di età. Gli animali cronici hanno ricevuto nicotina nella loro acqua potabile (200 µg/ml) per sei giorni consecutivi. In seguito, i topi cronici sono stati messi su acqua di rubinetto filtrata dalle 12:00 P.M. fino alle 7:00 A.M. del giorno successivo, seguita dalla raccolta dei tessuti come per gli animali ingenui. Cronico + animali di stimolazione sono stati trattati come animali cronici, ma ha ricevuto un’ulteriore iniezione di nicotina (1,5 mg / kg BW base nicotina senza nicotina i.p.) 30 min prima della raccolta degli organi. Per tutte e tre le serie di animali, a seguito di sacrificio cervelli sono stati spiegati e messi in ghiaccio. È stata eseguita un’incisione della linea mediana e sono stati sezionati il mesencefalo, l’ipotalamo e l’ippocampo di entrambi i lati. I tessuti sono stati immediatamente immersi in azoto liquido, poi conservati a -80°C fino ad ulteriore lavorazione.
Isolamento degli epatociti per mRNA-Seq e per ATAC-Seq
Otto animali F1 di sesso maschile di una settimana provenienti dal controllo (TA) e da padri esposti alla nicotina sono stati anestetizzati con ketamina (100 mg/kg di peso corporeo) e xilazina (10 mg/kg di peso corporeo). La cavità addominale è stata aperta con un’incisione trasversale sotto la gabbia toracica. La vena porta è stata sezionata con un forcipe smussato e un ago del catetere da 26 G è stato inserito. Dopo aver tagliato la vena cava cranica inferiore del fegato, l’organo è stato perfuso in primo luogo con 1X HBBS +200 mM EDTA (10 ml a 7 ml/min) e in secondo luogo con 50 ml DMEM contenente collagenasi di tipo I (0,4 mg/ml) a 7 ml/min. Il fegato è stato poi rimosso dalla cavità addominale, messo in una scatola di Petri contenente terreno di coltura (DMEM, 20% FBS, 1X ITS, 1X Penicillina / Streptomicina, 0,1 µM Desametasone, Sigma-Aldrich), e delicatamente sezionato per consentire il rilascio di epatociti e cellule di supporto dal tessuto connettivo. Si noti che a causa della disaggregazione dell’intero fegato, i cambiamenti dell’abbondanza di mRNA osservati in un sottoinsieme di epatociti (come, ad esempio, le cellule morenti in animali acclimatati dai farmaci – Figura 7) saranno diluiti dalla maggior parte degli epatociti non affetti. Dopo la filtrazione attraverso un filtro per cellule di nylon da 70 µm, le cellule sono state lavate due volte con PBS 1X e una volta con mezzi di coltura (centrifugazione a 500 rpm per 5 minuti), e placcate su un pozzo rivestito di gelatina allo 0,1%. Gli epatociti sono stati lasciati aderire al fondo del pozzo per tre ore. Le cellule non aderenti sono state poi rimosse, e il terreno di coltura fresco è stato poi aggiunto, iniziando il nostro corso del tempo (T0, T1, T3, T21 ore). Le cellule sono state raccolte dopo un lavaggio PBS 1X aggiungendo TriZol al pozzetto per gli esperimenti di RNA.
RNA-Seq
Sono state preparate biblioteche specifiche per le varie sezioni come descritto in precedenza(Zhang et al., 2012). In breve, il cervello e il fegato sono stati raccolti da maschi F1 esposti alla nicotina e di controllo. Gli epatociti sono stati isolati come descritto sopra. Per l’ippocampo, dopo la sezionatura del cervello in fette da 1 mm, sono state identificate le aree di interesse secondo l’Atlante del cervello del topo da Paxinos e Franklin e sezionato con punzoni da 0,5 mm.
RNA dal cervello e dal fegato è stato isolato utilizzando protocolli standard TriZol, seguito da rRNA esaurimento (RiboZero kit, Illumina, Inc.). Dopo la sintesi del primo e secondo filo, gli adattatori sono stati legati a frammenti e amplificati con primer PCR multiplexato. Le librerie sono state sequenziate su una piattaforma NextSeq 500 di Illumina, Inc. Lettura di qualità controllata sono stati allineati al genoma di riferimento (Mus musculus/mm10) con Bowtie2 e l’espressione differenziale è stata calcolata utilizzando DESeq2. Per le regolazioni multiple di confronto, abbiamo usato la correzione Holm-Bonferroni come approccio più conservativo.
I dati RNA-Seq sono disponibili presso GEO, adesione # GSE94059.
ATAC-Seq
Le biblioteche ATAC-seq sono state preparate per 16 campioni di epatociti (4 animali NIC e 4 animali AT, con ogni campione diviso in aliquote non trattate e trattate con desametasone) come precedentemente descritto(Buenrostro et al., 2015) utilizzando il kit di preparazione della biblioteca del DNA Nextera (Illumina). Le biblioteche sono state paired-end sequenziate su un NextSeq 500, e le letture sono state allineate al mm10 utilizzando Bowtie2, v2-2.1.0 con i parametri -D 15 R 2 N 1 L 20 -i S,1,0.50 –maxins 2000 –no-discordante –no-mixed. Sono stati rimossi il DNA mitocondriale e le letture con mappatura cromosomica casuale e sono stati rimossi i duplicati della PCR. Le immagini del browser del genoma sono state generate da set di dati fusi con letture estese a 150 bp, e normalizzate dal totale delle letture mappate per campione. Per l’analisi dei picchi differenziali, HOMER è stato utilizzato per identificare i picchi specifici della NIC utilizzando i file dei picchi TA come sfondo.
I dati ATAC-Seq sono disponibili presso GEO, adesione # GSE92240.
Istologia del fegato
I fegati sono stati raccolti da maschi F1 da padri esposti alla nicotina e di controllo in varie condizioni (pretrattamento con nicotina 1,5 mg/kg BW intraperitoneale b.i.d. per cinque giorni o cocaina 15 mg/kg BW intraperitoneale b.i.d. o acetaminofene 400 mg/kg BW q.d. per un giorno) e lavati con PBS. Una fetta di 4 mm è stata presa da ogni lobo e messa in formaldeide al 4% di formaldeide ghiacciata per una notte. Il giorno successivo, i campioni sono stati disidratati in una serie di soluzioni di etanolo crescente a partire dal 70% e termina con il 100%, incorporato in paraffina, e sezionato (fette di 4 µm), ogni sezione contenente tutti e quattro i lobi, che sono stati poi montati su un vetrino di vetro. Per la colorazione H/E, le fette sono state de-parafinizzate, incubate con xilene e una serie di soluzioni di etanolo discendente. I tempi di incubazione per l’ematossilina di Mayer (Sigma-Aldrich) e l’1% di Eosina Y (Sigma-Aldrich) sono stati rispettivamente di 30 s e 20 s. Dopo la decerizzazione dei tessuti, la colorazione TUNEL è stata eseguita seguendo le raccomandazioni del produttore (in Situ Cell Death Detection Kit, POD, Roche). Aree apoptotiche per lobo sono stati contati al microscopio ottico con ingrandimento 20X a cinque diversi livelli attraverso il campione e analizzati con l’immagine J.
References
- Bale TL. Epigenetic and transgenerational reprogramming of brain development. Nature Reviews Neuroscience. 2015; 16:332-344. DOI | PubMed
- Blewitt ME, Vickaryous NK, Hemley SJ, Ashe A, Bruxner TJ, Preis JI, Arkell R, Whitelaw E. An N-ethyl-N-nitrosourea screen for genes involved in variegation in the mouse. PNAS. 2005; 102:7629-7634. DOI | PubMed
- Buenrostro JD, Wu B, Chang HY, Greenleaf WJ. ATAC-seq: a method for assaying chromatin accessibility Genome-Wide. Current Protocols in Molecular Biology. 2015; 109:21.29.1-21.29.9. DOI
- Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R, Bock C, Li C, Gu H, Zamore PD, Meissner A, Weng Z, Hofmann HA, Friedman N, Rando OJ. Paternally induced transgenerational environmental reprogramming of metabolic gene expression in mammals. Cell. 2010; 143:1084-1096. DOI | PubMed
- Corrigall WA, Coen KM. Nicotine maintains robust self-administration in rats on a limited-access schedule. Psychopharmacology. 1989; 99:473-478. DOI | PubMed
- Dietz DM, Laplant Q, Watts EL, Hodes GE, Russo SJ, Feng J, Oosting RS, Vialou V, Nestler EJ. Paternal transmission of stress-induced pathologies. Biological Psychiatry. 2011; 70:408-414. DOI | PubMed
- Fonck C, Nashmi R, Deshpande P, Damaj MI, Marks MJ, Riedel A, Schwarz J, Collins AC, Labarca C, Lester HA. Increased sensitivity to agonist-induced seizures, straub tail, and hippocampal theta rhythm in knock-in mice carrying hypersensitive alpha 4 nicotinic receptors. Journal of Neuroscience. 2003; 23:2582-2590. PubMed
- Fowler CD, Lu Q, Johnson PM, Marks MJ, Kenny PJ. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 2011; 471:597-601. DOI | PubMed
- Gapp K, Jawaid A, Sarkies P, Bohacek J, Pelczar P, Prados J, Farinelli L, Miska E, Mansuy IM. Implication of sperm RNAs in transgenerational inheritance of the effects of early trauma in mice. Nature Neuroscience. 2014; 17:667-669. DOI | PubMed
- Harris A, Seckl J. Glucocorticoids, prenatal stress and the programming of disease. Hormones and Behavior. 2011; 59:279-289. DOI | PubMed
- McPherson NO, Fullston T, Aitken RJ, Lane M. Paternal obesity, interventions, and mechanistic pathways to impaired health in offspring. Annals of Nutrition and Metabolism. 2014; 64:231-238. DOI | PubMed
- Mineur YS, Abizaid A, Rao Y, Salas R, DiLeone RJ, Gundisch D, Diano S, De Biasi M, Horvath TL, Gao X-B, Picciotto MR. Nicotine decreases food intake through activation of POMC neurons. Science. 2011; 332:1330-1332. DOI | PubMed
- Pembrey ME, Bygren LO, Kaati G, Edvinsson S, Northstone K, Sjöström M, Golding J, ALSPAC Study Team. Sex-specific, male-line transgenerational responses in humans. European Journal of Human Genetics. 2006; 14:159-166. DOI | PubMed
- Rando OJ. Daddy issues: paternal effects on phenotype. Cell. 2012; 151:702-708. DOI | PubMed
- Rando OJ, Simmons RA. I’m eating for two: parental dietary effects on offspring metabolism. Cell. 2015; 161:93-105. DOI | PubMed
- Rodgers AB, Morgan CP, Bronson SL, Revello S, Bale TL. Paternal stress exposure alters sperm microRNA content and reprograms offspring HPA stress axis regulation. Journal of Neuroscience. 2013; 33:9003-9012. DOI | PubMed
- Short AK, Fennell KA, Perreau VM, Fox A, O’Bryan MK, Kim JH, Bredy TW, Pang TY, Hannan AJ. Elevated paternal glucocorticoid exposure alters the small noncoding RNA profile in sperm and modifies anxiety and depressive phenotypes in the offspring. Translational Psychiatry. 2016; 6DOI | PubMed
- Simmons R. Epigenetics and maternal nutrition: nature v. nurture. Proceedings of the Nutrition Society. 2011; 70:73-81. DOI | PubMed
- Siu EC, Tyndale RF. Characterization and comparison of nicotine and cotinine metabolism in vitro and in vivo in DBA/2 and C57BL/6 mice. Molecular Pharmacology. 2007; 71:826-834. DOI | PubMed
- Skinner MK, Manikkam M, Guerrero-Bosagna C. Epigenetic transgenerational actions of endocrine disruptors. Reproductive Toxicology. 2011; 31:337-343. DOI | PubMed
- Tapper AR, McKinney SL, Nashmi R, Schwarz J, Deshpande P, Labarca C, Whiteaker P, Marks MJ, Collins AC, Lester HA. Nicotine activation of alpha4* receptors: sufficient for reward, tolerance, and sensitization. Science. 2004; 306:1029-1032. DOI | PubMed
- Vassoler FM, White SL, Schmidt HD, Sadri-Vakili G, Pierce RC. Epigenetic inheritance of a cocaine-resistance phenotype. Nature Neuroscience. 2013; 16:42-47. DOI | PubMed
- Yohn NL, Bartolomei MS, Blendy JA. Multigenerational and transgenerational inheritance of drug exposure: The effects of alcohol, opiates, cocaine, marijuana, and nicotine. Progress in Biophysics and Molecular Biology. 2015; 118:21-33. DOI | PubMed
- Zeybel M, Hardy T, Wong YK, Mathers JC, Fox CR, Gackowska A, Oakley F, Burt AD, Wilson CL, Anstee QM, Barter MJ, Masson S, Elsharkawy AM, Mann DA, Mann J. Multigenerational epigenetic adaptation of the hepatic wound-healing response. Nature Medicine. 2012; 18:1369-1377. DOI | PubMed
- Zhang Z, Theurkauf WE, Weng Z, Zamore PD. Strand-specific libraries for high throughput RNA sequencing (RNA-Seq) prepared without poly(A) selection. Silence. 2012; 3DOI | PubMed
- Zhao-Shea R, Liu L, Pang X, Gardner PD, Tapper AR. Activation of GABAergic neurons in the interpeduncular nucleus triggers physical nicotine withdrawal symptoms. Current Biology. 2013; 23:2327-2335. DOI | PubMed
- Zhao-Shea R, DeGroot SR, Liu L, Vallaster M, Pang X, Su Q, Gao G, Rando OJ, Martin GE, George O, Gardner PD, Tapper AR. Increased CRF signalling in a ventral tegmental area-interpeduncular nucleus-medial habenula circuit induces anxiety during nicotine withdrawal. Nature Communications. 2015; 6DOI | PubMed
- Zhu J, Lee KP, Spencer TJ, Biederman J, Bhide PG. Transgenerational transmission of hyperactivity in a mouse model of ADHD. Journal of Neuroscience. 2014; 34:2768-2773. DOI | PubMed
Fonte
Vallaster MP, Kukreja S, Bing XY, Ngolab J, Zhao-Shea R, et al. () Paternal nicotine exposure alters hepatic xenobiotic metabolism in offspring. eLife 6e24771. https://doi.org/10.7554/eLife.24771





