Introduzione
La morbilità e la mortalità legate agli oppioidi continuano ad aumentare in Canada e negli Stati Uniti[1,2]. In molte regioni, tra cui Vancouver, in Canada – dove nel 2016 le overdose di droga sono state dichiarate un’emergenza sanitaria pubblica – l’emergere degli oppioidi sintetici (ad esempio, il fentanil) nei mercati delle droghe illecite ha scatenato un’ondata di morte senza precedenti [3]. La crisi da sovradosaggio è anche il culmine di una tendenza all’uso di oppiacei in continua evoluzione (dall’assunzione di oppiacei attraverso l’eroina all’assunzione di oppiacei farmaceutici[4]) che può essere ricondotta, in parte, all’eccessiva prescrizione di oppiacei farmaceutici per il dolore cronico non cancerogeno[5].
Nonostante questa tendenza alla prescrizione liberale di oppiacei, alcune popolazioni emarginate che soffrono di alti tassi di dolore, comprese le persone che fanno uso di farmaci (PWUD), non hanno accesso a un’adeguata gestione del dolore attraverso il sistema sanitario[6,7]. Il dolore non trattato o non trattato in questa popolazione può promuovere l’uso di sostanze ad alto rischio, poiché i pazienti possono cercare oppiacei illegali (ad esempio eroina non regolamentata o oppiacei farmaceutici contraffatti/diversificati) per gestire il dolore[6,7]. A Vancouver, questa pratica comporta un rischio particolarmente elevato di overdose accidentale, poiché le stime mostrano che quasi il 90% dei farmaci venduti come eroina sono contaminati da oppioidi sintetici, come il fentanil[8]. Un’altra strategia di autogestione del dolore meno esaminata tra i PWUD è l’uso di cannabis[9]. A differenza degli oppioidi e degli stimolanti illeciti, l’offerta di cannabis (non regolamentata o regolamentata) non è stata contaminata dal fentanil, e non è noto che la cannabis rappresenti un rischio diretto di overdose fatale[10]. Di conseguenza, la cannabis è stata accolta da alcuni, comprese le iniziative emergenti di riduzione del danno a Vancouver, come possibile sostituto degli oppiacei nella gestione non medica del dolore e dell’astinenza da oppiacei[11]. Inoltre, l’evidenza clinica sostiene l’uso di cannabis o di farmaci a base di cannabinoidi per il trattamento di alcuni tipi di dolore cronico non cancerogeno (ad esempio, il dolore neuropatico)[12].
Poiché un maggior numero di giurisdizioni in tutto il Nord America introduce quadri giuridici per l’uso medico o non medico della cannabis, studi ecologici hanno fornito prove che suggeriscono che gli stati che forniscono accesso alla cannabis legale sperimentano riduzioni a livello di popolazione nell’uso di oppioidi[13-17], dipendenza da oppioidi [18,19], e overdose fatale [19-21]. Tuttavia, queste tendenze a livello statale non rappresentano necessariamente dei cambiamenti all’interno degli individui[22], evidenziando la necessità critica di condurre una ricerca a livello individuale per capire meglio se il consumo di cannabis è associato a un uso ridotto di oppioidi e al rischio di danni legati agli oppioidi, in particolare tra gli individui che soffrono di dolore. Di particolare interesse è un possibile effetto di risparmio di oppioidi della cannabis, per cui una dose minore di oppioidi fornisce un’analgesia equivalente a una dose maggiore se accoppiata con la cannabis. Sebbene questo effetto sia stato identificato in studi preclinici[23], gran parte delle ricerche attuali nell’uomo si limita alle segnalazioni dei pazienti di riduzioni dell’uso di farmaci su prescrizione (compresi gli oppiacei) come risultato dell’uso di cannabis[24- 34]. Tuttavia, un recente studio condotto tra i pazienti su una terapia a lungo termine con prescrizione di oppioidi ha prodotto prove per contrastare la narrazione che l’uso di cannabis porta a riduzioni significative delle prescrizioni o della dose di oppioidi[35]. Questi risultati divergenti confermano la necessità di comprendere questa complessa questione. Ad oggi, manca una ricerca in contesti reali che esplori il potenziale di risparmio di oppioidi della cannabis tra le persone ad alto rischio che potrebbero essere impegnate in frequenti usi illeciti di oppioidi per gestire il dolore. Abbiamo quindi cercato di esaminare se la frequenza dell’uso di cannabis fosse correlata alla frequenza dell’uso illecito di oppioidi tra i PWUD che riferiscono di convivere con il dolore cronico a Vancouver, in Canada, scenario di una crisi di overdose di oppioidi in corso.
Metodi
Campione di studio
I dati per questo studio sono stati ricavati da 2 studi prospettici aperti in corso di coorte di PWUD a Vancouver, Canada. Il Vancouver Injection Drug Users Study (VIDUS) consiste in persone sieropositive che fanno uso di droghe iniettabili[36]. L’AIDS Care Cohort to Evaluating Exposure to Survival Services (ACCESS) consiste in persone che vivono con l’HIV e fanno uso di droghe[37]. Lo studio attuale, annidato all’interno di queste coorti, è stato concepito come parte di un più ampio progetto di ricerca di dottorato (SL) che esamina l’uso di cannabis e l’accesso tra i PWUD nel contesto del cambiamento della politica della cannabis e della crisi di overdose di oppioidi in corso[38]. Il piano di analisi per questo studio è fornito nel testo S1. Questo studio è riportato secondo le linee guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia (STROBE) per gli studi di coorte(S1 Checklist).
Il reclutamento per gli studi di coorte è in corso dal 1996 (VIDUS) e dal 2005 (ACCESS) attraverso un ampio raggio di azione in varie aree del centro di Vancouver, incluso il Downtown Eastside (DTES), un quartiere a basso reddito con un mercato aperto di droghe illecite e una diffusa emarginazione e criminalizzazione. Per essere ammessi al VIDUS, i partecipanti devono segnalare l’uso di droghe per via parenterale nei 30 giorni precedenti all’iscrizione. Per essere idonei all’ACCESSO, i partecipanti devono dichiarare di aver fatto uso di una droga illecita (diversa o in aggiunta alla cannabis, che era una sostanza controllata secondo la legge canadese fino al 17 ottobre 2018) nei 30 giorni precedenti all’iscrizione. Per entrambe le coorti, il sierostato dell’HIV è confermato attraverso la sierologia. Altri requisiti di idoneità includono l’età di 18 anni o più, la residenza nel Distretto Regionale di Metro Vancouver e il consenso informato scritto. A parte le valutazioni specifiche per l’HIV, tutti gli strumenti di studio e le procedure di follow-up sono armonizzati tra i due studi per facilitare l’analisi e l’interpretazione combinata dei dati.
Al momento dell’iscrizione allo studio, i partecipanti compilano un questionario di base gestito dall’intervistatore. Successivamente, ogni 6 mesi, i partecipanti possono compilare un questionario di follow-up. I questionari raccolgono informazioni sulle caratteristiche socio-demografiche, sulla vita (baseline) e sui modelli di consumo di sostanze negli ultimi 6 mesi (baseline, follow-up), sui comportamenti a rischio, sull’utilizzo delle cure sanitarie, sull’esposizione sociale e strutturale e su altri fattori correlati alla salute. Gli infermieri raccolgono campioni di sangue per il test HIV (VIDUS) o il monitoraggio clinico dell’HIV (ACCESS) e la sierologia del virus dell’epatite C, fornendo, se necessario, i riferimenti ai servizi sanitari appropriati. Ai partecipanti viene fornito un onorario di Can$40 per la loro partecipazione ad ogni visita di studio.
Dichiarazione etica
L’approvazione etica per questo studio è stata concessa dalla University of British Columbia/Providence Health Care Research Ethics Board (VIDUS: H14-01396; ACCESSO: H05-50233). Il consenso informato scritto è stato ottenuto da tutti i partecipanti allo studio.
Misure
Per esaminare l’uso di oppioidi e cannabis illeciti per una possibile gestione ad hoc del dolore tra i PWUD, abbiamo limitato il campione di studio a individui che soffrono di dolore maggiore o persistente. A partire dal periodo di follow-up 17 (giugno 2014), al questionario dello studio è stata aggiunta la seguente domanda: “Negli ultimi 6 mesi, avete avuto dolori maggiori o persistenti (a parte mal di testa, distorsioni, ecc.)?” Abbiamo incluso tutte le osservazioni dei partecipanti a partire dalla prima intervista di follow-up in cui hanno riportato dolori cronici. Per esempio, un partecipante che ha risposto “no” alla domanda sul dolore al follow-up 17 e “sì” al follow-up 18 sarebbe stato incluso a partire dal follow-up 18. Ai fini di queste analisi, questo primo periodo di follow-up con un rapporto sul dolore è considerato l’intervista “di base”.
L’esito di interesse è stato l’uso frequente di oppioidi illeciti, definiti come l’uso quotidiano (una o più volte al giorno) di eroina o di oppioidi farmaceutici (deviati, contraffatti o non – come prescritto) per iniezione o non iniezione (cioè, fumo, sniffare o somministrazione orale) nei 6 mesi precedenti. Questo risultato è stato catturato attraverso 4 diverse domande in più parti basate sulla classe di oppioidi (cioè eroina e oppioidi farmaceutici) e sulle modalità di somministrazione (cioè iniezione e non iniezione). Per esempio, ad ogni periodo di 6 mesi, l’uso di eroina per iniezione è stato valutato attraverso la domanda: “Negli ultimi 6 mesi, quando ha fatto uso di eroina, quali dei seguenti farmaci per via endovenosa ha usato e con quale frequenza?”Agli intervistati è stato fornito un elenco delle droghe comunemente iniettate, inclusa l’eroina, ed è stato chiesto di stimare la loro frequenza media di iniezione negli ultimi 6 mesi secondo le seguenti classificazioni: <1/mese, 1-3/mese, 1/ settimana, 2-3/settimana, ≥1/giorno. Una domanda identica per i farmaci non iniettabili ha valutato la frequenza dell’uso di eroina non iniettabile. L’iniezione di oppioidi farmaceutici è stata valutata attraverso la domanda “Negli ultimi 6 mesi, ha iniettato uno dei seguenti oppioidi su prescrizione? In caso affermativo, con quale frequenza li ha iniettati?” Ai partecipanti è stato fornito un elenco di oppiacei farmaceutici con le relative immagini per facilitarne l’identificazione. La domanda è stata ripetuta per l’uso non iniettato di oppioidi farmaceutici, e le categorie di frequenza erano identiche a quelle sopra elencate. Utilizzando le categorizzazioni di frequenza di queste 4 domande, i partecipanti che hanno approvato l’iniezione quotidiana o la non iniezione di eroina o di oppioidi farmaceutici per i 6 mesi precedenti sono stati codificati come “1” per l’esito (cioè l’uso quotidiano di oppioidi illeciti) per quel periodo di follow-up. La principale variabile indipendente era l’uso di cannabis, catturata attraverso la domanda “Negli ultimi 6 mesi, avete usato marijuana (sia medica che non medica) per qualsiasi motivo (ad esempio, per curare una condizione medica o per un motivo non medico, come sballarsi)?” A coloro che hanno risposto “sì” è stato anche chiesto di stimare la loro frequenza media di uso negli ultimi 6 mesi secondo le categorie di frequenza sopra descritte. La frequenza è stata ulteriormente categorizzata come “giornaliera” (cioè, ≥1/giorno), “occasionale” (cioè, <1/mese, 1-3/mese, 1/ settimana, 2-3/settimana), e “nessuna” (nessun uso di cannabis; categoria di riferimento). Le sezioni del questionario usate per la restrizione del campione e la costruzione della variabile principale sono fornite nel testo S2.
Abbiamo anche considerato diversi fattori socio-demografici, legati all’uso di sostanze e alla salute, con il potenziale di confondere l’associazione tra l’uso di cannabis e l’uso illecito di oppioidi. Le variabili socio-demografiche secondarie incluse in questa analisi sono state il sesso (maschio contro femmina), la razza (bianco contro altro), l’età (in anni), l’occupazione (sì contro no), la carcerazione (sì contro no), la condizione di senzatetto (sì contro no) e la residenza nel quartiere DTES (sì contro no). Abbiamo considerato i seguenti modelli di consumo di sostanze: consumo giornaliero di crack o cocaina (sì contro no), consumo giornaliero di metanfetamine (sì contro no) e consumo giornaliero di alcolici (sì contro no). I fattori sanitari che sono stati ipotizzati per influenzare l’associazione tra la cannabis e l’uso di oppiacei sono stati l’iscrizione al trattamento agonistico degli oppiacei (ad esempio, metadone o buprenorfina /naloxone; sì contro no), il sierostato HIV (HIV-positivo contro HIV-negativo), la prescrizione per il dolore (compresi gli oppiacei su prescrizione; sì contro no), e il livello medio di dolore delle ultime settimane (lieve-moderata, grave, o nessuno). La variabile del dolore è stata autodichiarata usando una scala del dolore che va da 0 (nessun dolore) a 10 (dolore peggiore possibile). Abbiamo usato 3 come cut-point per il dolore lieve-moderno e 7 come cut-point per il dolore moderato-grave. Anche se non esiste uno standard universale per la categorizzazione del dolore, questi punti di taglio sono comuni e sono stati validati in altre popolazioni di dolore[39]. A causa del basso numero di cellule per il dolore lieve (punteggio 1-3), abbiamo fatto crollare questa variabile con il dolore moderato (4-6) per creare la categoria mite-moderata. Ad eccezione del sesso e della razza, tutte le variabili sono aggiornate nel tempo e si riferiscono a comportamenti ed esposizioni nei 6 mesi precedenti l’intervista. Tutte le variabili, ad eccezione dello stato di sieropositività, sono state derivate attraverso l’autodenuncia. Poiché i dati per il presente studio sono stati ricavati da 2 grandi studi di coorte con obiettivi più ampi di monitoraggio dei cambiamenti dei modelli di salute e di consumo di sostanze nella comunità, i partecipanti allo studio e gli intervistatori non hanno visto l’obiettivo di questo particolare studio.
Analisi statistica
Abbiamo esplorato le differenze nelle caratteristiche alla linea di base in base allo stato di consumo giornaliero di cannabis (contro occasionale/nessuno) usando test chi-squared per variabili categoriche e test Wilcoxon rank-sum per variabili continue. Poi, abbiamo stimato le associazioni bivariabili tra ogni variabile indipendente e il risultato, l’uso illecito giornaliero di oppioidi, utilizzando modelli lineari generalizzati ad effetti misti (GLMM) con una funzione di logit-link per tenere conto delle misure ripetute all’interno degli individui nel tempo. Successivamente, abbiamo costruito un GLMM multivariabile per stimare l’associazione corretta tra la frequenza del consumo di cannabis e l’uso illecito di oppioidi. Abbiamo usato l’approccio dell’operatore di restringimento e selezione meno assoluto (LASSO) per determinare quali variabili includere nel modello multivariabile. Questo metodo utilizza un parametro di sintonizzazione per penalizzare il modello basato sul valore assoluto della grandezza dei coefficienti (cioè, la regolarizzazione L1), restringendo alcuni coefficienti fino a 0 (cioè, indicando la loro rimozione dal GLMMM multivariabile). La quadruplice convalida incrociata è stata utilizzata per determinare il valore ottimale del parametro di sintonia. Le GLMM sono state stimate utilizzando casi completi (98,6%-100% delle osservazioni per le stime bivariabili; 99,0% delle osservazioni per le stime multivariabili).
Nel periodo di follow-up più recente (dal 1 giugno 2017 al 1 dicembre 2017), i partecipanti che hanno segnalato un qualsiasi uso di cannabis nel precedente periodo di 6 mesi erano idonei per la domanda di follow-up: “Perché l’hai usata?” Gli intervistati potevano selezionare più opzioni da una lista di risposte o offrire un motivo alternativo sotto “Altro”. Questi dati sono stati analizzati in modo descrittivo, e le differenze tra i consumatori di cannabis di almeno un giorno e quelli di meno di un giorno sono state analizzate usando un chi-squared test, o il test di Fisher per il conteggio delle piccole cellule.
Tutte le analisi sono state eseguite in RStudio (versione 1.1.456; R Foundation for Statistical Computing, Vienna, Austria). Tutti i valori p sono a due facce.
Risultati
Tra il 1° giugno 2014 e il 1° dicembre 2017, 1.489 partecipanti hanno completato almeno una visita di studio e sono stati considerati potenzialmente idonei per queste analisi. Di questi, 13 partecipanti sono stati eliminati a causa della mancanza di dati sulla variabile fissa per la gara(n = 9), della mancata risposta alla domanda sul dolore(n = 1), o di colloqui multipli durante un singolo periodo di follow-up(n = 3). Dei restanti 1.476 partecipanti, 1.152 (78,0%) hanno riferito un dolore maggiore o persistente durante almeno un periodo di follow-up di 6 mesi e sono stati inclusi in questa analisi. Abbiamo considerato tutte le osservazioni di questi individui a partire dal primo rapporto di dolore cronico, ottenendo 5.350 osservazioni di studio, pari a 2.676,5 anni-persona di osservazione. Nel campione analitico c’erano 424 (36,8%) partecipanti femminili e l’età mediana alla prima intervista analitica era di 49,3 anni (IQR 42,3-54,9).
Durante il periodo di studio, un totale di 410 (35.6%) intervistati hanno riportato un uso giornaliero di cannabis e 557 (48.4%) hanno riportato un uso occasionale di cannabis durante almeno uno dei 6 mesi di follow-up; 455 (39.5%) hanno riportato un uso giornaliero di oppioidi illeciti durante almeno uno dei 6 mesi di follow-up. Al baseline (cioè la prima intervista in cui è stato riportato il dolore cronico), 583 (50,6%) partecipanti hanno fatto uso di cannabis occasionalmente(n = 322; 28,0%) o quotidianamente(n = 261; 22,7%), e 269 (23,4%) hanno fatto uso di oppioidi illeciti al giorno. Al livello di base, 693 (60,2%) partecipanti si sono auto-rappresentati con una diagnosi di dolore cronico a vita che includeva dolore osseo, meccanico o compressivo (n = 347; 50,1%); dolore infiammatorio( n = 338; 48,8%); dolore neuropatico( n = 129; 18,6%); dolore muscolare( n = 54; 7,8%); mal di testa/migraine( n = 41; 5,9%); e altri dolori( n = 53; 7,6%).
Latabella 1 fornisce un riassunto delle caratteristiche di base del campione stratificato in base allo stato di consumo giornaliero di cannabis (sì contro no). Il consumo giornaliero di cannabis alla linea di base era significativamente più comune tra gli uomini (odds ratio [OR] 1,76, 95% 95% CI 1,30-2,38, p < 0,001) e significativamente meno comune tra coloro che usavano quotidianamente oppioidi illeciti (OR 0,54, 95% CI 0,37-0,77, p < 0,001).
| Caratteristica | Consumo giornaliero di cannabis | Quoziente di probabilità (95% CI) | p-Valore | |
|---|---|---|---|---|
| Sì, n = 261 (22,7%) | No, n = 891 (77,3%) | |||
| Età, anni, mediana (IQR) | 49.0 (42.0–54.5) | 49.6 (42.4–48.5) | 0.99 (0.98–1.01) | 0.391 |
| Sesso | ||||
| Maschio | 190 (72.8) | 538 (60.4) | 1.76 (1.30–2.38) | <0.001 |
| Femmina | 71 (27.2) | 353 (39.6) | 1.00 | |
| Gara | ||||
| Bianco | 140 (53.6) | 491 (55.1) | 0.94 (0.71–1.24) | 0.728 |
| Altro | 121 (46.4) | 400 (44.9) | 1.00 | |
| Occupazione* | ||||
| Sì | 74 (28.4) | 206 (23.1) | 1.32 (0.96–1.80) | 0.099 |
| No | 187 (71.6) | 685 (76.9) | 1.00 | |
| Incarcerazione* | ||||
| Sì | 15 (5.8) | 49 (5.5) | 1.05 (0.58–1.91) | 0.985 |
| No | 244 (94.2) | 840 (94.5) | 1.00 | |
| Residenza Downtown Eastside* | ||||
| Sì | 141 (54.0) | 521 (58.5) | 0.83 (0.63–1.10) | 0.227 |
| No | 120 (46.0) | 370 (41.5) | 1.00 | |
| Senzatetto* | ||||
| Sì | 31 (11.9) | 148 (16.3) | 0.68 (0.45–1.03) | 0.066 |
| No | 229 (88.1) | 742 (83.4) | 1.00 | |
| Trattamento agonista a base di oppioidi* | ||||
| Sì | 129 (49.4) | 470 (53.3) | 0.86 (0.65–1.13) | 0.304 |
| No | 132 (50.6) | 412 (46.7) | 1.00 | |
| Uso di crack/cocaina* | ||||
| Almeno giornalmente | 43 (16.5) | 142 (16.0) | 1.04 (0.72–1.51) | 0.916 |
| Meno del quotidiano | 218 (83.5) | 748 (84.0) | 1.00 | |
| Uso di metanfetamine* | ||||
| Almeno giornalmente | 22 (8.4) | 102 (11.5) | 0.71 (0.44–1.15) | 0.202 |
| Meno del quotidiano | 239 (91.6) | 788 (88.6) | 1.00 | |
| Consumo di alcolici* | ||||
| Almeno giornalmente | 28 (10.9) | 83 (9.4) | 1.18 (0.75–1.86) | 0.467 |
| Meno del quotidiano | 229 (89.1) | 803 (90.6) | 1.00 | |
| Uso illecito di oppioidi* | ||||
| Almeno giornalmente | 40 (15.3) | 229 (25.7) | 0.52 (0.36–0.76) | <0.001 |
| Meno del quotidiano | 221 (84.7) | 662 (74.3) | 1.00 | |
| Stato HIV | ||||
| HIV+ | 112 (42.9) | 408 (45.8) | 0.89 (0.67–1.18) | 0.452 |
| HIV- | 149 (57.1) | 483 (54.2) | 1.00 | |
| Prescrizione per il dolore* | ||||
| Sì | 139 (54.1) | 413 (47.3) | 1.31 (0.99–1.74) | 0.064 |
| No | 118 (45.9) | 461 (52.7) | 1.00 | |
| Livello medio di dolore della settimana passata | ||||
| Severo | 101 (38.5) | 330 (37.0) | 1.24 (0.72–2.15) | 0.525 |
| Morbido e moderato | 139 (53.4) | 474 (53.2) | 1.19 (0.69–2.03) | 0.618 |
| Nessuno | 19 (7.3) | 77 (8.7) | 1.00 | |
Nelle analisi longitudinali bivariabili(Tabella 2), il consumo giornaliero di cannabis è stato significativamente e negativamente associato all’uso quotidiano di oppioidi illeciti (OR 0,60, 95% CI 0,40-0,90, p = 0, 013). Altri fattori che sono stati associati negativamente con l’uso illegale giornaliero di oppioidi nelle analisi grezze sono stati l’età (OR 0.90 per anno più vecchio, 95% CI 0.88-0.92, p < 0.001), l’occupazione (OR 0.73, 95% CI 0.54-0,99, p = 0,044 ), sieropositività all’HIV (OR 0,41, 95% CI 0,26-0,65, p < 0, 001), e con prescrizione di antidolorifici (OR 0,67, 95% CI 0,51-0,88, p = 0,004). Sono state rilevate significative associazioni positive con l’uso quotidiano di oppioidi illegali per la residenza DTES (OR 2,71, 95% CI 1,99-3,69, p < 0,001), senza fissa dimora (OR 2,95, 95% CI 2,06-4,20, p < 0,001), incarcerazione (OR 2,00, 95% CI 1,16-3,46, p = 0,013), uso quotidiano di crack o cocaina (OR 2.77, 95% CI 1,94-3,96, p < 0,001), uso giornaliero di metanfetamine (OR 6,63, 95% CI 4,31-10,19, p < 0,001), e livello di dolore (OR 1,33, 95% CI 1,00-1,76, p = 0,046, per dolore lieve-moderato; OR 1,75, 95% CI 1,28-2,38, p < 0,001, per dolore grave ). Come mostrato nella Tabella 2, dopo l’aggiustamento per i confonditori, le probabilità di consumo giornaliero di oppioidi illeciti erano significativamente più basse durante i periodi di consumo giornaliero di cannabis (OR 0,50 corretto, 95% CI 0,33-0,74, p < 0, 001), ma non durante i periodi di consumo occasionale (OR 0,94 corretto, 95% CI 0,69-1,27, p = 0,682), rispetto ai periodi di non consumo di cannabis.
| Caratteristica | Non regolato | Aggiustato | ||
|---|---|---|---|---|
| OR (95% CI) | p-Valore | OR (95% CI) | p-Valore | |
| Uso di cannabis* | ||||
| Occasionale contro nessuno | 1.04 (0.77–1.40) | 0.818 | 0.94 (0.69–1.27) | 0.682 |
| Tutti i giorni contro nessuno | 0.60 (0.40–0.90) | 0.013 | 0.50 (0.33–0.74) | <0.001 |
| Sesso | ||||
| Maschio contro femmina | 0.65 (0.41–1.03) | 0.067 | ||
| Età | ||||
| All’anno più vecchio | 0.90 (0.88–0.92) | <0.001 | 0.92 (0.90–0.94) | <0.001 |
| Gara | ||||
| Bianco contro altri | 0.98 (0.62–1.54) | 0.920 | ||
| Periodo di follow-up | ||||
| Per ogni intervallo di 6 mesi | 0.99 (0.94–1.05) | 0.767 | ||
| Residenza nel centro di Eastside* | ||||
| Sì contro no | 2.71 (1.99–3.69) | <0.001 | 2.12 (1.54–2.90) | <0.001 |
| Senzatetto* | ||||
| Sì contro no | 2.95 (2.07–4.21) | <0.001 | 1.91 (1.33–2.73) | <0.001 |
| Incarcerazione* | ||||
| Sì contro no | 2.00 (1.16–3.46) | 0.013 | 1.27 (0.73–2.22) | 0.393 |
| Occupazione* | ||||
| Sì contro no | 0.73 (0.54–0.99) | 0.044 | 0.79 (0.58–1.07) | 0.134 |
| Terapia agonista con oppioidi* | ||||
| Sì contro no | 0.90 (0.66–1.22) | 0.495 | ||
| Consumo giornaliero di alcolici* | ||||
| Sì contro no | 0.91 (0.57–1.44) | 0.673 | ||
| Uso quotidiano di crack/cocaina* | ||||
| Sì contro no | 2.77 (1.94–3.96) | <0.001 | 2.74 (1.93–3.90) | <0.001 |
| Uso quotidiano di metanfetamine* | ||||
| Sì contro no | 6.63 (4.31–10.19) | <0.001 | 4.60 (3.02–7.02) | <0.001 |
| Sierostato HIV | ||||
| Positivo contro negativo | 0.41 (0.26–0.65) | <0.001 | 0.48 (0.32–0.74) | <0.001 |
| Prescrizione del dolore* | ||||
| Sì contro no | 0.67 (0.51–0.88) | 0.004 | 0.86 (0.65–1.13) | 0.274 |
| Tasso medio di dolore della settimana passata | ||||
| Morbido-moderno contro nessuno | 1.33 (1.00–1.75) | 0.046 | ||
| Grave contro nessuno | 1.75 (1.29–2.37) | <0.001 | ||
Dei 414 consumatori di cannabis giornalieri e occasionali intervistati dal 1° giugno 2017 al 1° dicembre 2017, le motivazioni più comunemente riportate per l’uso erano di tipo ricreativo (ad es, per sballarsi, socializzare; n = 237; 57,2%), per gestire il dolore(n = 148; 35,7%), per aiutare a dormire( n = 144; 34,8%), per gestire lo stress( n = 127; 30,7%), per curare la nausea o la perdita di appetito( n = 123; 29,7%), e per ridurre l’uso di altre sostanze/trattamento dipendenza o astinenza( n = 53; 12,8%). L’autodenuncia del dolore, l’insonnia, lo stress, la nausea, la salute mentale, l’HIV e la spiritualità come ragioni per l’uso erano tutte molto più comuni per i consumatori quotidiani di cannabis rispetto ai consumatori occasionali(p < 0, 05; Fig 1).
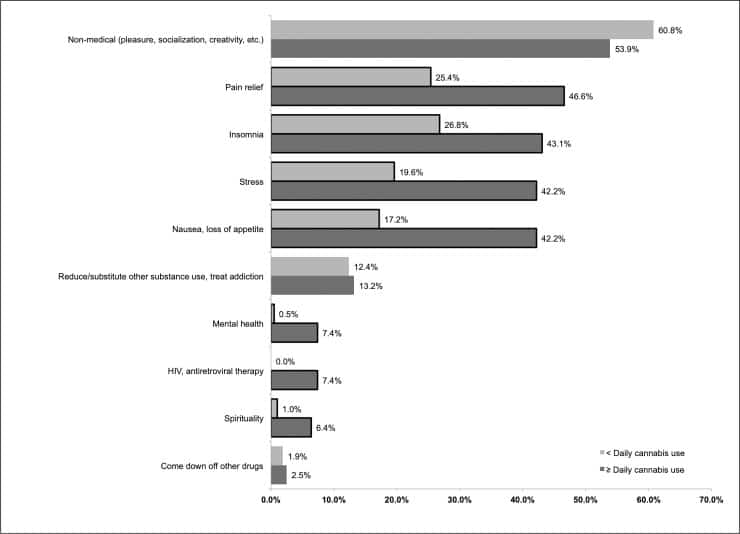
Fig 1.Fig 1. Ragioni autodenunciate per il consumo di cannabis tra i consumatori di cannabis giornalieri(n = 204) e occasionali(n = 210) che fanno uso di droghe con dolore cronico, giugno-dicembre 2017.I confini indicano il chi-squared o il test di Fisher p < 0,05 ( test di Fisher usato per il confronto tra salute mentale e HIV).

Fig. 1.Fig. 1. Motivi autodenunciati per l’uso di cannabis tra le persone che fanno uso quotidiano(n = 204) e occasionale(n = 210) di cannabis che fanno uso di droghe con dolore cronico, giugno-dicembre 2017.I confini indicano chi-squared o il test di Fisher p < 0,05 ( il test di Fisher usato per la salute mentale e il confronto con l’HIV).
Discussione
In questo studio longitudinale che esamina i modelli di frequenza della cannabis e dell’uso illecito di oppioidi negli ultimi 6 mesi, abbiamo trovato che le probabilità di uso quotidiano di oppioidi illeciti erano più basse (di circa la metà) tra coloro che hanno segnalato l’uso quotidiano di cannabis rispetto a coloro che non ne hanno segnalato l’uso. Tuttavia, non abbiamo osservato alcuna associazione significativa tra l’uso occasionale di cannabis e l’uso giornaliero di oppioidi, suggerendo che ci possa essere un elemento terapeutico intenzionale associato all’uso frequente di cannabis. Ciò è supportato da dati trasversali del campione in cui sono state osservate alcune ragioni per l’uso di cannabis che differiscono a seconda della frequenza del consumo di cannabis. In particolare, i consumatori giornalieri hanno riportato più motivazioni terapeutiche per il consumo di cannabis (tra cui il dolore, lo stress, la nausea, la salute mentale, o i sintomi dell’HIV o della terapia antiretrovirale, o per migliorare il sonno) rispetto ai consumatori occasionali, e le motivazioni non mediche – anche se comuni a tutti i consumatori – non sono state segnalate con maggiore probabilità dai consumatori giornalieri. Insieme, i nostri risultati suggeriscono che il PWUD che prova dolore potrebbe usare la cannabis come strategia ad hoc (cioè, improvvisata, auto-diretta) per ridurre la frequenza dell’uso di oppioidi.
Un recente studio ha analizzato i dati longitudinali di un’ampia indagine nazionale statunitense sulla salute e ha rilevato che il consumo di cannabis aumenta, piuttosto che diminuire, il rischio di un futuro uso non medico di oppioidi su prescrizione nella popolazione generale[40], fornendo importanti prove per contestare l’ipotesi che l’aumento dell’accesso alla cannabis faciliti la riduzione del consumo di oppioidi. I risultati del nostro studio rivelano una relazione contrastante tra il consumo di cannabis e la frequenza dell’uso di oppioidi, probabilmente dovuta a differenze intrinseche nelle popolazioni campionate e alle loro motivazioni per l’uso di cannabis. All’interno dell’attuale popolazione dello studio, l’uso di poli-sostanze è la norma; l’HIV e le comorbidità correlate sono comuni; e la gestione del dolore attraverso gli oppioidi prescritti è spesso negata, aumentando la probabilità di un uso non medico di oppioidi per una condizione medica[6,9]. Inoltre, il nostro studio si concentra in gran parte su questa relazione nel contesto del dolore (cioè, esaminando gli individui con dolore autodenunciato e tenendo conto dell’intensità del dolore). I nostri risultati si allineano più strettamente con quelli di un recente studio condotto tra pazienti sieropositivi che vivono con dolore cronico, in cui gli autori hanno trovato che i pazienti che hanno segnalato l’uso di cannabis nel corso dei mesi passati avevano una probabilità significativamente minore di assumere oppioidi prescritti[41]. Mentre questa scoperta potrebbe essere il risultato della negazione della prescrizione associata all’uso di cannabis (o di qualsiasi droga illecita), noi dimostriamo che i consumatori giornalieri di cannabis in questo contesto erano leggermente più propensi a ricevere una prescrizione di antidolorifici al basale, e l’aggiustamento di questo fattore in un modello multivariabile longitudinale non ha negato la significativa associazione negativa dell’uso frequente di cannabis con l’uso frequente di oppioidi illeciti.
L’idea della cannabis come coadiuvante o sostituto degli oppioidi nella gestione del dolore cronico ha recentemente guadagnato una più seria considerazione da parte di alcuni medici e scienziati. Un numero crescente di studi che coinvolgono pazienti che usano cannabis per gestire il dolore dimostrano riduzioni nell’uso di analgesici su prescrizione accanto a risultati favorevoli nella gestione del dolore[24-33]. Per esempio, Boehnke et al. hanno trovato che i pazienti con dolore cronico hanno riportato una riduzione media del 64% nell’uso di oppioidi su prescrizione dopo l’inizio della cannabis, insieme a un aumento medio del 45% della qualità di vita auto-riferita[29]. Degenhardt et al. hanno trovato che, in una coorte di pazienti australiani su prescrizione di oppiacei per il dolore cronico, quelli che usano cannabis per il sollievo dal dolore (6% dei pazienti al basale) hanno riportato una migliore analgesia da un uso aggiuntivo di cannabis (70% di riduzione media del dolore) rispetto al solo uso di oppiacei (50% di riduzione media)[33]. Tuttavia, ricerche più recenti di alta qualità hanno presentato risultati per mettere in discussione questa narrazione. Per esempio, nell’analisi di follow-up di 4 anni della suddetta coorte australiana di pazienti affetti da dolore, non sono state osservate associazioni temporali significative fra l’uso di cannabis (occasionale o frequente) e un certo numero di risultati, fra cui la dose di oppiacei prescritta, la gravità del dolore, l’interruzione dell’uso di oppiacei e l’interferenza del dolore[35]. Quindi, diverse altre spiegazioni per i nostri risultati attuali, a parte un effetto di risparmio di oppioidi, sono degne di considerazione.
Abbiamo scelto di includere individui con dolore cronico indipendentemente dal loro stato di consumo di oppioidi per evitare l’esclusione di individui che potrebbero aver già cessato l’uso illecito di oppioidi alla linea di base, poiché questi individui potrebbero riflettere un sottocampione importante di quelli già impegnati nella sostituzione della cannabis. D’altra parte, in questo studio ci possono essere caratteristiche importanti, non correlate al dolore, tra i consumatori regolari di cannabis in questo studio che li predispongono a fare un uso meno frequente o a non fare uso illecito di oppioidi all’inizio. Abbiamo cercato di misurare e controllare questi fattori, ma non possiamo escludere la possibilità di una connessione spuria. Per esempio, gli individui di questa coorte che consumano cannabis quotidianamente a scopo terapeutico possono semplicemente possedere una maggiore autoefficacia per gestire i problemi di salute e controllare il loro uso di oppioidi[42]. Tuttavia, è degno di nota il fatto che la nostra scoperta è in linea con uno studio precedente che dimostra che l’uso di cannabis è correlato con una minore frequenza di uso illecito di oppioidi tra un campione di persone che si iniettano droghe in California, tutti consumatori di oppioidi illeciti[43]. Il nostro studio si basa su questo lavoro affrontando il dolore cronico, ottenendo informazioni dettagliate sulle motivazioni del consumo di cannabis ed esaminando i modelli longitudinali.
Abbiamo osservato che i consumatori giornalieri di cannabis hanno approvato l’uso intenzionale della cannabis per una serie di scopi terapeutici che possono influenzare il dolore e l’interferenza del dolore. Dopo il dolore, l’insonnia (43%) e lo stress (42%) sono state le seconde e le terze motivazioni più comunemente segnalate per l’uso terapeutico della cannabis tra i consumatori giornalieri di cannabis. L’incapacità di addormentarsi e l’incapacità di rimanere addormentati sono sintomi comuni delle condizioni che causano dolore[44], e l’esperienza di questi sintomi aumenta la probabilità di abuso di oppioidi tra i pazienti con dolore cronico[45]. Si ritiene che la relazione tra la privazione del sonno e il dolore sia bidirezionale[44,46], suggerendo che una migliore gestione del sonno può migliorare gli esiti del dolore. Allo stesso modo, lo stress psicologico (in particolare negli anni dello sviluppo) è un predittore consolidato del dolore cronico[47] ed è anche probabile che derivi dal dolore cronico. Quindi, un’altra possibile spiegazione per la nostra scoperta è che l’uso di cannabis sostituisce certe pratiche di uso di sostanze ad alto rischio nell’affrontare questi problemi associati al dolore senza necessariamente affrontare il dolore stesso.
In particolare, le nostre scoperte sono coerenti con la conoscenza emergente della forma e della funzione dei sistemi recettoriali degli endocannabinoidi e degli oppioidi umani. Il sistema dei cannabinoidi endogeni, composto da recettori (cannabinoidi di tipo 1 [CB1] e tipo 2 [CB2]) e modulatori (endocannabinoidi anandamide e 2-arachidonoilglicerolo), è coinvolto nei principali percorsi di elaborazione del dolore[48]. La co-localizzazione dei recettori degli endocannabinoidi e dei μ-opioidi nel cervello e nelle regioni spinali coinvolte nell’antinocicettazione [49], e la modifica della risposta nocicettiva di un sistema attraverso la modulazione dell’altro [50,51],ha sollevato la possibilità che il fitocannabinoide tetraidrocannabinolo (THC) possa interagire sinergicamente con gli oppioidi per migliorare la gestione del dolore. Una recente revisione sistematica e meta-analisi ha trovato forti prove di un effetto di risparmio di oppioidi per la cannabis nei modelli di dolore animale, ma poche prove da 9 studi sull’uomo[23]. Tuttavia, gli autori della meta-analisi hanno identificato diversi importanti limiti che potenzialmente impediscono a questi studi nell’uomo di rilevare un effetto, tra cui le basse dimensioni del campione, le dosi singole, le dosi di oppioidi sub-terapeutiche e la mancanza di placebo[23]. Da allora, Cooper e colleghi hanno pubblicato i risultati di uno studio in doppio cieco, controllato con placebo, all’interno di un soggetto, in cui hanno trovato che la soglia del dolore e la tolleranza sono migliorate significativamente quando una dose non analgesica di un oppioide è stata somministrata insieme a una dose non analgesica di cannabis[52]. Suggestivi di un effetto sinergico, questi risultati forniscono la prova del potenziale della cannabis di abbassare la dose di oppioidi necessaria per ottenere un sollievo dal dolore [52].
Infine, c’è una ricerca clinica preclinica e pilota che suggerisce che i cannabinoidi, in particolare il cannabidiolo (CBD), possono avere un ruolo nel ridurre l’ansia e le voglie indotte dall’eroina[53] e i sintomi dell’astinenza[54]. Anche se preliminare, questa ricerca sostiene l’idea che la cannabis può essere usata anche per stabilizzare i soggetti in astinenza da oppioidi, come complemento agli oppioidi prescritti per gestire il disturbo da uso di oppioidi, o come strategia di riduzione del danno. Sebbene questa evidenza si estenda oltre i pazienti affetti da dolore cronico, merita di essere presa in considerazione in questa sede, data la storia condivisa dell’uso di sostanze illecite tra i campioni dello studio. Non è chiaro quale ruolo possano aver avuto la riduzione del danno o le motivazioni del trattamento nello studio attuale, dato che i consumatori giornalieri e occasionali non differivano in modo significativo nel segnalare l’uso di cannabis come strategia per ridurre o trattare l’uso di altre sostanze. Il fenomeno dell’uso di cannabis come strumento per ridurre la frequenza dell’iniezione di oppioidi è stato evidenziato attraverso un lavoro qualitativo in altri contesti[55], ma sono necessarie ulteriori ricerche per determinare se questo modello è abbastanza diffuso da produrre un effetto osservabile. Gli studi clinici che possono randomizzare i partecipanti a un intervento con la cannabis saranno fondamentali per stabilire l’efficacia della cannabis sia per la gestione del dolore che come terapia aggiuntiva per la gestione del disturbo da uso di oppioidi. Tali studi comincerebbero a far luce sul fatto che la scoperta attuale potrebbe essere causale, quali potrebbero essere i meccanismi sottostanti e come ottimizzare gli interventi a base di cannabis in contesti clinici o comunitari.
Ci sono diverse importanti limitazioni a questo studio che dovrebbero essere prese in considerazione. In primo luogo, le coorti non sono campioni casuali di PWUD, limitando la capacità di generalizzare questi risultati all’intera comunità o ad altri contesti. L’età mediana più anziana del campione dovrebbe essere presa in considerazione soprattutto quando si interpretano questi risultati rispetto a quelli di altri contesti. In secondo luogo, come discusso in precedenza, non possiamo escludere la possibilità di confusione residua. In terzo luogo, a parte il sierostato dell’HIV, ci siamo basati sull’autodenuncia di tutte le variabili, compresi i modelli di utilizzo delle sostanze. Il lavoro precedente mostra che l’auto-rapporto del PWUD è affidabile e valido contro la verifica biochimica[56], e non abbiamo motivo di sospettare che le risposte sull’esito sarebbero diverse a seconda dello stato di consumo di cannabis, soprattutto perché questo studio è stato annidato all’interno di uno studio di coorte molto più ampio sull’uso generale di sostanze e sui modelli di salute all’interno della comunità. Anche il dolore maggiore o persistente, che ha qualificato gli intervistati per l’inclusione in questo studio, è stato autodenunciato. La nostra definizione di dolore cronico è probabilmente più sensibile di altre valutazioni del dolore cronico (ad esempio, diagnosi cliniche o valutazioni che catturano il tempo con il dolore). Sebbene più della metà (60%) del campione ha riferito di aver mai ricevuto una diagnosi di dolore, è possibile che alcuni degli intervistati inclusi non abbiano soddisfatto i criteri per una diagnosi formale di dolore cronico. Infine, non abbiamo raccolto informazioni sul tipo di cannabis, sul modo di somministrazione, sul contenuto di cannabinoidi (per esempio, percentuale di THC:percentuale di CBD), o sulla dose durante il periodo di studio. La ricerca futura dovrà affrontare queste lacune per fornire un quadro più dettagliato dell’uso strumentale della cannabis per il dolore e altri problemi di salute tra i PWUD.
Conclusioni
In conclusione, abbiamo trovato prove che suggeriscono che l’uso frequente di cannabis può servire come aggiunta o sostituzione dell’uso illecito di oppioidi tra i PWUD con dolore cronico a Vancouver. I risultati di questo studio hanno implicazioni per la sanità e per i fornitori di servizi di riduzione del danno. Nei pazienti affetti da dolore cronico con un background socio-strutturale e di uso di sostanze complesse, la cannabis può essere usata come mezzo per trattare i problemi di salute o per ridurre il danno correlato alle sostanze. Nel contesto dell’attuale crisi degli oppioidi e della recente introduzione di un quadro normativo nazionale per l’uso di cannabis in Canada, l’uso frequente di cannabis tra i PWUD con dolore può giocare un ruolo importante nella prevenzione o nella sostituzione del frequente uso illecito di oppioidi. I PWUD descrivono un’ampia gamma di motivazioni per il consumo di cannabis, alcune delle quali possono avere implicazioni più forti nel trattamento del dolore e del disturbo da consumo di oppioidi. Le discussioni tra paziente e medico su queste motivazioni possono aiutare a sviluppare un piano di trattamento che minimizzi la probabilità di strategie di gestione del dolore ad alto rischio, ma rimane chiara la necessità di ulteriore formazione e di una guida specifica per l’uso medico della cannabis per la gestione del dolore [57].
Informazioni di supporto
References
- Special Advisory Committee on the Epidemic of Opioid Overdoses. National report: apparent opioid-related deaths in Canada (released September 2018). Public Health Agency of Canada: Ottawa; 2018. Publisher Full Text
- Scholl L, Seth P, Kariisa M, Wilson N, Baldwin G. Drug and opioid-involved overdose deaths—United States, 2013–2017. MMWR Morb Mortal Wkly Rep. 2018; 67(51/52):1419-26. PubMed
- .Publisher Full Text
- Cicero TJ, Ellis MS, Surratt HL, Kurtz SP. The changing face of heroin use in the United States: a retrospective analysis of the past 50 years. JAMA Psychiatry. 2014; 71(7):821-6. DOI | PubMed
- Kolodny A, Courtwright DT, Hwang CS, Kreiner P, Eadie JL, Clark TW. The prescription opioid and heroin crisis: a public health approach to an epidemic of addiction. Annu Rev Public Health. 2015; 36:559-74. DOI | PubMed
- Voon P, Callon C, Nguyen P, Dobrer S, Montaner JSG, Wood E. Denial of prescription analgesia among people who inject drugs in a Canadian setting. Drug Alcohol Rev. 2015; 34(2):221-8. DOI | PubMed
- Dahlman D, Kral AH, Wenger L, Hakansson A, Novak SP. Physical pain is common and associated with nonmedical prescription opioid use among people who inject drugs. Subst Abuse Treat Prev Policy. 2017; 12(1):29. DOI | PubMed
- British Columbia Centre on Substance Use. Drug checking in British Columbia: March 2019. British Columbia Centre on Substance Use: Vancouver; 2019. Publisher Full Text
- Voon P, Callon C, Nguyen P, Dobrer S, Montaner J, Wood E. Self-management of pain among people who inject drugs in Vancouver. Pain Manag. 2014; 4(1):27-35. DOI | PubMed
- Dormer D.. Why overdose may be the wrong word when it comes to cannabis. CBC News. 2018. Publisher Full Text
- Fumano D.. Pop-up Vancouver pot dispensary an ‘outside the box’ approach to opioid crisis: Vancouver Sun. 2017. Publisher Full Text
- National Academies of Sciences, Engineering, and Medicine. The health effects of cannabis and cannabinoids: the current state of evidence and recommendations for research. National Academies Press: Washington (DC); 2017. Publisher Full Text
- Kim JH, Santaella-Tenorio J, Mauro CM, Cerda M, Keyes KM, Hasin D. State medical marijuana laws and the prevalence of opioids detected among fatally injured drivers. Am J Public Health. 2016; 106:2032-7. DOI | PubMed
- Bradford AC, Bradford WD. Medical marijuana laws may be associated with a decline in the number of prescriptions for Medicaid enrollees. Health Aff (Millwood). 2017; 36(5):945-51. DOI | PubMed
- Bradford AC, Bradford WD, Abraham A, Bagwell Adams G. Association between US state medical cannabis laws and opioid prescribing in the Medicare Part D population. JAMA Intern Med. 2018; 178(5):667-72. DOI | PubMed
- Shi Y, Liang D, Bao Y, An R, Wallace MS, Grant I. Recreational marijuana legalization and prescription opioids received by Medicaid enrollees. Drug Alcohol Depend. 2019; 194:13-9. DOI | PubMed
- Liang D, Bao Y, Wallace M, Grant I, Shi Y. Medical cannabis legalization and opioid prescriptions: evidence on US Medicaid enrollees during 1993–2014. Addiction. 2018; 113(11):2060-70. DOI | PubMed
- Shi Y.. Medical marijuana policies and hospitalizations related to marijuana and opioid pain reliever. Drug Alcohol Depend. 2017; 173:144-50. DOI | PubMed
- Powell D, Pacula RL, Jacobson M. Do medical marijuana laws reduce addictions and deaths related to pain killers?. J Health Econ. 2018; 58:29-42. DOI | PubMed
- Bachhuber MA, Saloner B, Cunningham CO, Barry CL. Medical cannabis laws and opioid analgesic overdose mortality in the United States, 1999–2010. JAMA Intern Med. 2014; 174(10):1668-73. DOI | PubMed
- Livingston MD, Barnett TE, Delcher C, Wagenaar AC. Recreational cannabis legalization and opioid-related deaths in Colorado, 2000–2015. Am J Public Health. 2017; 107(11):1827-9. DOI | PubMed
- Finney JW, Humphreys K, Harris AS. What ecologic analyses cannot tell us about medical marijuana legalization and opioid pain medication mortality. JAMA Intern Med. 2015; 175(4):655-6. DOI | PubMed
- Nielsen S, Sabioni P, Trigo JM, Ware MA, Betz-Stablein BD, Murnion B. Opioid-sparing effect of cannabinoids: a systematic review and meta-analysis. Neuropsychopharmacology. 2017; 42(9):1752-65. DOI | PubMed
- Reiman A, Welty M, Solomon P. Cannabis as a substitute for opioid-based pain medication: patient self-report. Cannabis Cannabinoid Res. 2017; 2(1):160-6. DOI | PubMed
- Lucas P, Walsh Z. Medical cannabis access, use, and substitution for prescription opioids and other substances: a survey of authorized medical cannabis patients. Int J Drug Policy. 2017; 42(Suppl C):30-5. DOI | PubMed
- Lucas P, Walsh Z, Crosby K, Callaway R, Belle-Isle L, Kay R. Substituting cannabis for prescription drugs, alcohol and other substances among medical cannabis patients: the impact of contextual factors. Drug Alcohol Rev. 2015; 35(3):326-33. DOI | PubMed
- Lucas P, Reiman A, Earleywine M, McGowan SK, Oleson M, Coward MP. Cannabis as a substitute for alcohol and other drugs: a dispensary-based survey of substitution effect in Canadian medical cannabis patients. Addiction Res Theory. 2013; 21(5):435-42. DOI
- Reiman A.. Cannabis as a substitute for alcohol and other drugs. Harm Reduct J. 2009; 6:35. DOI | PubMed
- Boehnke KF, Litinas E, Clauw DJ. Medical cannabis use is associated with decreased opiate medication use in a retrospective cross-sectional survey of patients with chronic pain. J Pain. 2016; 17(6):739-44. DOI | PubMed
- Baron EP, Lucas P, Eades J, Hogue O. Patterns of medicinal cannabis use, strain analysis, and substitution effect among patients with migraine, headache, arthritis, and chronic pain in a medicinal cannabis cohort. J Headache Pain. 2018; 19(1):37. DOI | PubMed
- Piper BJ, Beals ML, Abess AT, Nichols SD, Martin MW, Cobb CM. Chronic pain patients’ perspectives of medical cannabis. Pain. 2017; 158(7):1373-9. DOI | PubMed
- Corroon JM, Mischley LK, Sexton M. Cannabis as a substitute for prescription drugs—a cross-sectional study. J Pain Res. 2017; 10:989-98. DOI | PubMed
- Degenhardt L, Lintzeris N, Campbell G, Bruno R, Cohen M, Farrell M. Experience of adjunctive cannabis use for chronic non-cancer pain: findings from the Pain and Opioids IN Treatment (POINT) study. Drug Alcohol Depend. 2015; 147:144-50. DOI | PubMed
- Vigil JM, Stith SS, Adams IM, Reeve AP. Associations between medical cannabis and prescription opioid use in chronic pain patients: a preliminary cohort study. PLoS ONE. 2017; 12(11):e0187795. DOI | PubMed
- Campbell G, Hall WD, Peacock A, Lintzeris N, Bruno R, Larance B. Effect of cannabis use in people with chronic non-cancer pain prescribed opioids: findings from a 4-year prospective cohort study. Lancet Public Health. 2018; 3(7):e341-50. DOI | PubMed
- .Publisher Full Text
- .Publisher Full Text
- Lake SL. Cannabis use and opioid-related health outcomes among people who use drugs. Canadian Institutes of Health Research: Ottawa; 2017. Publisher Full Text
- Woo A, Lechner B, Fu T, Wong CS, Chiu N, Lam H. Cut points for mild, moderate, and severe pain among cancer and non-cancer patients: a literature review. Ann Palliat Med. 2015; 4(4):176-83. DOI | PubMed
- Olfson M, Wall MM, Liu SM, Blanco C. Cannabis use and risk of prescription opioid use disorder in the United States. Am J Psychiatry. 2018; 175(1):47-53. DOI | PubMed
- Sohler NL, Starrels JL, Khalid L, Bachhuber MA, Arnsten JH, Nahvi S. Cannabis use is associated with lower odds of prescription opioid analgesic use among HIV-infected individuals with chronic pain. Subst Use Misuse. 2018; 53(10):1602-7. DOI | PubMed
- Bigand T, Wilson M, Riedy S, Lewis J. Cannabis use is related to self-efficacy but not sleep or pain symptoms: a survey of adults prescribed opioids for pain or opioid use disorders. J Pain. 2018; 19(3 Suppl 1):S28.
- Kral AH, Wenger L, Novak SP, Chu D, Corsi KF, Coffa D. Is cannabis use associated with less opioid use among people who inject drugs?. Drug Alcohol Depend. 2015; 153:236-41. DOI | PubMed
- Smith MT, Haythornthwaite JA. How do sleep disturbance and chronic pain inter-relate? Insights from the longitudinal and cognitive-behavioral clinical trials literature. Sleep Med Rev. 2004; 8(2):119-32. DOI | PubMed
- Hah JM, Sturgeon JA, Zocca J, Sharifzadeh Y, Mackey SC. Factors associated with prescription opioid misuse in a cross-sectional cohort of patients with chronic non-cancer pain. J Pain Res. 2017; 10:979-87. DOI | PubMed
- Kundermann B, Krieg J-C, Schreiber W, Lautenbacher S. The effects of sleep deprivation on pain. Pain Res Manage. 2004; 9(1):25-32. DOI | PubMed
- Burke NN, Finn DP, McGuire BE, Roche M. Psychological stress in early life as a predisposing factor for the development of chronic pain: clinical and preclinical evidence and neurobiological mechanisms. J Neurosci Res. 2017; 95(6):1257-70. DOI | PubMed
- Woodhams SG, Sagar DR, Burston JJ, Chapman V. The role of the endocannabinoid system in pain. Handb Exp Pharmacol. 2015; 227:119-43. DOI | PubMed
- Welch SP. Interaction of the cannabinoid and opioid systems in the modulation of nociception. Int Rev Psychiatry. 2009; 21(2):143-51. DOI | PubMed
- Smith PB, Welch SP, Martin BR. Interactions between delta 9-tetrahydrocannabinol and kappa opioids in mice. J Pharmacol Exp Ther. 1994; 268(3):1381-7. PubMed
- Mason DJ, Lowe J, Welch SP. Cannabinoid modulation of dynorphin A: correlation to cannabinoid-induced antinociception. Eur J Pharmacol. 1999; 378(3):237-48. DOI | PubMed
- Cooper ZD, Bedi G, Ramesh D, Balter R, Comer SD, Haney M. Impact of co-administration of oxycodone and smoked cannabis on analgesia and abuse liability. Neuropsychopharmacology. 2018; 43(10):2046-55. DOI | PubMed
- Hurd YL, Spriggs S, Alishayev J, Winkel G, Gurgov K, Kudrich C. Cannabidiol for the reduction of cue-induced craving and anxiety in drug-abstinent individuals with heroin use disorder: a double-blind randomized placebo-controlled trial. Am J Psychiatry. 2019. DOI | PubMed
- Hurd Y.. Cannabidiol: swinging the marijuana pendulum from ‘weed’ to medication to treat the opioid epidemic. Trends Neurosci. 2017; 40(3):124-7. DOI | PubMed
- Wenger LD, Lopez AM, Comfort M, Kral AH. The phenomenon of low-frequency heroin injection among street-based urban poor: drug user strategies and contexts of use. Int J Drug Policy. 2014; 25(3):471-9. DOI | PubMed
- Darke S.. Self-report among injecting drug users: a review. Drug Alcohol Depend. 1998; 51(3):253-63. DOI | PubMed
- Philpot LM, Ebbert JO, Hurt RT. A survey of the attitudes, beliefs and knowledge about medical cannabis among primary care providers. BMC Fam Pract. 2019; 20(1):17. DOI | PubMed
Fonte
Lake S, Walsh Z, Kerr T, Cooper ZD, Buxton J, et al. (2019) Frequency of cannabis and illicit opioid use among people who use drugs and report chronic pain: A longitudinal analysis. PLoS Medicine 16(11): e1002967. https://doi.org/10.1371/journal.pmed.1002967





