Abstract
Introduzione
Nel 2014, il virus Zika è stato introdotto in Brasile e ad Haiti, da dove si è diffuso rapidamente in tutte le Americhe. Nel gennaio 2017, oltre 100.000 casi sono stati confermati in 24 diversi Stati del Brasile(http://ais.paho.org/phip/viz/ed_zika_cases.asp), con un gran numero di segnalazioni da molte altre contee del Sud e del Centro America(Faria et al., 2016). Originariamente isolato in Uganda nel 1947, il virus è rimasto poco conosciuto fino a quando non ha iniziato a diffondersi nel Pacifico meridionale, compreso un focolaio che ha colpito il 75% degli abitanti dell’isola di Yap nel 2007 (49 casi confermati) e oltre 32.000 casi nel resto dell’Oceania nel 2013-2014, il più grande focolaio prima delle Americhe (2016-presente) (Cao-Lormeauet al., 2016; Duffy et al., 2009). La sindrome di Guillian-Barré, una patologia neurologica associata all’infezione da virus Zika, è stata riconosciuta per la prima volta in questo periodo (Cao-Lormeauet al., 2016). Analogamente, è stato riscontrato un aumento della microcefalia neonatale correlato all’aumento dei casi di Zika in Brasile nel 2015 e nel 2016(Schuler-Faccini et al., 2016). Per questo motivo, nel febbraio 2016, l’Organizzazione Mondiale della Sanità ha dichiarato l’epidemia del virus Zika americano un’emergenza sanitaria pubblica di interesse internazionale.
Nonostante la sua importanza per la salute pubblica, l’ecologia della trasmissione del virus Zika è stata poco compresa fino a poco tempo fa. Si presume che Aedes aegypti e Ae. albopictus siano i principali vettori dovuti all’associazione epidemiologica con il virus Zika(Messina et al., 2016), l’isolamento virale e gli esperimenti di trasmissione con popolazioni di campo (specialmente in Ae. aegypti[Haddow et al., 2012; Boorman e Porterfield, 1956; Haddow et al., 1964]), e l’associazione con i relativi arbovirus (ad es. virus della febbre dengue, virus della febbre gialla). Le previsioni sulla potenziale estensione geografica del virus Zika negli Stati Uniti, e le stime associate per la dimensione della popolazione vulnerabile, si basano quindi principalmente sulle distribuzioni di Ae. aegypti e Ae. albopictus, che si estendono congiuntamente attraverso il sud-ovest, la costa del Golfo e le regioni medio-atlantiche degli Stati Uniti(Centers for Disease Control and Prevention, 2016). Abbiamo ragionato, tuttavia, che se nelle Americhe esistono altre zanzare attualmente non identificate come Zika-competenti, allora queste proiezioni potrebbero essere troppo limitate e quindi ottimisticamente di parte. Inoltre, recenti studi sperimentali mostrano che la capacità di Ae. aegypti e Ae. albopictus di trasmettere il virus varia significativamente tra le popolazioni di zanzare e le regioni geografiche(Chouin-Carneiro et al., 2016), con alcune popolazioni che mostrano bassi tassi di diffusione anche se il titolo virale iniziale dopo l’inoculazione può essere elevato(Diagne et al., 2015). Ciò suggerisce che in alcune località altre specie possono essere coinvolte nella trasmissione. L’epidemia su Yap, ad esempio, è stata causata da una specie diversa, Ae. hensilli(Ledermann et al., 2014). I virus strettamente correlati della famiglia dei Flaviviridae sono vettori di oltre nove specie di zanzare, in media (vedi dati supplementari). Pertanto, poiché il virus Zika può essere associato a più specie di zanzare, abbiamo ritenuto necessario sviluppare un elenco più completo dei potenziali vettori Zika.
Il gold standard per identificare i vettori competenti della malattia richiede l’isolamento del virus dalle zanzare raccolte sul campo, seguito dall’inoculazione sperimentale e dall’indagine di laboratorio sulla diffusione virale nell’organismo e nelle ghiandole salivari(Barnett, 1960; Hardy et al., 1983) e, quando possibile, la trasmissione di ritorno all’ospite vertebrato (ad esempio Komar et al., 2003). Purtroppo questi metodi sono costosi, spesso sottovalutano il rischio di trasmissione(Bustamante e Lord, 2010) e il tempo necessario per le analisi può ritardare il processo decisionale durante un’epidemia(Day, 2001). Per affrontare il problema dell’identificazione dei potenziali candidati vettoriali in un arco di tempo realizzabile, abbiamo quindi perseguito un approccio basato sui dati per identificare i vettori candidati, aiutato da algoritmi di machine learning per l’identificazione di modelli in dati ad alta dimensione. Se la propensione delle specie di zanzare ad associarsi al virus Zika è statisticamente associata ai tratti comuni delle zanzare, è possibile classificare le specie di zanzare in base al grado di rischio rappresentato dai loro tratti – un approccio comparativo simile all’analisi dei fattori di rischio in epidemiologia. Per esempio, si potrebbe costruire un modello per stimare la discrepanza statistica tra i tratti dei vettori noti (ad esempio, Ae. aegypti, Ae. albopictus e Ae. hensilli) e i tratti di tutti i possibili vettori. Sfortunatamente, questo approccio semplicistico fallirebbe inevitabilmente a causa della piccola quantità di dati disponibili (cioè, la dimensione del campione di 3). Così, abbiamo sviluppato un approccio indiretto che sfrutta le informazioni contenute nelle associazioni tra molte coppie virus-zanzare per informarci su associazioni specifiche. In particolare, il nostro metodo identifica i covariati associati alla propensione delle specie di zanzare a veicolare qualsiasi flavivirus. Da questo, abbiamo costruito un modello della rete di zanzare-flavivirus e poi abbiamo estratto da questo modello il profilo della storia della vita e l’elenco delle specie di zanzare che si prevede di associare al virus Zika, che consigliamo di testare sperimentalmente per la competenza del virus Zika.
Risultati
In totale, abbiamo identificato 132 coppie vettore-virus, composte da 77 specie di zanzare e 37 flavivirus. La maggior parte di queste specie erano specie Aedes (32) o Culex (24). Il nostro set di dati supplementari consisteva di altre 103 specie di zanzare sospettate di trasmettere i flavivirus, ma per le quali non esiste l’evidenza di un ciclo completo di trasmissione. Ciò ha portato a 180 potenziali coppie di zanzare-Zika su cui prevedere con il nostro modello addestrato. Come previsto, virus strettamente correlati, come i quattro ceppi di dengue, condividono molti degli stessi vettori e sono stati raggruppati nel nostro diagramma di rete(Figura 1). La distribuzione dei vettori ai virus è stata disomogenea, con alcuni virus vettori vettori di molte specie di zanzare e virus più rari vettori di una o due sole specie. Il virus con i vettori competenti più noti è stato il virus del Nilo occidentale (31 vettori di zanzare), seguito dal virus della febbre gialla (24 vettori di zanzare). In generale, i virus encefalici come il virus del Nilo occidentale sono stati trovati più comunemente vettori di zanzare Culex e i virus emorragici sono stati trovati più comunemente vettori di zanzare Aedes (vedi Gould e Solomon (2008) per ulteriori distinzioni all’interno di Flaviviridae)(Figura 1).10.7554/eLife.22053.003Figure 1.A diagramma di rete di vettori di zanzare (cerchi) e le loro coppie di flavivirus (rettangoli).le zanzare di Culex (azzurro) e soprattutto i virus encefalici (blu) sono più raggruppati rispetto ai virus Aedes (arancione) e ai virus emorragici (rosso). In particolare, il virus del Nilo occidentale è vettoriato sia dalla specie Aedes che da quella Culex. I vettori previsti di Zika sono mostrati da link in grassetto in nero. L’inserto mostra i vettori previsti di Zika e i nomi delle specie, ordinati in base ai punteggi di propensione del modello. I flavivirus inclusi sono il virus Banzi (BANV), il virus Bouboui (BOUV), i ceppi 1, 2, 3 e 4 del virus dengue (DENV-1,2,3,4), il virus Edge Hill (EHV), il virus Ilheus (ILHV), il virus della meningoencefalomielite del tacchino israeliano (ITV), Il virus dell’encefalite giapponese (JEV), il virus Kedougou (KEDV), il virus Kokobera (KOKV), il virus Kunjin (KUNV), il virus dell’encefalite della Valle di Murray (MVEV), il virus Rocio (ROCV), il virus di St. Louis encephalitis virus (SLEV), Spondwendi virus (SPOV), Stratford virus (STRV), Uganda S virus (UGSV), Wesselsbron virus (WESSV), West Nile Virus (WNV), virus della febbre gialla (YFV) e Zika virus (ZIKV).DOI:http://dx.doi.org/10.7554/eLife.22053.003
Il nostro insieme di modelli BRT addestrati sui comuni tratti vettoriali e virus ha previsto coppie di zanzare vettoriali e virus nel set di dati del test con elevata precisione (AUC = 0,92 ± 0,02; sensibilità = 0, 858 ± 0,04; specificità = 0,872 ± 0,04). A causa della non monotonicità e dell’esistenza di interazioni tra variabili predittrici all’interno del nostro modello, non si possono fare affermazioni generali sulla direzionalità dell’effetto. Pertanto, ci concentriamo sull’importanza relativa delle diverse variabili per la performance del modello. La variabile più importante per prevedere con precisione la presenza della coppia vettore-virus è stata il sottogenere delle specie di zanzare, seguito dall’intervallo continentale (ad esempio, i continenti in cui sono presenti le specie). Il numero di virus vettori di una specie di zanzara e il numero di vettori di zanzare di un virus sono stati rispettivamente la terza e la quinta variabile più importante. Non sorprende che questo suggerisca che, quando si controllano altre variabili, le zanzare e i virus con coppie vettori-virus più conosciute (cioè, più virus vettori vettori e più ospiti infetti, rispettivamente), hanno maggiori probabilità di far parte di una coppia prevista dal modello. I tratti ecologici delle zanzare, come l’habitat larvale e la tolleranza alla salinità, erano generalmente meno importanti della filogenesi o dell’intervallo geografico di una specie (Figura 2).10.7554/eLife.22053.004Figure 2.Variable importance by permutation, mediata su 25 modelli.Poiché alcune variabili categoriali sono state trattate come binarie dal nostro modello (cioè l’intervallo continentale), l’importanza relativa di ogni variabile binaria è stata sommata per ottenere l’importanza complessiva della variabile categoriale. I tratti delle zanzare e dei virus sono mostrati rispettivamente in blu e marrone. Le barre di errore rappresentano l’errore standard di 25 modelli.DOI:http://dx.doi.org/10.7554/eLife.22053.004
Applicato alle 180 coppie potenziali di zanzare-Zika, il modello prevedeva trentacinque vettori da classificare al di sopra della soglia (fissata al valore del vettore noto più basso), per un totale di nove vettori noti e ventisei nuovi vettori di zanzare previste di Zika(Tabella 1). Di questi vettori, c’erano ventiquattro specie di Aedes, nove specie di Culex, una specie di Psorophora e una specie di Runchomyia. I primi due vettori classificati del modello GBM per Zika sono i vettori più sospetti del virus di Zika, Ae. aegypti e Ae. albopictus.
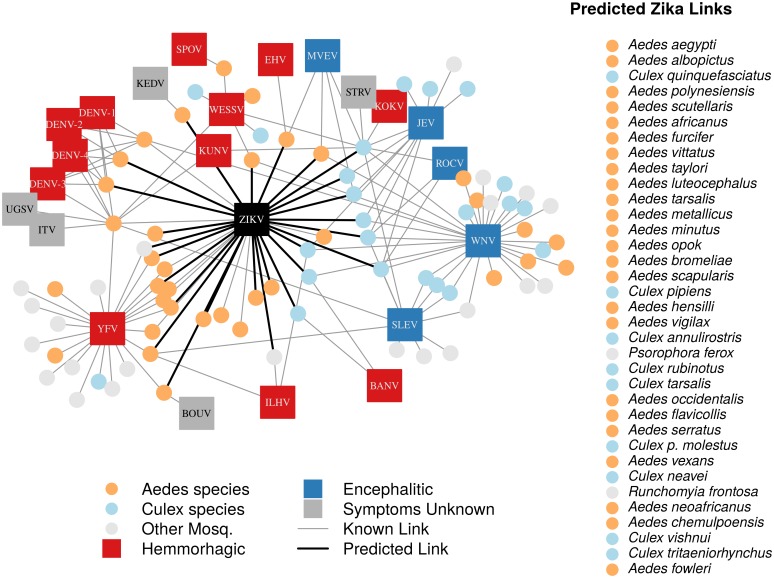
Figura 1.Un diagramma di rete di vettori di zanzare (cerchi) e le loro coppie di flavivirus (rettangoli).Le zanzare di Culex (azzurro) e soprattutto i virus encefalici (blu) sono più raggruppati dei virus Aedes (arancione) e dei virus emorragici (rosso). In particolare, il virus del Nilo occidentale è vettoriato sia dalla specie Aedes che da quella Culex. I vettori previsti di Zika sono mostrati da link in grassetto in nero. L’inserto mostra i vettori previsti di Zika e i nomi delle specie, ordinati in base ai punteggi di propensione del modello. I flavivirus inclusi sono il virus Banzi (BANV), il virus Bouboui (BOUV), i ceppi 1, 2, 3 e 4 del virus dengue (DENV-1,2,3,4), il virus Edge Hill (EHV), il virus Ilheus (ILHV), il virus della meningoencefalomielite del tacchino israeliano (ITV), Il virus dell’encefalite giapponese (JEV), il virus Kedougou (KEDV), il virus Kokobera (KOKV), il virus Kunjin (KUNV), il virus dell’encefalite della Valle di Murray (MVEV), il virus Rocio (ROCV), il virus di St. Louis encephalitis virus (SLEV), Spondwendi virus (SPOV), Stratford virus (STRV), Uganda S virus (UGSV), Wesselsbron virus (WESSV), West Nile Virus (WNV), virus della febbre gialla (YFV) e Zika virus (ZIKV).DOI:
http://dx.doi.org/10.7554/eLife.22053.003
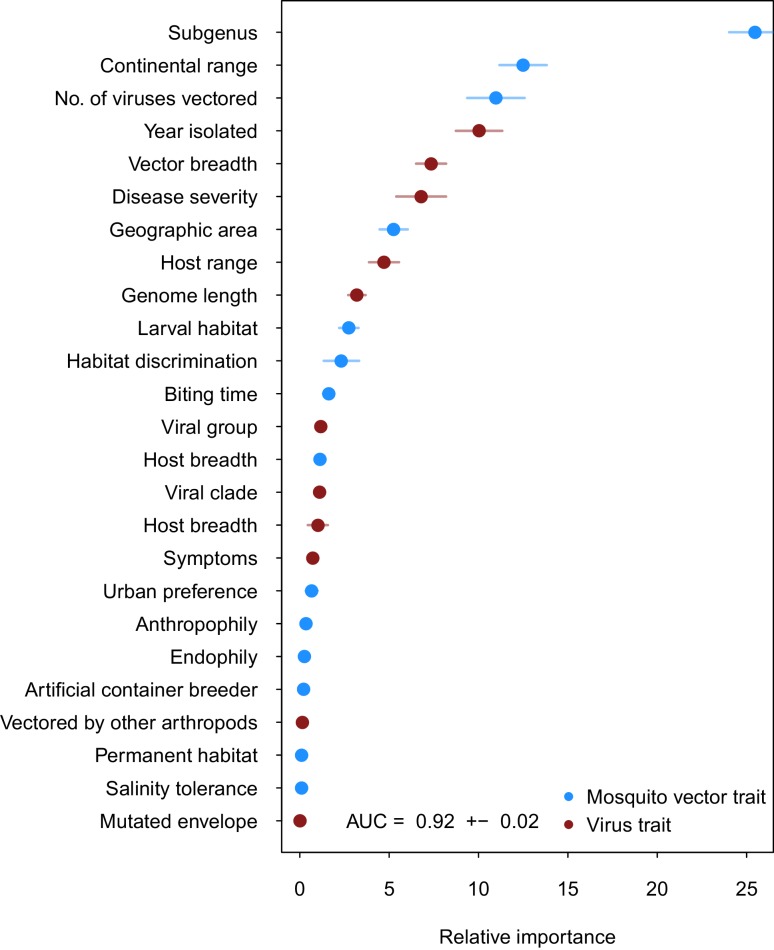
Figura 2.Importanza variabile per permutazione, in media su 25 modelli.Poiché alcune variabili categoriali sono state trattate come binarie dal nostro modello (cioè l’intervallo continentale), l’importanza relativa di ogni variabile binaria è stata sommata per ottenere l’importanza complessiva della variabile categoriale. I tratti delle zanzare e dei virus sono mostrati rispettivamente in blu e marrone. Le barre di errore rappresentano l’errore standard di 25 modelli.DOI:
http://dx.doi.org/10.7554/eLife.22053.004
Convalida del modello
I nostri modelli supplementari e primari sono generalmente concordi e la loro classificazione dei potenziali vettori del virus Zika è altamente correlata (ρ = 0,508 e ρ = 0,693 sulle previsioni grezze e soglia, rispettivamente). Come ci si potrebbe aspettare, il modello supplementare ha assegnato meno punteggi di bassa propensione(Appendice 1-figure 2), suggerendo che l’incorporazione di questa incertezza aggiuntiva nel set di dati di formazione ha eroso la capacità del modello di distinguere i collegamenti negativi. La performance del modello supplementare sui dati di prova (AUC = 0,84 ± 0,02), tuttavia, indica che l’incertezza aggiuntiva non ha impedito la performance del modello.
Quando sono stati addestrati su set di dati “leave-one-out”, tutti e tre i modelli sono stati in grado di prevedere i dati dei test con elevata accuratezza (AUC = 0,91, AUC = 0,91, AUC = 0,92 per i virus del Nilo occidentale, dengue e febbre gialla, rispettivamente). Le prestazioni sono variate quando i modelli sono stati convalidati a fronte di previsioni di “risultati noti”. Un modello addestrato senza virus del Nilo occidentale prevedeva vettori altamente collegati ragionevolmente bene (AUC = 0,69), tuttavia ha assegnato punteggi bassi a vettori più rari ‘noti’, come Culiseta inornata, che è stato associato solo con il virus del Nilo occidentale. Allo stesso modo, il modello addestrato sul dataset di dengue-omitted dati di formazione previsto dati e vettori di dengue stesso con alta precisione (AUC = 0,92). Mentre il modello addestrato senza febbre gialla si è comportato bene sui dati dei test, si è comportato male quando ha previsto i vettori del virus della febbre gialla (AUC = 0,47). A differenza dei virus del Nilo occidentale e della dengue, la maggior parte dei vettori noti della febbre gialla sono associati solo alla febbre gialla (cioè un singolo collegamento vettore-virus), e quindi sono stati completamente esclusi dai dati di formazione quando tutti i collegamenti della febbre gialla sono stati omessi. Inoltre, diverse specie di vettori sono del genere Haemagogus, che era completamente assente dai dati di formazione. Data l’importanza della filogenesi delle specie vettoriali nella previsione dei collegamenti tra vettore e virus, ne consegue che un set di dati con un nuovo sottogenere sarebbe difficile da prevedere per il modello, con conseguente bassa performance del modello. Le scarse prestazioni di questo modello dimostrano che l’incorporazione di tratti comuni e di ulteriori collegamenti tra vettori e virus migliora la previsione del modello. Quando i tratti non erano disponibili nel set di dati di formazione, le prestazioni del modello erano molto più basse, suggerendo che esiste un’associazione statistica tra i tratti di un vettore e la sua capacità di trasmettere un virus.
Discussione
Il virus Zika non ha precedenti tra gli arbovirus emergenti nella sua combinazione di grave pericolo per la salute pubblica, rapida diffusione e scarsa conoscenza scientifica. Particolarmente cruciale per la preparazione alla salute pubblica è la conoscenza dell’estensione geografica delle popolazioni potenzialmente a rischio e delle condizioni ambientali locali per la trasmissione, che sono determinate dalla presenza di vettori competenti. Finora, l’identificazione di ulteriori specie di vettori competenti è stata una priorità bassa perché il virus Zika è stato storicamente limitato geograficamente a una ristretta regione dell’Africa equatoriale e dell’Asia(Petersen et al., 2016), e i lievi sintomi dell’infezione hanno reso il suo raggio d’azione relativamente irrilevante a partire dagli anni ’50. Tuttavia, con la sua espansione relativamente recente e rapida nelle Americhe e la sua associazione con gravi disturbi neurologici, la previsione di potenziali vettori di malattia in aree non endemiche è diventata una questione di importanza critica per la salute pubblica. Identifichiamo queste potenziali specie vettoriali sviluppando un modello basato su dati che identifica le specie vettoriali candidate del virus Zika facendo leva sui dati relativi ai tratti dei vettori delle zanzare e dei loro flavivirus. Suggeriamo che il lavoro empirico dovrebbe dare priorità a queste specie nella loro valutazione della competenza vettoriale delle zanzare per il virus Zika.
Il nostro modello prevede che meno di un terzo dei potenziali vettori di zanzare del virus Zika sono stati identificati, con oltre venticinque specie di zanzare aggiuntive in tutto il mondo che potrebbero avere la capacità di contribuire alla trasmissione. La continua attenzione nella letteratura pubblicata su due specie note per la trasmissione del virus Zika(Ae. aegypti e Ae. albopictus) ignora il ruolo potenziale di altri vettori, travisando potenzialmente l’estensione spaziale del rischio. In particolare, quattro specie previste dal nostro modello come vettori competenti – Ae. vexans, Culex quinquefasciatus, Cx. pipiens e Cx. tarsalis – si trovano in tutti gli Stati Uniti continentali. Inoltre, le tre specie di Culex sono vettori primari del virus del Nilo occidentale(Farajollahi et al., 2011). Cx. quinquefasciatus e Cx. pipiens sono stati classificati al 3° e al 17° posto rispettivamente dal nostro modello, e insieme queste specie sono state le specie endemiche di più alto rango negli Stati Uniti dopo i vettori conosciuti(Ae. aegypti e Ae. albopictus). Cx. quinquefasciatus è stato precedentemente implicato come un importante vettore di flavivirus encefalico, in particolare il virus del Nilo occidentale e l’encefalite di St. Louis(Turell et al., 2005; Hayes et al., 2005), e un’ibridazione della specie con Cx. pipiens morde facilmente gli esseri umani(Fonseca et al., 2004). I dati empirici disponibili sulla competenza vettoriale di Cx. pipiens e Cx. quinquefasciatus sono attualmente misti, con alcuni studi che trovano prove di trasmissione del virus e altri no(Guo et al., 2016; Aliota et al., 2016; Fernandes et al., 2016; Huang et al., 2016). Questi risultati suggeriscono, in combinazione con le prove di effetti genotipi x genotipi significativi sulla competenza vettoriale di Ae. aegypti e Ae. albopictus a trasmettere Zika(Chouin-Carneiro et al., 2016), che la competenza vettoriale di Cx. pipiens e Cx. quinquefasciatus per il virus Zika potrebbe essere altamente dipendente dal background genetico dell’accoppiamento zanzara-virus, così come dalle condizioni ambientali locali. Così, considerando la loro natura antropofila e la loro vasta gamma geografica, Cx. quinquefasciatus e Cx. pip iens potrebbero potenzialmente giocare un ruolo maggiore nella trasmissione del virus Zika negli Stati Uniti continentali. Ulteriori ricerche sperimentali sulla competenza delle popolazioni di Cx. pipiens a trasmettere il virus Zika in un’area geografica più ampia sono quindi altamente raccomandate e dovrebbero essere considerate prioritarie.
I vettori previsti dal nostro modello hanno un intervallo geografico combinato molto più ampio di quello dei vettori attualmente sospettati di Zika(Figura 3), suggerendo che, se queste specie dovessero essere confermate come vettori, una popolazione più grande potrebbe essere a rischio di infezione da Zika rispetto a quella rappresentata dalle mappe che si concentrano esclusivamente su Ae. aegypti e Ae. albopictus. L’intervallo di Cx. pipiens comprende il Pacifico nord-occidentale e l’alto centro-occidentale, aree che non rientrano nell’intervallo noto di Ae. aegypti o Ae. albopictus(Darsie e Ward, 2005). Inoltre, Ae. vexans, un altro previsto vettore del virus Zika, si trova in tutti gli Stati Uniti continentali e la gamma di Cx. tarsalis si estende lungo tutta la costa occidentale(Darsie and Ward, 2005). Su scala più fine, queste specie utilizzano un insieme di habitat più diversificato, con Ae. aegypti e Cx. quinquefasciatus che si riproducono principalmente in contenitori artificiali, e Ae. vexans e Ae. albopictus che sono relativamente indiscriminati nei loro siti di riproduzione, compresa la riproduzione in siti naturali come buche di alberi e paludi. Pertanto, oltre alla più ampia regione geografica che supporta i potenziali vettori, questi risultati suggeriscono che sia le aree rurali che quelle urbane potrebbero servire come habitat per i potenziali vettori di Zika. Raccomandiamo test sperimentali di queste specie per la competenza a trasmettere il virus Zika, perché una conferma di questi vettori richiederebbe l’espansione degli sforzi di salute pubblica in queste aree attualmente non considerate a rischio.10.7554/eLife.22053.005Figure 3.Distribution maps of predicted vectors of Zika virus in the continental US.Maps of Aedes species are based on Centers for disease control and prevention (2016). Le distribuzioni di tutte le altre specie sono mappe georeferenziate di Darsie e Ward (2005).DOI:http://dx.doi.org/10.7554/eLife.22053.005
Mentre la trasmissione richiede un vettore competente, la competenza vettoriale non equivale necessariamente al rischio di trasmissione o informa la capacità vettoriale. Ci sono molti fattori biologici che, insieme alla competenza vettoriale positiva, determinano il ruolo di un vettore nella trasmissione della malattia. Per esempio, anche se le zanzare Ae. aegypti sono vettori efficienti del virus del Nilo occidentale, preferiscono nutrirsi di esseri umani, che sono ospiti a testa morta per la malattia, e quindi hanno un basso potenziale di servire come vettore(Turell et al., 2005). Psorophora ferox, sebbene previsto dal nostro modello come potenziale vettore del virus Zika, avrebbe probabilmente un ruolo limitato nella trasmissione perché raramente si nutre di esseri umani(Molaei et al., 2008). Inoltre, la competenza del vettore è dinamica e può essere mediata da fattori ambientali che influenzano lo sviluppo virale e l’immunità delle zanzare(Muturi e Alto, 2011). Pertanto, la nostra lista di potenziali vettori di Zika rappresenta un punto di partenza completo, che dovrebbe essere ulteriormente ristretto dal lavoro empirico e dalla considerazione dei dettagli biologici che incidono sulle dinamiche di trasmissione. Dati i gravi effetti collaterali neurologici dell’infezione da virus Zika, iniziare con il metodo più conservativo di previsione vettoriale assicura che il rischio non sia sottovalutato e permette alle agenzie di salute pubblica di interpretare la possibilità di trasmissione di Zika date le condizioni locali.
Il nostro modello serve come punto di partenza per razionalizzare gli sforzi empirici per identificare le aree e le popolazioni a rischio di trasmissione del virus Zika. Mentre il nostro modello consente previsioni guidate dai dati sull’area geografica a potenziale rischio di trasmissione di Zika, per la validazione del modello è necessario un successivo lavoro empirico che indaghi la competenza del vettore Zika e l’efficienza della trasmissione è necessario per la validazione del modello e per informare le future analisi delle dinamiche di trasmissione. Ad esempio, nonostante la sua bassa efficienza di trasmissione in alcune regioni geografiche(Chouin-Carneiro et al., 2016), Ae. aegypti è antropofilo(Powell e Tabachnick, 2013), e può quindi rappresentare un rischio maggiore di trasmissione del virus Zika da uomo a uomo rispetto alle zanzare che mordono una più ampia varietà di animali. D’altra parte, le specie di zanzare che preferiscono alcuni ospiti in ambienti rurali sono note per alterare i loro comportamenti alimentari per mordere ospiti alternativi (ad esempio, umani e roditori) in ambienti urbani, a causa dei cambiamenti nella composizione della comunità ospitante(Chaves et al., 2010). Fattori ambientali come le precipitazioni e la temperatura influenzano direttamente le popolazioni di zanzare e determinano la densità dei vettori in una data area(Thomson et al., 2006), un importante fattore di rischio di trasmissione. Inoltre, fattori socio-economici come il tipo di abitazione e lo stile di vita possono diminuire il contatto delle popolazioni con i vettori delle zanzare e ridurre il rischio di trasmissione all’uomo (Moreno-Madriñáne Turell, 2017). Un’efficace modellazione del rischio e la previsione dell’espansione del raggio d’azione del virus Zika negli Stati Uniti dipenderà dalla convalida dello stato vettoriale di queste specie, così come dalla risoluzione dei dettagli comportamentali e biologici che incidono sulle dinamiche di trasmissione.
Sebbene abbiamo sviluppato questo modello tenendo presente il virus Zika, le nostre scoperte hanno implicazioni per altri flavivirus emergenti e contribuiscono alla metodologia recentemente sviluppata applicando metodi di apprendimento automatico alla previsione di agenti sconosciuti di malattie infettive. Questa tecnica è stata utilizzata per prevedere i serbatoi di roditori di malattia(Han et al., 2015) e i portatori di pipistrelli dei filovirus(Han et al., 2016) attraverso l’addestramento di modelli con dati specifici per l’ospite. Il nostro modello, tuttavia, incorpora dati aggiuntivi costruendo una rete di vettori-virus che viene utilizzata per informare le previsioni delle associazioni di vettori-virus. La combinazione di tratti comuni del virus con tratti specifici del vettore ci ha permesso di prevedere i potenziali vettori di zanzare di flavivirus specifici e di addestrare il modello su informazioni aggiuntive distribuite in tutta la rete di flavivirus-zanzare.
L’incertezza nel nostro modello nasce dall’incertezza insita nei nostri set di dati. Lo stato dei vettori non è statico (ad esempio, la mutazione del virus chikungunya per aumentare la trasmissione da parte di Ae. albopictus[Weaver e Forrester, 2015]) e può variare tra le popolazioni di vettori(Bennett et al., 2002). Quando abbiamo incorporato l’incertezza nello status di vettore attraverso il nostro modello supplementare, le nostre previsioni sono generalmente concordate con quelle del nostro modello originale. Tuttavia, l’aumento dell’incertezza ha ridotto la capacità dei modelli di distinguere i collegamenti negativi, con conseguente maggiore incertezza nei punteggi di propensione (misurati in base alla deviazione standard) e un numero maggiore di vettori previsti. Inoltre, il modello funziona male quando si prevedono collegamenti tra vettori e virus con livelli di tratti non inclusi nel set di dati di formazione, come è stato il caso quando si è omesso il virus della febbre gialla. Un’altra fonte di incertezza riguarda i tratti del vettore e del virus. Oltre alla variazione intraspecifica dei tratti biologici, molti vettori sono poco studiati e i tratti comuni, come l’attività di mordere, sono sconosciuti al livello delle specie. Un ulteriore studio del comportamento e della biologia delle specie vettoriali meno comuni aumenterebbe l’accuratezza di tecniche di previsione come questa, e permetterebbe una migliore comprensione del ruolo potenziale delle specie come vettori.
È interessante notare che la nostra rete di flavivirus-zanzare costruita concorda generalmente con la dicotomia proposta di Aedes specie vettoriali emorragiche o febbrili arbovirus e Culex specie vettoriali di virus neurologici o encefalici(Grard et al., 2010)(Figura 1). Tuttavia, ci sono diverse eccezioni a questa tendenza, in particolare il virus del Nilo occidentale, che è vettoriato da diverse specie di Aedes. Inoltre, il nostro modello prevede che diverse specie di Culex siano possibili vettori del virus Zika. Mentre questo può sembrare inizialmente contrario al comune accoppiamento filogenetico di vettori e virus sopra notato, i sintomi di Zika, come il virus del Nilo occidentale, sono sia febbrili che neurologici. Pertanto, i suoi sintomi non seguono la convenzionale divisione emorragica/encefalica. La capacità del virus Zika di essere vettoriato da una varietà di vettori di zanzare potrebbe avere importanti conseguenze per la salute pubblica, in quanto potrebbe espandere sia la gamma geografica che il rischio di trasmissione stagionale del virus Zika, e merita un’ulteriore indagine empirica.
Considerando le nostre previsioni sulle specie vettoriali potenziali e le loro gamme combinate, le specie della lista dei vettori candidati devono essere convalidate per informare la risposta al virus Zika. Gli sforzi di controllo dei vettori che prendono di mira esclusivamente le specie Aedes potrebbero alla fine non riuscire a controllare la trasmissione di Zika perché non controllano altri vettori sconosciuti. Ad esempio, il rilascio di Ae. aegypti geneticamente modificati per controllare la densità dei vettori attraverso la tecnica dell’insetto sterile è specie-specifico e non controllerebbe vettori alternativi(Alphey et al., 2010). Inoltre, le preferenze di habitat delle specie sono diverse e gli sforzi di controllo basati singolarmente sulla riduzione dell’habitat larvale di Aedes non avranno lo stesso successo nel controllare le popolazioni di Cx. quinquefasciatus (Reyet al., 2006). I vettori previsti del virus Zika devono essere testati empiricamente e, se confermati, gli sforzi di controllo dei vettori dovrebbero rispondere ampliando la loro attenzione per controllare l’abbondanza di tutti i vettori previsti del virus Zika. Allo stesso modo, se gli sforzi di controllo devono includere tutte le aree a potenziale rischio di trasmissione della malattia, gli sforzi di salute pubblica dovrebbero espandersi per affrontare regioni come il Midwest settentrionale che rientrano nella gamma delle specie vettoriali aggiuntive previste dal nostro modello. Una comprensione della capacità delle specie di zanzare di veicolare il virus Zika è necessaria per prepararsi all’insediamento potenziale del virus Zika negli Stati Uniti, e raccomandiamo di iniziare il lavoro sperimentale con questo elenco di specie vettori candidate.
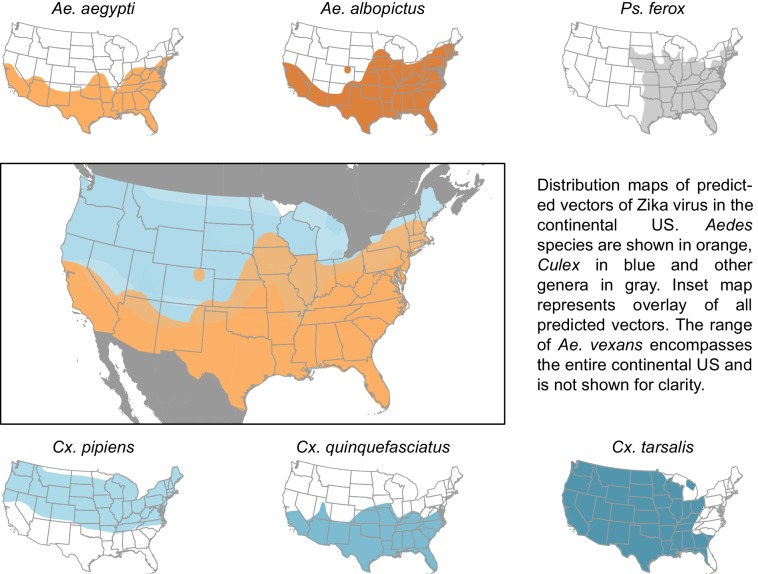
Figura 3.Figura 3. Mappe di distribuzione dei vettori previsti del virus Zika negli Stati Uniti continentali.Le mappe delle specie di Aedes si basano sui Centri per il controllo e la prevenzione delle malattie (2016). Le distribuzioni di tutte le altre specie sono mappe georettificate di Darsie e Ward (2005).DOI:
http://dx.doi.org/10.7554/eLife.22053.005
Materiali e metodi
Raccolta dati e costruzione delle caratteristiche
Il nostro set di dati comprendeva una matrice di coppie di vettori-virus relativi a tutti i flavivirus conosciuti e ai loro vettori di zanzare. Per costruire questa matrice, abbiamo dapprima compilato una lista di flavivirus trasmessi dalle zanzare da includere nel nostro studio(Van Regenmortel et al., 2000; Kuno et al., 1998; Cook e Holmes, 2006). Non sono stati inclusi i virus che infettano solo le zanzare e non sono noti per infettare gli esseri umani. Utilizzando questo elenco, abbiamo costruito una matrice di coppia zanzara-virus basata sul database del Global Infectious Diseases and Epidemiology Network(GIDEON, 2016), il Catalogo Internazionale degli Arbovirus che include alcuni altri virus dei vertebrati (ArboCat)(Karabatsos, 1985), l’Enciclopedia di Entomologia Medica e Veterinaria (Russell et al., 2013) e Mackenzie et al. (2012).
Abbiamo definito una coppia nota di vettori-virus come una coppia per la quale è stato osservato l’intero ciclo di trasmissione (cioè l’infezione della zanzara attraverso un ospite infetto (mammifero o aviario) o la farina di sangue che è in grado di essere trasmessa attraverso la saliva). La competenza vettoriale di base sull’isolamento o sull’iniezione intratoracica bypassa diverse importanti barriere alla trasmissione(Hardy et al., 1983), e può non essere una vera prova della capacità di una zanzara di trasmettere un arbovirus. Abbiamo trovato la nostra definizione più conservativa di quella comunemente usata nelle banche dati sulle malattie (ad esempio, Global Infectious Diseases and Epidemiology Network database), che spesso presuppone l’isolamento dalle zanzare catturate allo stato brado come prova del ruolo di vettore di una zanzara. Pertanto, un’analisi supplementare indaga la solidità dei nostri risultati per quanto riguarda l’incertezza dello status di vettore, confrontando l’analisi riportata nel testo principale con una seconda analisi in cui ogni tipo di prova di associazione, compreso il semplice isolamento del virus nelle zanzare selvatiche, viene presa come base per la connessione nella rete virus-vettore (vedi Appendice 1 per l’analisi e i risultati).
Dalla letteraturasono stati raccolti quindici tratti di zanzare(appendice 2 tabella 1) e dodici tratti di virus (appendice 2 tabella 2). Per le specie di zanzare, l’intervallo geografico è stato definito come il numero di paesi in cui la specie è stata raccolta, sulla base della Walter Reed Biosystematics Unit, (2016). Anche se ci sono incertezze negli intervalli delle specie dovute a false assenze, questo rappresenta il set di dati più completo e standardizzato disponibile che include sia le specie di zanzare rare che quelle comuni. L’estensione continentale di una specie è stata registrata come valore binario della sua presenza per continente. L’intervallo di ospiti di una specie è stato definito come il numero di classi tassonomiche di cui la specie è nota per nutrirsi, con la classe Mammalia ulteriormente suddivisa in primati non umani e altri mammiferi, a causa dell’importante ruolo svolto dai primati nelle ricadute zoonotiche di malattie trasmesse da vettori (ad esempio dengue, chikungunya, febbre gialla e virus Zika) (Weaver, 2005; Diallo et al., 2005; Weaver et al., 2016). Il numero totale di flavivirus unici osservati per specie di zanzara è stato calcolato dalla nostra matrice di zanzara-flavivirus. Tutti gli altri tratti si sono basati sul consenso della letteratura (vedi Appendice III per le fonti per specie). Per tre tratti – preferenza urbana, endofilia (una propensione a mordere in ambienti chiusi) e tolleranza alla salinità – se non è stata trovata in letteratura la prova di questo tratto per una zanzara, si è supposto che fosse negativa.10.7554/eLife.22053.006Table 1.Predicted vectors of Zika virus, come riportato dal nostro modello. Le specie di zanzare endemiche degli Stati Uniti continentali sono audaci. Una specie è definita come un vettore noto del virus Zika se è stato osservato un ciclo completo di trasmissione (vedi testo principale).DOI:http://dx.doi.org/10.7554/eLife.22053.006SpeciesGBMprevisione ± SDVettore noto?Aedes aegypti0,81 ± 0,12SìAe. albopictus0,54 ± 0,14SìCulex quinquefasciatus0,38 ± 0,14NoAe. polynesiensis0,36 ± 0,13NoAe. scutellaris0,33 ± 0,13NoAe.africanus0.32 ± 0,11NoAe. furcifer0,31± 0,16SiAe. vittatus0,30 ± 0,20SiAe. taylori0,30± 0,16SiAe.luteocefalo0,25 ± 0,12SìAe. tarsalis0,18± 0,11SìAe. metallicus0,16 ± 0,08NoAe.minutus0.16 ±0.09NoAe. opok0.14 ± 0.06NoAe. bromeliae0.11 ± 0.06NoAe. scapularis0.10 ± 0.04NoCx. pipiens0,10 ± 0,04NoAe. hensilli0,10± 0,06SiSiAe. vigilax0,10 ± 0,05NoCx. annulirostrix0,08 ± 0,03NoPsorophora ferox0,08 ± 0,05NoCx. rubinotus0,08 ± 0,07NoCx. tarsalis0,08 ± 0,03NoAe. occidentalis0,08 ± 0,05NoAe. flavicolis0,07 ± 0,04NoAe.serratus0,07± 0,04NoAe.serratus0,07 ± 0,04NoCx. p. molestus0,07 ± 0,04NoAe. vexans0,06 ± 0,04NoCx. neavei0,06± 0,02NoRunchomyiafrontosa0,06 ± 0,04NoAe. neoafricanus0,06 ± 0,03NoAe.chemulpoensis0.06 ± 0.03NoCx. vishnui0.05± 0.01NoCx. tritaeniorhynchus0.05 ± 0.01NoAe. fowleri0.04± 0.03Si
Abbiamo raccolto dati sui seguenti tratti del virus: range dell’ospite(Mahy, 2009; Mackenzie et al., 2012; Chambers e Monath, 2003; Cook e Zumla, 2009b), gravità della malattia(Mackenzie et al., 2012), la malattia umana(Chambers e Monath, 2003; Cook e Zumla, 2009), la presenza di una proteina mutata dell’involucro, che controlla l’ingresso del virus nelle cellule (Grardet al., 2010), l’anno di isolamento (Karabatsos,1985), e l’intervallo dell’ospite (Karabatsos,1985). La gravità della malattia si basava su Mackenzie et al. (2012), che andava dall’assenza di sintomi noti (ad esempio, il virus Kunjin) a sintomi gravi e a una significativa mortalità umana (ad esempio, il virus della febbre gialla). Per ogni virus, l’intervallo dei vettori è stato calcolato come numero di specie di zanzare per le quali è stato osservato l’intero ciclo di trasmissione. La lunghezza del genoma è stata calcolata come media di tutte le sequenze complete del genoma elencate per ogni flavivirus nel database e nella risorsa di analisi dei virus(http://www.viprbrc.org/). Per i flavivirus scoperti più di recente e non ancora catalogati nei database di cui sopra (ad esempio, New Mapoon Virus, Iquape virus), i tratti virali sono stati raccolti dalla letteratura primaria (fonti elencate nell’Appendice 3).
Modello predittivo
Dopo Han et al. (2015), gli alberi di regressione potenziati (BRT)(Friedman, 2001) sono stati utilizzati per adattare un modello predittivo simile a quello logistico relativo allo stato di tutte le possibili coppie virus-vettore (0: non associato, 1: associato) a una matrice predittrice che comprende i tratti della zanzara e i tratti del virus in ogni coppia. Gli alberi di regressione potenziati aggirano molti problemi associati all’analisi di regressione tradizionale(Elith et al., 2008), consentendo interazioni variabili complesse, collinearità, relazioni non lineari tra covariate e variabili di risposta, e dati mancanti. Inoltre, questa tecnica funziona bene rispetto ad altri approcci di regressione logistica(Friedman, 2001). I modelli ad albero di regressione potenziati e addestrati dipendono dalla divisione tra i dati di addestramento e quelli di prova, in modo tale che ogni modello può prevedere valori di propensione leggermente diversi. Per far fronte a questo, abbiamo addestrato un insieme di 25 modelli BRT con validazione interna incrociata su partizioni indipendenti dei dati di addestramento e di test. Il modello risultante ha dimostrato una bassa varianza nell’importanza relativa delle variabili e nell’accuratezza complessiva del modello, suggerendo che tutti i modelli convergevano verso un risultato simile.
Prima dell’analisi di ogni modello, abbiamo diviso casualmente i dati in set di training (70%) e test (30%), mantenendo la proporzione di etichette positive (associazioni note) in ogni set di training e test. I modelli sono stati formati utilizzando il pacchetto gbm in R (Ridgeway, 2015), con un numero massimo di alberi impostato a 25.000, un tasso di apprendimento di 0,001 e una profondità di interazione di 5. Per correggere un pregiudizio ottimistico(Smith et al., 2014), abbiamo effettuato una convalida incrociata di 10 volte e abbiamo scelto una frazione di borsa pari al 50% dei dati di formazione per ogni iterazione del modello. Abbiamo stimato le prestazioni di ogni singolo modello con tre metriche: Area sotto la curva dell’operatore ricevente, specificità e sensibilità. Per la specificità e la sensibilità, che richiedono una soglia preimpostata, abbiamo effettuato delle previsioni di soglia sui dati di test in base al valore che ha massimizzato la somma della sensibilità e della specificità, una soglia robusta rispetto al rapporto tra la presenza e i punti di sfondo nei set di dati solo presenza(Liu et al., 2016). L’importanza variabile è stata quantificata mediante permutazione(Breiman, 2001) per valutare il contributo relativo di virus e tratti vettoriali alla propensione di un virus e di un vettore a formare una coppia. Poiché abbiamo trasformato molte variabili categoriali in variabili binarie (ad esempio, intervallo continentale come presenza o assenza binaria per continente), la somma dell’importanza relativa di ogni caratteristica binaria è stata sommata per ottenere un unico valore per l’intera variabile.
Ciascuno dei nostri venticinque modelli addestrati è stato poi utilizzato per prevedere nuovi vettori di zanzare di Zika applicando il modello addestrato a un insieme di dati costituito dai tratti virali di Zika abbinati ai tratti di tutte le zanzare per le quali i flavivirus sono stati isolati da individui catturati in natura e, a seconda della specie, possono o meno essere stati testati in esperimenti a ciclo completo di trasmissione (un totale di 180 specie di zanzare). Questo set di dati allargato ci ha permesso di prevedere un gran numero di specie di zanzare, limitando ragionevolmente il nostro set di dati alle specie sospettate di trasmettere i flavivirus. Il risultato di questo modello è stato un punteggio di propensione che va da 0 a 1. Nel nostro caso, il punteggio di propensione finale per ogni vettore è stato il punteggio di propensione medio assegnato dai venticinque modelli. Per etichettare i bordi non osservati, abbiamo soglie i punteggi di propensione al valore del vettore noto più basso classificato(Liu et al., 2013).
Convalida del modello
Oltre alle metriche di performance convenzionali, abbiamo condotto ulteriori analisi per convalidare ulteriormente sia questo metodo di previsione, sia il nostro modello in particolare. Per tenere conto dell’incertezza dei collegamenti vettori-virus nella nostra matrice iniziale, abbiamo ripetuto la nostra analisi per una matrice vettoriale-virus con una definizione meno conservativa di collegamento positivo (isolamento del campo e oltre), definita come il nostro modello supplementare. La competenza del vettore è un tratto dinamico, ed esiste una significativa variazione intraspecifica della capacità di un vettore di trasmettere un virus per alcune specie di zanzare(Diallo et al., 2005; Gubler et al., 1979). Il nostro modello supplementare si basa su una definizione meno conservativa della competenza del vettore e include specie implicate come vettori, ma non ancora verificate attraverso studi di competenza di laboratorio, e quindi rappresenta un’ulteriore incertezza come la variazione intraspecifica.
Questo approccio è ben collaudato nelle applicazioni epidemiologiche(Parascandola, 2004), ma solo recentemente è stato applicato per prevedere le associazioni ecologiche e, in quanto tale, ha limiti unici a questa applicazione. Per valutare ulteriormente questo metodo di previsione, abbiamo eseguito un’analisi “leave-one-out” modificata, in cui abbiamo addestrato un modello ad un set di dati da cui era stato omesso un virus ben studiato, e poi abbiamo previsto i vettori per questo virus e li abbiamo confrontati con una lista di vettori noti. Abbiamo ripetuto questa analisi per i virus del Nilo occidentale, della dengue e della febbre gialla, seguendo lo stesso metodo di formazione del nostro modello originale. Anche se questa analisi si differenzia dal nostro metodo originale, fornisce una valutazione più rigorosa di questo metodo di previsione perché il modello è addestrato su un set di dati incompleto e prevede su dati non familiari, un compito più difficile di quello posto al nostro modello originale.
References
- Adebote AD, Oniye JS, Ndams S, Nache KM. The breeding of mosquitoes (Diptera: culicidae) in Peridomestic containers and implication in yellow fever transmission in villages around Zaria, northern Nigeria. Journal of Entomology. 2006; 3:180-188. DOI
- Aitken TH, Anderson CR. Virus transmission studies with trinidadian mosquitoes II. further observations. The American Journal of Tropical Medicine and Hygiene. 1959; 8:41-45. PubMed
- Al-Sheik AA. Larval habitat, ecology, seasonal abundance and vectorial role in malaria transmission of anopheles arabiensis in Jazan region of saudi arabia. Journal of the Egyptian Society of Parasitology. 2011; 41:615-634. PubMed
- Aldemir A, Bedir H, Demirci B, Alten B. Biting activity of mosquito species (Diptera: culicidae) in the Turkey-Armenia border area, ararat valley, turkey. Journal of Medical Entomology. 2010; 47:22-27. DOI | PubMed
- Alencar J, Lorosa ES, Dégallier lN, Serra-Freire NM, Pacheco JB, Guimarães AE. Feeding patterns of haemagogus janthinomys (Diptera: culicidae) in different regions of brazil. Journal of Medical Entomology. 2005; 42:981-985. DOI | PubMed
- Alencar J, Marcondes CB, Serra-Freire NM, Lorosa ES, Pacheco JB, Guimarães AE. Feeding patterns of haemagogus capricornii and haemagogus leucocelaenus (Diptera: culicidae) in two brazilian states (Rio de janeiro and goiás). Journal of Medical Entomology. 2008; 45:873-876. DOI | PubMed
- Alfonzo D, Grillet ME, Liria J, Navarro JC, Weaver SC, Barrera R. Ecological characterization of the aquatic habitats of mosquitoes (Diptera: culicidae) in enzootic foci of venezuelan equine encephalitis virus in western Venezuela. Journal of Medical Entomology. 2005; 42:278-284. DOI | PubMed
- Aliota MT, Peinado SA, Osorio JE, Bartholomay LC. Culex pipiens and aedes triseriatus mosquito susceptibility to zika virus. Emerging Infectious Diseases. 2016; 22:1857-1859. DOI | PubMed
- Alphey L, Benedict M, Bellini R, Clark GG, Dame DA, Service MW, Dobson SL. Sterile-insect methods for control of mosquito-borne diseases: an analysis. Vector-Borne and Zoonotic Diseases. 2010; 10:295-311. DOI | PubMed
- Amerasinghe FP, Indrajith NG. Nocturnal biting rhythms of mosquitoes (Diptera Culicidae) in Sri Lanka. Tropical Zoology. 1995; 8:43-53. DOI
- Amerasinghe FP, Munasingha NB. Nocturnal biting rhythms of six mosquito species (Diptera: culicidae) in Kandy, Sri Lanka. Journal of the National Science Council of Sri Lanka. 1994; 22:279-290.
- Ammar SE, Kenawy MA, Abdel-Rahman HA, Gad AM, Hamed AF. Ecology of the mosquito larvae in urban environments of Cairo Governorate, Egypt. Journal of the Egyptian Society of Parasitology. 2012; 42:191-202. DOI | PubMed
- Anderson JF, Main AJ, Ferrandino FJ, Andreadis TG. Nocturnal activity of mosquitoes (Diptera: culicidae) in a west nile virus focus in Connecticut. Journal of Medical Entomology. 2007; 44:1102-1108. DOI | PubMed
- Andreadis TG, Anderson JF, Vossbrinck CR, Main AJ. Epidemiology of west nile virus in Connecticut: a five-year analysis of mosquito data 1999-2003. Vector-Borne and Zoonotic Diseases. 2004; 4:360-378. DOI | PubMed
- Apperson CS, Harrison BA, Unnasch TR, Hassan HK, Irby WS, Savage HM, Aspen SE, Watson DW, Rueda LM, Engber BR, Nasci RS. Host-feeding habits of culex and other mosquitoes (Diptera: culicidae) in the borough of queens in New York City, with characters and techniques for identification of culex mosquitoes. Journal of Medical Entomology. 2002; 39:777-785. DOI | PubMed
- Arnell JH. Mosquito studies (DIPTERA, Culicidae) XXXII. a revision of the genus haemagogus. Contributions of the American Entomological Institute. 1973; 10:1-176.
- Bagirov GA, Gadzhibekova EA, Alirzaev GU. [The attack activity of Uranotaenia Unguiculata Edwards, 1913 mosquitoes on man]. Meditsinskaia Parazitologiia I Parazitarnye Bolezni. 1994; 3:39-40. PubMed
- Barker CM, Bolling BG, Black WC, Moore CG, Eisen L. Mosquitoes and west nile virus along a river corridor from prairie to montane habitats in eastern Colorado. Journal of Vector Ecology. 2009; 34:276-293. DOI | PubMed
- Barnett H. Proceedings of the 11th International Congress of Entomolgoy. 1960.
- Bashar K, Tuno N, Ahmed TU, Howlader AJ. Blood-feeding patterns of anopheles mosquitoes in a malaria-endemic area of Bangladesh. Parasites & Vectors. 2012; 5:39. DOI | PubMed
- Baton LA, Pacidônio EC, Gonçalves DS, Moreira LA. wFlu: characterization and evaluation of a native Wolbachia from the mosquito aedes fluviatilis as a potential vector control agent. PLoS One. 2013; 8DOI | PubMed
- Becker G, Neumann D. Mosquito populations diptera Culicidae of wetlands of an urban area. Zeitschrift Fuer Angewandte Zoologie. 1983; 70:73-90.
- Begum A, Biswas BR, Elias M. The ecology and seasonal fluctuations of mosquito larvae in a lake in Dhaka City bangladesh. Bangladesh Journal of Zoology. 1986; 14:41-48.
- Belton P. The mosquitoes of Burnaby lake British-Columbia Canada. Journal of the Entomological Society of British Columbia. 1979; 75
- Bennett KE, Olson KE, Muñoz ML, Fernandez-Salas I, Farfan-Ale JA, Higgs S, Black WC, Beaty BJ. Variation in vector competence for dengue 2 virus among 24 collections of aedes aegypti from Mexico and the united states. The American Journal of Tropical Medicine and Hygiene. 2002; 67:85-92. PubMed
- Bennett KL, Linton YM, Shija F, Kaddumukasa M, Djouaka R, Misinzo G, Lutwama J, Huang YM, Mitchell LB, Richards M, Tossou E, Walton C. Molecular differentiation of the african yellow fever vector aedes bromeliae (Diptera: culicidae) from its sympatric Non-vector sister species, aedes lilii. PLOS Neglected Tropical Diseases. 2015; 9DOI | PubMed
- Beran GW. Handbook of Zoonoses. CRC Press; 1994.
- Bhattacharyya DR, Handique R, Dutta LP, Dutta P, Doloi P, Goswami BK, Sharma CK, Mahanta J. Host feeding patterns of culex vishnui sub group of mosquitoes in dibrugarh district of assam. The Journal of Communicable Diseases. 1994; 26:133-138. PubMed
- Bohart RM, Ingram RL. Mosquitoes of Okinawa and Islands in the Central Pacific. US Dept of the Navy, Bureau of Medicine and Surgery; 1946.
- Boorman JP, Porterfield JS. A simple technique for infection of mosquitoes with viruses; transmission of zika virus. Transactions of the Royal Society of Tropical Medicine and Hygiene. 1956; 50:238-242. DOI | PubMed
- Boorman JPT. Observations on the habits of mosquitos of plateau province, northern Nigeria, with particular reference to aëdes (Stegomyia) vittatus (Bigot). Bulletin of Entomological Research. 1961; 52:709-725. DOI
- Boreham PFL, Chandler JA, Highton RB. Studies on the feeding patterns of mosquitoes of the genera Ficalbia, mimomyia and uranotaenia in the Kisumu area of Kenya. Bulletin of Entomological Research. 1975; 65DOI
- Bosak PJ, Reed LM, Crans WJ. Habitat preference of host-seeking Coquillettidia perturbans (Walker) in relation to birds and eastern equine encephalomyelitis virus in new jersey. Journal of Vector Ecology : Journal of the Society for Vector Ecology. 2001; 26:103-109. PubMed
- Boussès P, Dehecq JS, Brengues C, Fontenille D. Inventaire actualisé des moustiques (Diptera : culicidae) de l’île de La Réunion, océan Indien. Bulletin De La Société De Pathologie Exotique. 2013; 106:113-125. DOI | PubMed
- Boxmeyer CE, Palchick SM. Distribution of resting female aedes vexans (Meigen) in wooded and nonwooded areas of metropolitan Minneapolis-St. Paul, Minnesota. Journal of the American Mosquito Control Association. 1999; 15:128-132. PubMed
- Breiman L. Random forests. Machine Learning. 2001; 45:5-32. DOI
- Brugman VA, Hernández-Triana LM, Prosser SW, Weland C, Westcott DG, Fooks AR, Johnson N. Molecular species identification, host preference and detection of myxoma virus in the anopheles maculipennis complex (Diptera: culicidae) in southern England, UK. Parasites & Vectors. 2015; 8:421. DOI | PubMed
- Bueno-Marà R, Almeida APG, Navarro JC. Emerging Zoonoses: Eco-Epidemiology, Involved Mechanisms and Public Health Implications. Frontiers Media SA; 2015.
- Burke DS, Leake CJ. Japanese encephalitis. The Arboviruses: Epidemiology and Ecology. 1988; 3:62-92.
- Burkett-Cadena ND. Mosquitoes of the Southeastern United States. University of Alabama Press: Tuscaloosa; 2013.
- Bustamante DM, Lord CC. Sources of error in the estimation of mosquito infection rates used to assess risk of arbovirus transmission. American Journal of Tropical Medicine and Hygiene. 2010; 82:1172-1184. DOI | PubMed
- Callahan JL, Morris CD. Habitat characteristics of Coquillettidia perturbans in central florida. Journal of the American Mosquito Control Association. 1987; 3:176-180. PubMed
- Cao-Lormeau VM, Blake A, Mons S, Lastère S, Roche C, Vanhomwegen J, Dub T, Baudouin L, Teissier A, Larre P, Vial AL, Decam C, Choumet V, Halstead SK, Willison HJ, Musset L, Manuguerra JC, Despres P, Fournier E, Mallet HP, Musso D, Fontanet A, Neil J, Ghawché F. Guillain-Barré syndrome outbreak associated with zika virus infection in french polynesia: a case-control study. The Lancet. 2016; 387:1531-1539. DOI | PubMed
- Cardoso CA, Lourenço-de-Oliveira R, Codeço CT, Motta MA. Mosquitoes in bromeliads at ground level of the brazilian Atlantic forest: the relationship between mosquito fauna, water volume, and plant type. Annals of the Entomological Society of America. 2015; 108:449-458. DOI | PubMed
- Cardoso JC, de Almeida MA, dos Santos E, da Fonseca DF, Sallum MA, Noll CA, Monteiro HA, Cruz AC, Carvalho VL, Pinto EV, Castro FC, Nunes Neto JP, Segura MN, Vasconcelos PF. Yellow fever virus in haemagogus leucocelaenus and aedes serratus mosquitoes, southern brazil, 2008. Emerging Infectious Diseases. 2010; 16:1918-1924. DOI | PubMed
- Carpenter SJ, LaCasse WJ. Mosquitoes of North America (North of Mexico). University of California Press; 1974.
- Centers for Disease Control and Prevention. Estimated range of Aedes albopictus and Aedes aegypti in the United States, 2016. 2016. Publisher Full Text
- Chadee DD, Hingwan JO, Persad RC, Tikasingh ES. Seasonal abundance, biting cycle, parity and vector potential of the mosquito haemagogus equinus in Trinidad. Medical and Veterinary Entomology. 1993; 7:141-146. DOI | PubMed
- Chadee DD, Persad RC, Andalcio N, Ramdath W. Distribution of haemagogus mosquitoes on small islands off Trinidad, W. I. Mosquito Systematics. 1985; 17:147-153.
- Chadee DD, Tikasingh ES, Ganesh R. Seasonality, biting cycle and parity of the yellow fever vector mosquito haemagogus janthinomys in Trinidad. Medical and Veterinary Entomology. 1992; 6:143-148. DOI | PubMed
- Chadee DD, Tikasingh ES. Diel biting activity of culex (Melanoconion) caudelli in Trinidad, west indies. Medical and Veterinary Entomology. 1989; 3:231-237. DOI | PubMed
- Chalvet-Monfray K, Sabatier P, Bicout DJ. Downscaling modeling of the aggressiveness of mosquitoes vectors of diseases. Ecological Modelling. 2007; 204:540-546. DOI
- Chambers TJ, Monath TP. The Flaviviruses: Detection, Diagnosis and Vaccine Development. Academic Press; 2003.
- Chandler JA, Boreham PF, Highton RB, Hill MN. A study of the host selection patterns of the mosquitoes of the Kisumu area of Kenya. Transactions of the Royal Society of Tropical Medicine and Hygiene. 1975; 69:415-425. DOI | PubMed
- Chapman HC. Observations on aedes Melanimon and A. dorsalis in Nevada. Annals of the Entomological Society of America. 1960; 53:706-708. DOI
- Chapman HF, Hughes JM, Jennings C, Kay BH, Ritchie SA. Population structure and dispersal of the saltmarsh mosquito aedes vigilax in Queensland, Australia. Medical and Veterinary Entomology. 1999; 13:423-430. DOI | PubMed
- Chaves LF, Harrington LC, Keogh CL, Nguyen AM, Kitron UD. Blood feeding patterns of mosquitoes: random or structured?. Frontiers in Zoology. 2010; 7:3-11. DOI | PubMed
- Chen CD, Lee HL, Lau KW, Abdullah AG, Tan SB, Sa’diyah I, Norma-Rashid Y, Oh PF, Chan CK, Sofian-Azirun M. Biting behavior of malaysian mosquitoes, aedes albopictus Skuse, armigeres kesseli ramalingam, culex quinquefasciatus say, and culex vishnui theobald obtained from urban residential areas in kuala lumpur. Asian Biomedicine. 2014; 8:315-321. DOI
- Chevalier V, Mondet B, Diaite A, Lancelot R, Fall AG, Ponçon N. Exposure of sheep to mosquito bites: possible consequences for the transmission risk of rift valley fever in Senegal. Medical and Veterinary Entomology. 2004; 18:247-255. DOI | PubMed
- Chouin-Carneiro T, Vega-Rua A, Vazeille M, Yebakima A, Girod R, Goindin D, Dupont-Rouzeyrol M, Lourenço-de-Oliveira R, Failloux AB. Differential susceptibilities of aedes aegypti and aedes albopictus from the americas to zika virus. PLOS Neglected Tropical Diseases. 2016; 10DOI | PubMed
- Coggeshall LT. Anopheles gambiae in Brazil, 1930-40. American Journal of Public Health and the Nations Health. 1944; 34:75-76. DOI
- Coimbra TL, Nassar ES, Nagamori AH, Ferreira IB, Pereira LE, Rocco IM, Ueda-Ito M, Romano NS. Iguape: a newly recognized Flavivirus from São Paulo state, Brazil. Intervirology. 1993; 36:144-152. PubMed
- Cook GC, Zumla A. Manson’s Tropical Diseases. Elsevier Health Sciences; 2009.
- Cook S, Holmes EC. A multigene analysis of the phylogenetic relationships among the flaviviruses (Family: flaviviridae) and the evolution of vector transmission. Archives of Virology. 2006; 151:309-325. DOI | PubMed
- Cooper RD, Waterson DG, Frances SP, Beebe NW, Sweeney AW. The anopheline fauna of papua new guinea. Journal of the American Mosquito Control Association. 2006; 22:213-221. DOI | PubMed
- Corbet PS. A note on the biting behaviour of the mosquito, aedes ochraceus, in a village in Kenya. East African Medical Journal. 1962; 39:511-514. PubMed
- Crans WJ, Sprenger DA, Mahmood F. The blood-feeding habits of aedes sollicitans (Walker) in relation to eastern equine encephalitis virus in coastal areas of new jersey. 2. results of experiments with caged mosquitoes and the effects of temperature and physiological age on host selection. Journal of Vector Ecology. 1996; 21:1-5.
- Crans WJ, Sprenger DA. The blood-feeding habits of Aedes sollicitans (Walker) in relation to eastern equine encephalitis virus in coastal areas of New Jersey. 3. Habitat preference, vertical distribution, and diel periodicity of host-seeking adults. Journal of Vector Ecology. 1996; 21:6-13.
- Crans WJ. New Jersey mosquito species: Rutgers center for vector biology. 2016. Publisher Full Text
- Cupp EW, Klingler K, Hassan HK, Viguers LM, Unnasch TR. Transmission of eastern equine encephalomyelitis virus in central Alabama. The American Journal of Tropical Medicine and Hygiene. 2003; 68:495-500. PubMed
- Darsie RF, Ward RA. Identification and Geographical Distribution of the Mosquitos of North America, North of Mexico. University Press of Florida; 2005.
- Davies JB. Moonlight and the biting activity of culex (Melanoconion) portesi senevet & abonnenc and C. (M.) taeniopus D. & K. (Diptera, Culicidae) in Trinidad forests. Bulletin of Entomological Research. 1975; 65:81-96. DOI
- Davies JB. Attraction of culex portesi senevet & abonnenc and culex taeniopus dyar & knab (Diptera: culicidae) to 20 animal species exposed in a Trinidad forest. I. baits ranked by numbers of mosquitoes caught and engorged. Bulletin of Entomological Research. 1978; 68:707-719. DOI
- Davis GE, Philip CB. The identification of the blood-meal in west african mosquitoes by means of the precipitin test. a preliminary report*. American Journal of Epidemiology. 1931; 14:130-141. DOI
- Day JF. Predicting St. louis encephalitis virus epidemics: lessons from recent, and not so recent, outbreaks. Annual Review of Entomology. 2001; 46:111-138. DOI | PubMed
- de Cunha Ramos H, Ribeiro H. Research on the mosquitoes of Angola XXI – Description of Eretmapodites angolensis sp. nov. and Eretmapodites dundo sp. nov. of the oedipodeios group. Garcia De Orta. Série De Zoologia. 1990; 17:31-35.
- de Oliveria RL, da Silva TF, Heyden R. Alguns aspectos da ecologia dos mosquitos (Diptera: culicidae) de Uma area de planicie (Granjas Calabria), em Jacarepagua, rio de janeiro. II. Frequencia Mensal E No Ciclo Lunar. Memoirs Instituto Oswaldo Cruz-Fiocruz. 1985; 80:123-133.
- Degallier N, Pajot F, Kramer R, Claustre J, Bellony S. Biting cycle of Culicidae in french guiana. Cahiers O.R.S.T.O.M. (Office De La Recherche Scientifique Et Technique Outre-Mer) Serie Entomologie Medicale Et Parasitologie. 1978; 16:73-84.
- DeGroote JP, Sugumaran R. National and regional associations between human west nile virus incidence and demographic, landscape, and land use conditions in the coterminous united states. Vector-Borne and Zoonotic Diseases. 2012; 12:657-665. DOI | PubMed
- Derraik JG, Ji W, Slaney D. Mosquitoes feeding on brushtail possums (Trichosurus vulpecula) and humans in a native forest fragment in the Auckland region of New Zealand. The New Zealand Medical Journal. 2007; 120PubMed
- Diagne CT, Diallo D, Faye O, Ba Y, Faye O, Gaye A, Dia I, Faye O, Weaver SC, Sall AA, Diallo M. Potential of selected senegalese aedes spp. mosquitoes (Diptera: culicidae) to transmit zika virus. BMC Infectious Diseases. 2015; 15DOI | PubMed
- Diagne N, Fontenille D, Konate L, Faye O, Lamizana MT, Legros F, Molez JF, Trape JF. [Anopheles of Senegal. an annotated and illustrated list]. Bulletin De La Société De Pathologie Exotique. 1994; 87:267-277. PubMed
- Diallo D, Diagne CT, Hanley KA, Sall AA, Buenemann M, Ba Y, Dia I, Weaver SC, Diallo M. Larval ecology of mosquitoes in sylvatic arbovirus foci in southeastern senegal. Parasites & Vectors. 2012a; 5:286-17. DOI | PubMed
- Diallo D, Sall AA, Buenemann M, Chen R, Faye O, Diagne CT, Faye O, Ba Y, Dia I, Watts D, Weaver SC, Hanley KA, Diallo M. Landscape ecology of sylvatic chikungunya virus and mosquito vectors in southeastern senegal. PLoS Neglected Tropical Diseases. 2012b; 6DOI | PubMed
- Diallo D, Sall AA, Diagne CT, Faye O, Faye O, Ba Y, Hanley KA, Buenemann M, Weaver SC, Diallo M. Zika virus emergence in mosquitoes in southeastern Senegal, 2011. PLoS ONE. 2014; 9DOI | PubMed
- Diallo M, Sall AA, Moncayo AC, Ba Y, Fernandez Z, Ortiz D, Coffey LL, Mathiot C, Tesh RB, Weaver SC. Potential role of sylvatic and domestic african mosquito species in dengue emergence. The American Journal of Tropical Medicine and Hygiene. 2005; 73:445-449. PubMed
- Digoutte JP. An arbovirus disease of present interest: yellow fever, its natural history facing an haemorragic fever, rift valley fever. Bulletin De La Société De Pathologie Exotique. 1999; 92:343-348. PubMed
- Doherty RL, Carley JG, Gorman BM, Buchanan P, Welch JS, Whitehead RH. Studies of arthropod-borne virus infections in Queensland. Australian Journal of Experimental Biology and Medical Science. 1964; 42:149-164. DOI | PubMed
- dos Santos Silva J, Alencar J, Costa JM, Seixas-Lorosa E, Guimarães AÉ. Feeding patterns of mosquitoes (Diptera: culicidae) in six brazilian environmental preservation areas. Journal of Vector Ecology. 2012; 37:342-350. DOI | PubMed
- Doucet J, Cachan P. Forest mosquitoes of the ivory coast republic. V. observations on the breeding places of mosquitoes of the genus Eretmapodites in the banco forest, Abidjan. Bulletin De La Société De Pathologie Exotique. 1961; 54:1253-1265.
- Duffy MR, Chen TH, Hancock WT, Powers AM, Kool JL, Lanciotti RS, Pretrick M, Marfel M, Holzbauer S, Dubray C, Guillaumot L, Griggs A, Bel M, Lambert AJ, Laven J, Kosoy O, Panella A, Biggerstaff BJ, Fischer M, Hayes EB. Zika virus outbreak on Yap Island, federated states of Micronesia. New England Journal of Medicine. 2009; 360:2536-2543. DOI | PubMed
- Eastwood G, Goodman SJ, Cunningham AA, Kramer LD. Aedes taeniorhynchus vectorial capacity informs a pre-emptive assessment of west nile virus establishment in galápagos. Scientific Reports. 2013; 3:1-8. DOI | PubMed
- Ebel GD, Rochlin I, Longacker J, Kramer LD. Culex restuans (Diptera: culicidae) relative abundance and vector competence for west nile virus. Journal of Medical Entomology. 2005; 42:838-843. DOI | PubMed
- Elith J, Leathwick JR, Hastie T. A working guide to boosted regression trees. Journal of Animal Ecology. 2008; 77:802-813. DOI | PubMed
- Ellis BR, Wesson DM, Sang RC. Spatiotemporal distribution of diurnal yellow fever vectors (Diptera: culicidae) at two sylvan interfaces in Kenya, east africa. Vector-Borne and Zoonotic Diseases. 2007; 7:129-142. DOI | PubMed
- Evans AM. Notes on Freetown mosquitos, with descriptions of new and Little-Known species. Annals of Tropical Medicine & Parasitology. 1926; 20:97-108. DOI
- Fakoorziba MR, Vijayan A. Breeding habitats of culex tritaeniorhynchus (Diptera: culicidae), A Japanese encephalitis vector, and associated mosquitoes in Mysore, India. Journal of the Entomological Research Society. 2008; 10:1-9.
- Fall AG, Diaïté A, Lancelot R, Tran A, Soti V, Etter E, Konaté L, Faye O, Bouyer J. Feeding behaviour of potential vectors of west nile virus in Senegal. Parasites & Vectors. 2011; 4:99. DOI | PubMed
- Fall AG, Diaïté A, Seck MT, Bouyer J, Lefrançois T, Vachiéry N, Aprelon R, Faye O, Konaté L, Lancelot R. West nile virus transmission in sentinel chickens and potential mosquito vectors, Senegal river Delta, 2008-2009. International Journal of Environmental Research and Public Health. 2013; 10:4718-4727. DOI | PubMed
- Farajollahi A, Fonseca DM, Kramer LD, Marm Kilpatrick A. "Bird biting" mosquitoes and human disease: a review of the role of Culex pipiens complex mosquitoes in epidemiology. Infection, Genetics and Evolution. 2011; 11:1577-1585. DOI | PubMed
- Faria NR, Azevedo RS, Kraemer MU, Souza R, Cunha MS, Hill SC, Thézé J, Bonsall MB, Bowden TA, Rissanen I, Rocco IM, Nogueira JS, Maeda AY, Vasami FG, Macedo FL, Suzuki A, Rodrigues SG, Cruz AC, Nunes BT, Medeiros DB, Rodrigues DS, Nunes Queiroz AL, da Silva EV, Henriques DF, Travassos da Rosa ES, de Oliveira CS, Martins LC, Vasconcelos HB, Casseb LM, Simith DB, Messina JP, Abade L, Lourenço J, Carlos Junior Alcantara L, de Lima MM, Giovanetti M, Hay SI, de Oliveira RS, Lemos PS, de Oliveira LF, de Lima CP, da Silva SP, de Vasconcelos JM, Franco L, Cardoso JF, Vianez-Júnior JL, Mir D, Bello G, Delatorre E, Khan K, Creatore M, Coelho GE, de Oliveira WK, Tesh R, Pybus OG, Nunes MR, Vasconcelos PF. Zika virus in the americas: early epidemiological and genetic findings. Science. 2016; 352:345-349. DOI | PubMed
- Feng LC. The tree-hole species of mosquitoes of peiping, China. Chinese Medical Journal. 1983; 2:503-525.
- Fernandes RS, Campos SS, Ferreira-de-Brito A, Miranda RM, Barbosa da Silva KA, Castro MG, Raphael LM, Brasil P, Failloux AB, Bonaldo MC, Lourenço-de-Oliveira R. Culex quinquefasciatus from rio de janeiro is not competent to transmit the local zika virus. PLOS Neglected Tropical Diseases. 2016; 10DOI | PubMed
- Ferro C, Boshell J, Moncayo AC, Gonzalez M, Ahumada ML, Kang W, Weaver SC. Natural enzootic vectors of venezuelan equine encephalitis virus, Magdalena Valley, Colombia. Emerging Infectious Diseases. 2003; 9:49-54. DOI | PubMed
- Flemings MB. An altitude biting study of culex tritaeniorhynchus (Giles) and other associated mosquitoes in japan. Journal of Economic Entomology. 1959; 52:490-492. DOI
- Flordia Medical Entomology Laboratory. Mosquito information website. 2016. Publisher Full Text
- Fonseca DM, Keyghobadi N, Malcolm CA, Mehmet C, Schaffner F, Mogi M, Fleischer RC, Wilkerson RC. Emerging vectors in the culex pipiens complex. Science. 2004; 303:1535-1538. DOI | PubMed
- Fontenille D, Traore-Lamizana M, Diallo M, Thonnon J, Digoutte JP, Zeller HG. New vectors of rift valley fever in west africa. Emerging Infectious Diseases. 1998; 4:289-293. DOI | PubMed
- Forattini OP, Gomes AC, de Castro Gomes A. Biting activity of aedes scapularis (Rondani) and Haemagogus mosquitoes in southern Brazil (Diptera: Culicidae). Revista De Saúde Pública. 1988; 22:84-93. DOI | PubMed
- Fornadel CM, Norris LC, Franco V, Norris DE. Unexpected anthropophily in the potential secondary malaria vectors anopheles coustani s.l. and anopheles squamosus in Macha, Zambia. Vector-Borne and Zoonotic Diseases. 2011; 11:1173-1179. DOI | PubMed
- Frances SP, Van Dung N, Beebe NW, Debboun M. Field evaluation of repellent formulations against daytime and nighttime biting mosquitoes in a tropical rainforest in northern Australia. Journal of Medical Entomology. 2002; 39:541-544. DOI | PubMed
- Friedman JH. Greedy function approximation: a gradient boosting machine. The Annals of Statistics. 2001; 29:1189-1232. DOI
- Frohne WC. Natural History of Culiseta Impatiens (Wlk.), (Diptera, Culicidae), in Alaska. Transactions of American Microscopical Society. 1953; 72:103-118. DOI
- Fyodorova MV, Savage HM, Lopatina JV, Bulgakova TA, Ivanitsky AV, Platonova OV, Platonov AE. Evaluation of potential west nile virus vectors in Volgograd region, Russia, 2003 (Diptera: culicidae): species composition, bloodmeal host utilization, and virus infection rates of mosquitoes. Journal of Medical Entomology. 2006; 43:552-563. DOI | PubMed
- Gad AM, Riad IB, Farid HA. Host-feeding patterns of culex pipiens and cx. Antennatus (Diptera: culicidae) from a village in Sharqiya Governorate, Egypt. Journal of Medical Entomology. 1995; 32:573-577. DOI | PubMed
- Galindo P, Carpenter SJ, Trapido H. Ecological observations on forest mosquitoes of an endemic yellow fever area in Panama. The American Journal of Tropical Medicine and Hygiene. 1951; 31:98-137. PubMed
- Galindo P, Trapido H, Carpenter SJ. Observations on diurnal forest mosquitoes in relation to sylvan yellow fever in Panama. The American Journal of Tropical Medicine and Hygiene. 1950; 30:533-574. PubMed
- Galindo P. Bionomics of Sabethes chloropterus humboldt, a vector of sylvan yellow fever in middle america. The American Journal of Tropical Medicine and Hygiene. 1958; 7:429-440. PubMed
- Gamino V, Gutiérrez-Guzmán AV, Fernández-de-Mera IG, Ortíz JA, Durán-Martín M, de la Fuente J, Gortázar C, Höfle U. Natural bagaza virus infection in game birds in Southern Spain. Veterinary Research. 2012; 43DOI | PubMed
- Geoffroy B. The aedes (Aedimorphus) Domesticus group (Diptera, Culicidae). Mosquito Systematics. 1987; 19:100-110.
- Germain M, Sureau P, Herve JP, Fabre J, Mouchet J, Robin Y, Geoffrey B. Isolation of the yellow fever virus from the aedes of the Aedes-Africanus group in the Central-African-Republic the importance of the humid and semi humid savanna in the emergence zone of the amaril virus. Cahiers O.R.S.T.O.M. (Office De La Recherche Scientifique Et Technique Outre-Mer) Serie Entomologie Medicale Et Parasitologie. 1976; 14:125-140.
- Giberson DJ, Dau-Schmidt K, Dobrin M. Mosquito species composition, phenology and distribution (Diptera: culicidae) on prince Edward island. Journal of the Acadian Entomological Society. 2007; 3:7-27.
- GIDEON Online. Global guide to infectious diseases.Publisher Full Text
- Gillies MT, De Meillon B. The anophelinae of Africa south of the sahara (Ethiopian zoogeographical region). Publications of the South African Institute for Medical Research. 1968; 54:1-343.
- Githeko AK, Adungo NI, Karanja DM, Hawley WA, Vulule JM, Seroney IK, Ofulla AV, Atieli FK, Ondijo SO, Genga IO, Odada PK, Situbi PA, Oloo JA. Some observations on the biting behavior of anopheles gambiae s.s., anopheles arabiensis, and anopheles funestus and their implications for malaria control. Experimental Parasitology. 1996; 82:306-315. DOI | PubMed
- Gomes AdC, Torres MAN, Paula MBd, Fernandes A, Marassá AM, Consales CA, Fonseca DF. Ecologia de Haemagogus e Sabethes (Diptera: Culicidae) em áreas epizoóticas do vírus da febre amarela, Rio Grande do Sul, Brasil. Epidemiologia e Serviços de Saúde. 2010; 19:101-113.
- Gomes B, Sousa CA, Vicente JL, Pinho L, Calderón I, Arez E, Almeida AP, Donnelly MJ, Pinto J. Feeding patterns of molestus and pipiens forms of culex pipiens (Diptera: Culicidae) in a region of high hybridization. Parasites & Vectors. 2013; 6:93. DOI | PubMed
- Gordeev M, Zvantsov AB, Goriacheva I, ShaÄkevich E, Ezhov MN. Description of the new species anopheles artemievi sp.n. Diptera, Culicidae). ResearchGate. 2005; 2:4-5.
- Gould EA, Solomon T. Pathogenic flaviviruses. The Lancet. 2008; 371:500-509. DOI | PubMed
- Grard G, Moureau G, Charrel RN, Holmes EC, Gould EA, de Lamballerie X. Genomics and evolution of Aedes-borne flaviviruses. Journal of General Virology. 2010; 91:87-94. DOI | PubMed
- Gresser I, Hardy JL, Hu SM, Scherer WF. Factors influencing transmission of japanese B encephalitis virus by a colonized strain of culex tritaeniorhynchus giles, from infected pigs and chicks to susceptible pigs and birds. The American Journal of Tropical Medicine and Hygiene. 1958; 7:365-373. PubMed
- Grieco JP, Johnson S, Achee NL, Masuoka P, Pope K, Rejmánková E, Vanzie E, Andre R, Roberts D. Distribution of anopheles albimanus, anopheles vestitipennis, and anopheles crucians associated with land use in northern Belize. Journal of Medical Entomology. 2006; 43:614-622. DOI | PubMed
- Gubler DJ, Nalim S, Tan R, Saipan H, Sulianti Saroso J. Variation in susceptibility to oral infection with dengue viruses among geographic strains of aedes aegypti. The American Journal of Tropical Medicine and Hygiene. 1979; 28:1045-1052. PubMed
- Guimarães AE, Gentile C, Lopes CM, de Mello RP. Ecology of mosquitoes (Diptera: culicidae) in areas of serra do mar state Park, state of são paulo, Brazil. III. daily biting rhythms and lunar cycle influence. Memórias Do Instituto Oswaldo Cruz. 2000; 95:753-760. DOI | PubMed
- Guo XX, Li CX, Deng YQ, Xing D, Liu QM, Wu Q, Sun AJ, Dong YD, Cao WC, Qin CF, Zhao TY. Culex pipiens quinquefasciatus: a potential vector to transmit zika virus. Emerging Microbes & Infections. 2016; 5DOI | PubMed
- Haddow AD, Schuh AJ, Yasuda CY, Kasper MR, Heang V, Huy R, Guzman H, Tesh RB, Weaver SC. Genetic characterization of zika virus strains: geographic expansion of the asian lineage. PLoS Neglected Tropical Diseases. 2012; 6DOI | PubMed
- Haddow AJ, Williams MC, Woodall JP, Simpson DI, Goma LK. Twelve isolations of Zika virus from Aedes (Stegomyia) africanus (Theobald) taken in and above a Uganda forest. Bulletin of the World Health Organization. 1964; 31:57-69. PubMed
- Haddow AJ. The mosquito fauna and climate of native huts at Kisumu, Kenya. Bulletin of Entomological Research. 1942; 33:91-142. DOI
- Haddow AJ. The mosquitoes of bwamba county, Uganda. IV.- Studies on the genus Eretmapodites, theobald. Bulletin of Entomological Research. 1946a; 37:57-82. DOI
- Haddow AJ. The mosquitoes of bwamba county, Uganda. Bulletin of Entomological Research. 1946b; 37DOI
- Haddow AJ. Studies on the biting habits and medical importance of east african mosquitos in the genus aëdes. II.—Subgenera Mucidus, Diceromyia, Finlaya and Stegomyia. Bulletin of Entomological Research. 1961; 52:317-351. DOI
- Haddow AJ. Observations on the biting habits of mosquitos in the forest canopy at Zika, Uganda, with special reference to the crepuscular periods. Bulletin of Entomological Research. 1964; 55:589-608. DOI
- Hall-Mendelin S, Jansen CC, Cheah WY, Montgomery BL, Hall RA, Ritchie SA, Van den Hurk AF. Culex annulirostris (Diptera: Culicidae) host feeding patterns and Japanese encephalitis virus ecology in northern Australia. Journal of Medical Entomology. 2012; 49:371-377. DOI | PubMed
- Halstead SB. Dengue virus-mosquito interactions. Annual Review of Entomology. 2008; 53:273-291. DOI | PubMed
- Han BA, Schmidt JP, Alexander LW, Bowden SE, Hayman DT, Drake JM. Undiscovered bat hosts of filoviruses. PLOS Neglected Tropical Diseases. 2016; 10DOI | PubMed
- Han BA, Schmidt JP, Bowden SE, Drake JM. Rodent reservoirs of future zoonotic diseases. PNAS. 2015; 112:7039-7044. DOI | PubMed
- Hanson SM, Novak RJ, Lampman RL, Vodkin MH. Notes on the biology of Orthopodomyia in Illinois. Journal of the American Mosquito Control Association. 1995; 11:375-376. PubMed
- Harbach RE, Schnur HJ. Uranotaenia (Pseudoficalbia) mashonaensis, an afrotropical species found in northern israel. Journal of the American Mosquito Control Association. 2007; 23:224-225. DOI | PubMed
- Harbach RE. The mosquitoes of the subgenus culex in southwestern Asia and Egypt (Diptera: culicidae). ResearchGate. 1988; 24:1-240.
- Harbach RE. Mosquito taxonomic inventory. 2015. Publisher Full Text
- Hardy JL, Houk EJ, Kramer LD, Reeves WC. Intrinsic factors affecting vector competence of mosquitoes for arboviruses. Annual Review of Entomology. 1983; 28:229-262. DOI | PubMed
- Hayes EB, Komar N, Nasci RS, Montgomery SP, O’Leary DR, Campbell GL. Epidemiology and transmission dynamics of west nile virus disease. Emerging Infectious Diseases. 2005; 11:1167-1173. DOI | PubMed
- Hearnden MN, Kay BH. Changes in mosquito populations with expansion of the ross river reservoir, Australia, from stage 1 to stage 2A. Journal of the American Mosquito Control Association. 1995; 11:211-224. PubMed
- Heinemann SJ, Aitken THG, Belkin JN. Collection records of the project "Mosquitoes of Middle America". Mosquito Systematics. 1980; 12:179-284.
- Herve JP, Germain M, Geoffroy B. Bioecologie comparee d’Aedes opok Corbet et Van Someren et A. africanus Theobald dans une galerie forestiere du sud de la Republique Centrafricaine. Cah ORSTOM Ser Ent Med Et Parasitol. 1975; 14:235-244.
- Hervy J, Legros F, Ferrara L. Influence de la clarte lunaire sur l’activite trophique d’Aedes taylori (Diptera, Culicidae). Cah ORSTOM Ser Ent Med Et Parasitol. 1986; 24:59-65.
- Hickman R, Brown J. Culiseta Melanura Biology. 2013.
- Hoogstraal H, KNIGHT K. Observations on Eretmapodites silvestris Conchobius Edwards (Culicidae) in the Anglo-Egyptian Sudan. The American Journal of Tropical Medicine and Hygiene. 1951; 31:659-664. PubMed
- Hopkins GHE. Mosquitoes of the ethiopian region I. larval bionomics of mosquitoes and taxonomy of culicine larvae. Adlard & Son, Ltd, British Museum of Natural History. 1952.
- Huang YJ, Ayers VB, Lyons AC, Unlu I, Alto BW, Cohnstaedt LW, Higgs S, Vanlandingham DL. Culex species mosquitoes and zika virus. Vector-Borne and Zoonotic Diseases. 2016; 16:673-676. DOI | PubMed
- Huho B, Briët O, Seyoum A, Sikaala C, Bayoh N, Gimnig J, Okumu F, Diallo D, Abdulla S, Smith T, Killeen G. Consistently high estimates for the proportion of human exposure to malaria vector populations occurring indoors in rural africa. International Journal of Epidemiology. 2013; 42:235-247. DOI | PubMed
- Iwuala M. Peri-Domestic ecology of Dry-Season populations of aedes (stegomyia) Mosquitos (diptera, Culicidae) in Uyo, Cross-River state, Nigeria. Environmental Entomology. 1981; 10:592-599. DOI
- Jansen CC, Williams CR, van den Hurk AF. The usual suspects: comparison of the relative roles of potential urban chikungunya virus vectors in Australia. PLoS One. 2015; 10DOI | PubMed
- Jansen CC, Zborowski P, Ritchie SA, van den Hurk AF. Efficacy of bird-baited traps placed at different heights for collecting ornithophilic mosquitoes in eastern Queensland, Australia. Australian Journal of Entomology. 2009; 48:53-59. DOI
- Johansen CA, Power SL, Broom AK. Determination of mosquito (Diptera: culicidae) bloodmeal sources in western Australia: implications for arbovirus transmission. Journal of Medical Entomology. 2009; 46:1167-1175. DOI | PubMed
- Jupp PG, Brown RG. The laboratory colonization of culex (Culex) univittatus theobald (Diptera: culicidae) from material collected in the highveld region of south Africa. Journal of the Entomological Society of Southern Africa. 1967; 30:34-39.
- Jupp PG, Kemp A. Studies on an outbreak of wesselsbron virus in the free state province, South Africa. Journal of the American Mosquito Control Association. 1998; 14:40-45. PubMed
- Jupp PG, Kemp A. Laboratory vector competence experiments with yellow fever virus and five south african mosquito species including aedes aegypti. Transactions of the Royal Society of Tropical Medicine and Hygiene. 2002; 96:493-498. DOI | PubMed
- Jupp PG, McIntosh BM, Anderson D. Culex (Eumelanomyia) rubinotus theobald as vector of banzi, Germiston and witwatersrand viruses. Journal of Medical Entomology. 1976; 12:647-651. DOI | PubMed
- Jupp PG, McIntosh BM. A bionomic study of adult aedes (Neomelaniconion) circumluteolus in northern Kwazulu, South Africa. Journal of the American Mosquito Control Association. 1987; 3:131-136. PubMed
- Jupp PG. Larval habitats of culicine mosquitoes (Diptera: culcidae) in a sewage effluent disposal area in the south african high veld. Journal of Entomology of South Africa. 1967; 30:243-250.
- Kampen H, Werner D. Out of the bush: the asian bush mosquito aedes japonicus japonicus (Theobald, 1901) (Diptera, Culicidae) becomes invasive. Parasites & Vectors. 2014; 7:59. DOI | PubMed
- Kanojia PC, Geevarghese G. First report on high-degree endophilism in culex tritaeniorhynchus (Diptera: culicidae) in an area endemic for japanese encephalitis. Journal of Medical Entomology. 2004; 41:994-996. DOI | PubMed
- Kanojia PC. Bionomics of culex epidesmus associated with japanese encephalitis virus in India. Journal of the American Mosquito Control Association. 2003; 19:151-154. PubMed
- Karabatsos N. International catalog of arboviruses including certain other viruses of vertebrates. The American Journal of Tropical Medicine and Hygiene. 1985; 27:372-440.
- Karch S, Asidi N, Manzambi ZM, Salaun JJ. [The culicidian fauna and its nuisance in Kinshasha (Zaire)]. Bulletin De La Société De Pathologie Exotique. 1993; 86:68-75. PubMed
- Karch S, Mouchet J. [Anopheles paludis: important vector of malaria in zaire]. Bulletin De La Société De Pathologie Exotique. 1992; 85:388-389. PubMed
- Kaufman MG, Fonseca DM. Invasion biology of aedes japonicus japonicus (Diptera: culicidae). Annual Review of Entomology. 2014; 59:31-49. DOI | PubMed
- Kay BH, Ryan PA, Russell BM, Holt JS, Lyons SA, Foley PN. The importance of subterranean mosquito habitat to arbovirus vector control strategies in North Queensland, Australia. Journal of Medical Entomology. 2000; 37:846-853. DOI | PubMed
- Kenawy MA, Beier JC, Zimmerman JH, el Said S, Abbassy MM. Host-feeding patterns of the mosquito community (Diptera: culicidae) in Aswan Governorate, Egypt. Journal of Medical Entomology. 1987; 24:35-39. DOI | PubMed
- Kenawy MA, Rashed SS, Teleb SS. Characterization of rice field mosquito habitats in Sharkia Governorate, Egypt. Journal of the Egyptian Society of Parasitology. 1998; 28:449-459. PubMed
- Kerr JA. Studies on the transmission of experimental yellow fever by culex thalassius and mansonia uniformis. Ann Trop Med and Parasitol [Liverpool]. 1932; 26:119-127. DOI
- Khoshdel-Nezamiha F, Vatandoost H, Azari-Hamidian S, Bavani MM, Dabiri F, Entezar-Mahdi R, Chavshin AR. Fauna and larval habitats of mosquitoes (Diptera: culicidae) of west Azerbaijan province, northwestern iran. Journal of Arthropod-Borne Diseases. 2014; 8:163-173. PubMed
- Kilpatrick AM, Kramer LD, Campbell SR, Alleyne EO, Dobson AP, Daszak P. West nile virus risk assessment and the bridge vector paradigm. Emerging Infectious Diseases. 2005; 11:425-429. DOI | PubMed
- King WV, Hoogstraal H. Two new species of mosquitoes of the genus Ficalbia from netherlands new guinea. Proceedings of the Entomological Society of Washington. 1946; 48:186-190.
- Kirby MJ, West P, Green C, Jasseh M, Lindsay SW. Risk factors for house-entry by culicine mosquitoes in a rural town and satellite villages in the Gambia. Parasites & Vectors. 2008; 1:41-47. DOI | PubMed
- Knight J, Griffin L, Dale P, Phinn S. Oviposition and larval habitat preferences of the saltwater mosquito, aedes vigilax, in a subtropical mangrove forest in Queensland, Australia. Journal of Insect Science. 2012; 12:6. DOI | PubMed
- Knight KL, Hull WB. The aedes mosquitoes of the philippine islands. Pacific Science. 1953; 7:453-481.
- Komar N, Langevin S, Hinten S, Nemeth N, Edwards E, Hettler D, Davis B, Bowen R, Bunning M. Experimental infection of north american birds with the New York 1999 strain of west nile virus. Emerging Infectious Diseases. 2003; 9:311-322. DOI | PubMed
- Kulkarni SM, Rajput K. Day-Time resting habitats of culicine mosquitoes and their preponderance. Journal of Communicable Diseases. 1988; 20:280-286. PubMed
- Kumar NP, Sabesan S, Panicker KN. Biting rhythm of the vectors of malayan filariasis, mansonia annulifera, M. uniformis & M. indiana in shertallai (Kerala state), India. The Indian Journal of Medical Research. 1989; 89:52-55. PubMed
- Kuno G, Chang GJ, Tsuchiya KR, Karabatsos N, Cropp CB. Phylogeny of the genus Flavivirus. Journal of Virology. 1998; 72:73-83. PubMed
- Laemmert HW, Hughes TP. The virus of IlhéUs encephalitis; isolation, serological specificity and transmission. journal of immunology (Baltimore, md. 1950). 1947; 55:61-67.
- Lane RP, Crosskey RW. Medical Insects and Arachnids. Springer Science & Business Media; 2012.
- Laporta GZ, Crivelaro TB, Vicentin EC, Amaro P, Branquinho MS, Sallum MAM. Culex nigripalpus theobald (Diptera, Culicidae) feeding habit at the parque ecologico do Tiete, Sao Paulo, brazil. Revista Brasileira De Entomologia. 2008; 52:663-668. DOI
- Le Berre R, Hamon J. Description of the larva, pupa and female of aedes (N.) jemoti and revision of the keys to the subgenus neomelaniconion in Africa south of the Sahara. Bulletin De La Société De Pathologie Exotique. 1961; 53:1054-1064.
- Ledermann JP, Guillaumot L, Yug L, Saweyog SC, Tided M, Machieng P, Pretrick M, Marfel M, Griggs A, Bel M, Duffy MR, Hancock WT, Ho-Chen T, Powers AM. Aedes hensilli as a potential vector of Chikungunya and zika viruses. PLoS Neglected Tropical Diseases. 2014; 8DOI | PubMed
- Lee JS, Hong HK. [Seasonal prevalence and behaviour of aedes togoi]. The Korean Journal of Parasitology. 1995; 33:19-26. DOI | PubMed
- Lequime S, Lambrechts L. Vertical transmission of arboviruses in mosquitoes: a historical perspective. Infection, Genetics and Evolution : Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases. 2014; 28:681-690. DOI | PubMed
- Linthicum KJ, Bailey CL, Davies FG, Kairo A. Observations on the dispersal and survival of a population of aedes lineatopennis (Ludlow) (Diptera: culicidae) in Kenya. Bulletin of Entomological Research. 1985; 75DOI
- Liu C, Newell G, White M. On the selection of thresholds for predicting species occurrence with presence-only data. Ecology and Evolution. 2016; 6:337-348. DOI | PubMed
- Liu C, White M, Newell G. Selecting thresholds for the prediction of species occurrence with presence-only data. Journal of Biogeography. 2013; 40:778-789. DOI
- Liu LB, Wong KC, Chen KK, Wu SM. One year’s observations on the development and habits of A. sinensis and C. fatigans in Foochow. Acta Ent Sinica. 1960; 10:86-95.
- Llorente F, Pérez-Ramírez E, Fernández-Pinero J, Elizalde M, Figuerola J, Soriguer RC, Jiménez-Clavero MÁ. Bagaza virus is pathogenic and transmitted by direct contact in experimentally infected partridges, but is not infectious in house sparrows and adult mice. Veterinary Research. 2015; 46:93. DOI | PubMed
- Lobo JM, Jiménez-Valverde A, Real R. AUC: a misleading measure of the performance of predictive distribution models. Global Ecology and Biogeography. 2008; 17:145-151. DOI
- Logan TM, Linthicum KJ, Thande PC, Wagateh JN, Roberts CR. Mosquito species collected from a marsh in western Kenya during the long rains. Journal of the American Mosquito Control Association. 1991; 7:395-399. PubMed
- Lopes J. Ecology of mosquitoes (Diptera: culicidae) in natural and artificial breeding sites of rural area in the north of Parana state, Brazil. 4. wild species breeding in artificial reservoirs. Arquivos De Biologia E Tecnologia. 1996; 39:671-676.
- Lopes J. Ecology of mosquitoes (Diptera, Culicidae) in natural and artificial rural breeding in places in northern Parana state, brazil. VI. Larvae Collections in the Home Surroundings. Revista Brasileira De Zoologia. 1997; 14:571-578. DOI
- Lounibos LP. The bionomics of three sympatric Eretmapodites (Diptera: culicidae) at the Kenya coast. Bulletin of Entomological Research. 1980; 70:309-320. DOI
- Lutomiah J, Omondi D, Masiga D, Mutai C, Mireji PO, Ongus J, Linthicum KJ, Sang R. Blood meal analysis and virus detection in blood-fed mosquitoes collected during the 2006-2007 rift valley fever outbreak in Kenya. Vector Borne and Zoonotic Diseases. 2014; 14:656-664. DOI | PubMed
- MacDonald WW, Smith CE, Webb HE. Arbovirus infections in Sarawak: observations on the mosquitoes. Journal of Medical Entomology. 1965; 1:335-347. DOI | PubMed
- Mackay AJ, Kramer WL, Meece JK, Brumfield RT, Foil LD. Host feeding patterns of culex mosquitoes (Diptera: culicidae) in east baton rouge parish, Louisiana. Journal of Medical Entomology. 2010; 47:238-248. DOI | PubMed
- Mackenzie J, Barrett ADT, Deubel V. Japanese Encephalitis and West Nile Viruses. Springer Science & Business Media; 2012.
- Maestre-Serrano R, Cochero S, Bello B, Ferro C. [Registry and distribution update of the species of the haemagogus (Diptera: culicidae) genus in the Caribbean region of Colombia]. Biomedica : Revista Del Instituto Nacional De Salud. 2013; 33 Suppl 1:185-189. PubMed
- Mahmood F, Crans WJ. Effect of temperature on the development of Culiseta melanura (Diptera: culicidae) and its impact on the amplification of eastern equine encephalomyelitis virus in birds. Journal of Medical Entomology. 1998; 35:1007-1012. DOI | PubMed
- Mahy BWJ. The Dictionary of Virology. Academic Press; 2009.
- Martin DH, Chaniotis BN, Tesh RB. Host preferences of deinocerites pseudes dyar & knab. Journal of Medical Entomology. 1973; 10:206-208. DOI | PubMed
- Mcclelland GA, Weitz B. Further observations on the natural hosts of three species of mansonia blanchard (Diptera, Culicidae) in Uganda. Annals of Tropical Medicine & Parasitology. 1960; 54:300-304. DOI | PubMed
- Medlock JM, Hansford KM, Versteirt V, Cull B, Kampen H, Fontenille D, Hendrickx G, Zeller H, Van Bortel W, Schaffner F. An entomological review of invasive mosquitoes in Europe. Bulletin of Entomological Research. 2015; 105:637-663. DOI | PubMed
- Messina JP, Kraemer MU, Brady OJ, Pigott DM, Shearer FM, Weiss DJ, Golding N, Ruktanonchai CW, Gething PW, Cohn E, Brownstein JS, Khan K, Tatem AJ, Jaenisch T, Murray CJ, Marinho F, Scott TW, Hay SI. Mapping global environmental suitability for zika virus. eLife. 2016; 5:1-22. DOI | PubMed
- Miyagi I, Toma T, Suzuki H, Okazawa T. Mosquitoes of the Takara archipelago, Japan. Mosquito Systematics. 1983; 15:18-27.
- Molaei G, Andreadis TG, Armstrong PM, Diuk-Wasser M. Host-Feeding patterns of potential mosquito vectors in Connecticut, USA: molecular analysis of bloodmeals from 23 species of aedes, anopheles, culex, Coquillettidia, psorophora, and uranotaenia. Journal of Medical Entomology. 2008; 45:1143-1151. DOI | PubMed
- Molaei G, Oliver J, Andreadis TG, Armstrong PM, Howard JJ. Molecular identification of blood-meal sources in Culiseta melanura and Culiseta morsitans from an endemic focus of eastern equine encephalitis virus in New York. The American Journal of Tropical Medicine and Hygiene. 2006; 75:1140-1147. PubMed
- Montarsi F, Martini S, Dal Pont M, Delai N, Ferro Milone N, Mazzucato M, Soppelsa F, Cazzola L, Cazzin S, Ravagnan S, Ciocchetta S, Russo F, Capelli G. Distribution and habitat characterization of the recently introduced invasive mosquito aedes koreicus [Hulecoeteomyia koreica], a new potential vector and pest in north-eastern italy. Parasites & Vectors. 2013; 6:292. DOI | PubMed
- Moreno-Madriñán MJ, Turell M. Factors of concern regarding zika and other aedes aegypti-Transmitted viruses in the United States. Journal of Medical Entomology. 2017. DOI
- Mores CN, Turell MJ, Dohm DJ, Blow JA, Carranza MT, Quintana M. Experimental transmission of west nile virus by culex nigripalpus from honduras. Vector Borne and Zoonotic Diseases. 2007; 7:279-284. DOI | PubMed
- Morrison A, Andreadis TG. Larval population dynamics in a community of nearctic aedes inhabiting a temporary vernal pool. Journal of the American Mosquito Control Association. 1992; 8:52-57. PubMed
- Morsy TA, el Okbi LM, Kamal AM, Ahmed MM, Boshara EF. Mosquitoes of the genus culex in the suez canal governorates. Journal of the Egyptian Society of Parasitology. 1990; 20:265-268. PubMed
- Mouchet J. Observations sur quelques anophèles exophiles au cameroun. Bulletin De La Société De Pathologie Exotique. 1957; 50:378-381.
- Muñoz J, Ruiz S, Soriguer R, Alcaide M, Viana DS, Roiz D, Vázquez A, Figuerola J. Feeding patterns of potential west nile virus vectors in south-west spain. PLoS ONE. 2012; 7DOI | PubMed
- Multini LC, Marrelli MT, Wilke AB. Microsatellite loci cross-species transferability in aedes fluviatilis (Diptera:culicidae): a cost-effective approach for population genetics studies. Parasites & Vectors. 2015; 8:635. DOI | PubMed
- Murdock CC, Olival KJ, Perkins SL. Molecular identification of host feeding patterns of snow-melt mosquitoes (Diptera: culicidae): potential implications for the transmission ecology of Jamestown canyon virus. Journal of Medical Entomology. 2010; 47:226-229. DOI | PubMed
- Muriu SM, Muturi EJ, Shililu JI, Mbogo CM, Mwangangi JM, Jacob BG, Irungu LW, Mukabana RW, Githure JI, Novak RJ. Host choice and multiple blood feeding behaviour of malaria vectors and other anophelines in mwea rice scheme, Kenya. Malaria Journal. 2008; 7DOI | PubMed
- Muturi EJ, Alto BW. Larval environmental temperature and insecticide exposure alter aedes aegypti competence for arboviruses. Vector-Borne and Zoonotic Diseases. 2011; 11:1157-1163. DOI | PubMed
- Muturi EJ, Muriu S, Shililu J, Mwangangi JM, Jacob BG, Mbogo C, Githure J, Novak RJ. Blood-feeding patterns of culex quinquefasciatus and other culicines and implications for disease transmission in mwea rice scheme, Kenya. Parasitology Research. 2008; 102:1329-1335. DOI | PubMed
- Mwandawiro C, Tsuda Y, Tuno N, Higa Y, Urakawa E, Sugiyama A, Yanagi T, Takagi M. Host-feeding patterns of culex tritaeniorhynchus and anopheles sinensis (Diptera: culicidae) in a ricefield agroecosystem. Medical Entomology and Zoology. 1999; 50:267-273. DOI
- Mwangangi JM, Mbogo CM, Muturi EJ, Nzovu JG, Githure JI, Yan G, Minakawa N, Novak R, Beier JC. Spatial distribution and habitat characterisation of anopheles larvae along the kenyan coast. Journal of Vector Borne Diseases. 2007; 44:44-51. PubMed
- Mwangangi JM, Muturi EJ, Mbogo CM. Seasonal mosquito larval abundance and composition in Kibwezi, lower eastern Kenya. Journal of Vector Borne Diseases. 2009; 46:65-71. PubMed
- Mwangangi JM, Muturi EJ, Muriu SM, Nzovu J, Midega JT, Mbogo C. The role of anopheles arabiensis and anopheles coustani in indoor and outdoor malaria transmission in Taveta district, Kenya. Parasites & Vectors. 2013; 6:114. DOI | PubMed
- Natal D, Barata EAMDF, Urbinatti PR, Barata JMS, Paula MBD. On the adult mosquito fauna (Diptera, Culicidae) in an hydroelectric project area in the Parana river basin, Brazil. Revista Brasileira De Entomologia. 1998; 41:213-216.
- Navarro JC, Enriquez S, Duque P, Campana Y, Benitez-Ortiz W. New Sabethes (Diptera: culicidae) species records for Ecuador, from Colonso-Chalupas biological reserve, province of napo (Amazon). Journal of Entomology and Zoology Studies. 2015; 3:169-172.
- Nicholson J, Ritchie SA, Russell RC, Webb CE, Cook A, Zalucki MP, Williams CR, Ward P, van den Hurk AF. Effects of cohabitation on the population performance and survivorship of the invasive mosquito aedes albopictus and the resident mosquito aedes notoscriptus (Diptera: culicidae) in Australia. Journal of Medical Entomology. 2015; 52:375-385. DOI | PubMed
- Nikolay B, Diallo M, Faye O, Boye CS, Sall AA. Vector competence of culex neavei (Diptera: culicidae) for usutu virus. The American Journal of Tropical Medicine and Hygiene. 2012; 86:993-996. DOI | PubMed
- Nir Y. Some characteristics of Israel turkey virus. Archiv Fur Die Gesamte Virusforschung. 1972; 36:105-114. DOI | PubMed
- Nisbet DJ, Lee KJ, van den Hurk AF, Johansen CA, Kuno G, Chang GJ, Mackenzie JS, Ritchie SA, Hall RA. Identification of new flaviviruses in the kokobera virus complex. The Journal of General Virology. 2005; 86:121-124. DOI | PubMed
- Njabo KY, Cornel AJ, Sehgal RN, Loiseau C, Buermann W, Harrigan RJ, Pollinger J, Valkiūnas G, Smith TB. Coquillettidia (Culicidae, diptera) mosquitoes are natural vectors of avian malaria in africa. Malaria Journal. 2009; 8DOI | PubMed
- Njogu A, Kinoti G. Observations on breeding sites of mosquitoes in lake Manyara, a saline lake in east african rift valley. Bulletin of Entomological Research. 1971; 60DOI
- NSW Health. NSW arbovirus surveillance and vector monitoring program. 2016. Publisher Full Text
- Ohba SY, Van Soai N, Van Anh DT, Nguyen YT, Takagi M. Study of mosquito fauna in rice ecosystems around Hanoi, northern vietnam. Acta Tropica. 2015; 142:89-95. DOI | PubMed
- Okorie TG. The flight activity of mosquitoes in Ibadan Nigeria. Nigerian Journal of Entomology. 1978; 3:81-92.
- Omondi D, Masiga DK, Ajamma YU, Fielding BC, Njoroge L, Villinger J. Unraveling Host-Vector-Arbovirus interactions by Two-Gene high resolution melting mosquito bloodmeal analysis in a kenyan Wildlife-Livestock interface. Plos One. 2015; 10DOI | PubMed
- Paramasivan R, Philip SP, Selvaraj PR. Biting rhythm of vector mosquitoes in a rural ecosystem of south India. International Journal of Mosquito Research. 2015; 2:106-113.
- Parascandola M. Skepticism, statistical methods, and the cigarette: a historical analysis of a methodological debate. Perspectives in Biology and Medicine. 2004; 47:244-261. DOI | PubMed
- Paterson HE, Bronsden P, Levitt J, Worth CB. Some culicine mosquitoes (Diptera, Culicidae) at Ndumu, republic of south Africa. Medical Proceedings. 1964; 10:188-192.
- Pedro PM, Sallum MA, Butlin RK. Forest-obligate Sabethes mosquitoes suggest palaeoecological perturbations. Heredity. 2008; 101:186-195. DOI | PubMed
- Peiris JS, Amerasinghe FP, Amerasinghe PH, Ratnayake CB, Karunaratne SH, Tsai TF. Japanese encephalitis in Sri Lanka–the study of an epidemic: vector incrimination, porcine infection and human disease. Transactions of the Royal Society of Tropical Medicine and Hygiene. 1992; 86:307-313. DOI | PubMed
- Penn GH. The larval development and ecology of aedes (Stegomyia) scutellaris (Walker, 1859) in New Guinea. The Journal of Parasitology. 1947; 33:43-50. DOI | PubMed
- Petersen E, Wilson ME, Touch S, McCloskey B, Mwaba P, Bates M, Dar O, Mattes F, Kidd M, Ippolito G, Azhar EI, Zumla A. Rapid spread of zika virus in the americas–implications for public health preparedness for mass gatherings at the 2016 Brazil olympic games. International Journal of Infectious Diseases. 2016; 44:11-15. DOI | PubMed
- Peyton EL, Reinert JF, Peterson NE. The occurrence of deinocerites pseudes dyar and knab in the united states, with additional notes on the biology of deinocerites species of Texas. Mosquito News. 1964; 24:449-458.
- Pinto CS, Confalonieri UEC, Mascarenhas BM. Ecology of Haemagogus sp. and Sabethes sp. (Diptera: Culicidae) in relation to the microclimates of the Caxiuanã National Forest, Pará, Brazil. Memórias do Instituto Oswaldo Cruz. 2009; 104:592-598. DOI | PubMed
- Ponçon N, Balenghien T, Toty C, Baptiste Ferré J, Thomas C, Dervieux A, L’ambert G, Schaffner F, Bardin O, Fontenille D. Effects of local anthropogenic changes on potential malaria vector anopheles hyrcanus and west nile virus vector culex modestus, camargue, France. Emerging Infectious Diseases. 2007; 13:1810-1815. DOI | PubMed
- Powell JR, Tabachnick WJ. History of domestication and spread of aedes aegypti–a review. Memórias Do Instituto Oswaldo Cruz. 2013; 108 Suppl 1:11-17. DOI | PubMed
- Prummongkol S, Panasoponkul C, Apiwathnasorn C, Lek-Uthai U. Biology of culex sitiens, a predominant mosquito in Phang Nga, Thailand after a tsunami. Journal of Insect Science. 2012; 12:1-8. DOI | PubMed
- Qualls WA, Smith ML, Muller GC, Zhao TY, Xue RD. Field evaluation of a large-scale barrier application of bifenthrin on a golf course to control floodwater mosquitoes. Journal of the American Mosquito Control Association. 2012; 28:219-224. DOI | PubMed
- Radrova J, Seblova V, Votypka J. Feeding behavior and spatial distribution of culex mosquitoes (Diptera: culicidae) in wetland areas of the czech republic. Journal of Medical Entomology. 2013; 50:1097-1104. DOI | PubMed
- Ramasamy R, Surendran SN, Jude PJ, Dharshini S, Vinobaba M. Larval development of aedes aegypti and aedes albopictus in peri-urban brackish water and its implications for transmission of arboviral diseases. PLoS Neglected Tropical Diseases. 2011; 5DOI | PubMed
- Ramsdale CD, Snow KR. Distribution of the genera Coquillettidia, orthopodomyia and uranotaenia in Europe. European Mosquito Bulletin. 2001; 10:25-29.
- Reinert JF, Harbach RE, Kitching IJ. Phylogeny and classification of ochlerotatus and allied taxa (Diptera: culicidae: aedini) based on morphological data from all life stages. Zoological Journal of the Linnean Society. 2008; 153:29-114. DOI
- Reinert JF. Contributions to the mosquito fauna of southeast asia. Contributions of the American Entomological Institute. 1970; 5:1-44.
- Reinert JF. Albuginosus, a new subgenus of aedes Meigem (Diptera: Culicidae) described from the afrotropical region. Mosquito Systematics. 1986; 3:307-326.
- Reisen W. The western encephalitis mosquito, culex tarsalis. Wing Beats. 1993; 4:16.
- Reisen WK, Aslamkhan M, Suleman M, Naqvi ZH. Observations on the diel activity patterns of some punjab Pakistan mosquitoes diptera Culicidae. Biologia. 1976; 22:67-78.
- Renshaw M, Service MW, Birley MH. Host finding, feeding patterns and evidence for a memorized Home-Range. Medical and Veterinary Entomology. 1994; 8:187-193. DOI | PubMed
- Renshaw M, Silver JB, Service MW, Birley MH. Spatial-Dispersion patterns of larval aedes cantans (diptera, Culicidae). Bulletin of Entomological Research. 1995; 85:125-133. DOI
- Reuben R, Thenmozhi V, Samuel PP, Gajanana A, Mani TR. Mosquito blood feeding patterns as a factor in the epidemiology of japanese encephalitis in southern India. The American Journal of Tropical Medicine and Hygiene. 1992; 46:654-663. PubMed
- Reuben R. Studies on the mosquitoes of north arcot district, madras state, India. 5. breeding places of the culex vishnui group of species. Journal of Medical Entomology. 1971; 8:363-366. DOI | PubMed
- Rey JR, Nishimura N, Wagner B, Braks MA, O’Connell SM, Lounibos LP. Habitat segregation of mosquito arbovirus vectors in south Florida. Journal of Medical Entomology. 2006; 43:1134-1141. DOI | PubMed
- Ridgeway G. 2015.
- Robert V, Awono-Ambene HP, Thioulouse J. Ecology of larval mosquitoes, with special reference to anopheles arabiensis (Diptera: culcidae) in market-garden wells in urban Dakar, Senegal. Journal of Medical Entomology. 1998; 35:948-955. DOI | PubMed
- Robinson WH. Urban insects and arachnids: a handbook of urban entomology. Cambridge University Press. 2005. DOI
- Rochlin I, Dempsey ME, Campbell SR, Ninivaggi DV. Salt marsh as culex salinarius larval habitat in coastal New York. Journal of the American Mosquito Control Association. 2008; 24:359-367. DOI | PubMed
- Rueda LM, Iwakami M, O’Guinn M, Mogi M, Prendergast BE, Miyagi I, Toma T, Pecor JE, Wilkerson RC. Habitats and distribution of anopheles sinensis and associated Anopheles hyrcanus group in Japan. Journal of the American Mosquito Control Association. 2005; 21:458-463. DOI | PubMed
- Rueda LM, Kim HC, Klein TA, Pecor JE, Li C, Sithiprasasna R, Debboun M, Wilkerson RC. Distribution and larval habitat characteristics of anopheles hyrcanus group and related mosquito species (Diptera: culicidae) in South Korea. Journal of Vector Ecology. 2006; 31:198-205. DOI | PubMed
- Rueger ME, Price RD, Olson TA. Larval habitats of culex tarsalis (Diptera: culicidae) in Minnesota. Mosquito News. 1964; 24:39-42.
- Russell RC, Otranto D, Wall RL. The Encyclopedia of Medical and Veterinary Entomology. CABI; 2013.
- Russell RC. Seasonal abundance of mosquitoes in a native forest of the murray valley of Victoria, 1979?1985. Australian Journal of Entomology. 1986; 25:235-240. DOI
- Russell RC. A review of the status and significance of the species within the culex pipiens group in Australia. Journal of the American Mosquito Control Association. 2012; 28:24-27. DOI | PubMed
- Ryan PA, Kay BH. Emergence trapping of mosquitoes (Diptera: culicidae) in brackish forest habitats in Maroochy Shire, south-east Queensland, Australia, and a management option for verrallina funerea (Theobald) and aedes procax (Skuse). Australian Journal of Entomology. 2000; 39:212-218. DOI
- Sabesan S, Kumar NP, Krishnamoorthy K, Panicker KN. Seasonal abundance & biting behaviour of mansonia annulifera, M. uniformis & M. indiana & their relative role in the transmission of malayan filariasis in shertallai (Kerala state). The Indian Journal of Medical Research. 1991; 93:253-258. PubMed
- Sallum MA, Forattini OP. Revision of the spissipes section of culex (Melanoconion) (Diptera:culicidae). Journal of the American Mosquito Control Association. 1996; 12:517-600. PubMed
- Schuler-Faccini L, Ribeiro EM, Feitosa IM, Horovitz DD, Cavalcanti DP, Pessoa A, Doriqui MJ, Neri JI, Neto JM, Wanderley HY, Cernach M, El-Husny AS, Pone MV, Serao CL, Sanseverino MT, Brazilian Medical Genetics Society–Zika Embryopathy Task Force. Possible association between zika virus infection and microcephaly – Brazil, 2015. MMWR. Morbidity and Mortality Weekly Report. 2016; 65:59-62. DOI | PubMed
- Schwetz J. Contributions a l’etude de la Biologie de Taeniorhynchus (Mansonoides) africanus et de Taeniorhynchus (Coquillettidia) aurites au Congo Beige. Revue De Zoologie Et De Botanique Africaines. 1930; 4:311-330.
- Sebesta O, Halouzka J, Hubálek Z, Juricová Z, Rudolf I, Sikutová S, Svobodová P, Reiter P. Mosquito (Diptera: culicidae) fauna in an area endemic for west nile virus. Journal of Vector Ecology. 2010; 35:156-162. DOI | PubMed
- Selvaraj PR, Dwarakanath SK. The biting activity rhythm in aedini mosquitoes of Madurai. Comparative Physiological Ecology. 1992; 17:66-70.
- Serandour J, Rey D, Raveton M. Behavioural adaptation of coquillettidia (Coquillettidia) richiardii larvae to underwater life: environmental cues governing plant–insect interaction. Entomologia Experimentalis Et Applicata. 2006; 120:195-200. DOI
- Service MW. The ecology of the Tree-Hole breeding mosquitoes in the northern guinea savanna of Nigeria. The Journal of Applied Ecology. 1965a; 2:1-16. DOI
- Service MW. The identification of blood-meals from culicine mosquitos from northern Nigeria. Bulletin of Entomological Research. 1965b; 55:637-643. DOI | PubMed
- Service MW. Mosquito ecology: field sampling methods. Springer Science & Business Media. 1993. DOI
- Shililu J, Ghebremeskel T, Seulu F, Mengistu S, Fekadu H, Zerom M, Ghebregziabiher A, Sintasath D, Bretas G, Mbogo C, Githure J, Brantly E, Novak R, Beier JC. Larval habitat diversity and ecology of anopheline larvae in Eritrea. Journal of Medical Entomology. 2003; 40:921-929. DOI | PubMed
- Silver JB. Mosquito Ecology: Field Sampling Methods. Springer Science & Business Media; 2007.
- Simsek FM. Seasonal larval and adult population dynamics and breeding habitat diversity of culex theileri theobald, 1903 (Diptera: culicidae) in the golbasi district, Ankara, turkey. Turkish Journal of Zoology. 2004; 28:337-344.
- Sinka ME, Bangs MJ, Manguin S, Chareonviriyaphap T, Patil AP, Temperley WH, Gething PW, Elyazar IR, Kabaria CW, Harbach RE, Hay SI. The dominant anopheles vectors of human malaria in the Asia-Pacific Region: occurrence data, distribution maps and bionomic précis. Parasites & Vectors. 2011; 4:89. DOI | PubMed
- Sirivanakarn S, Galindo P. Culex-adamesi new-species from panama diptera culicidae. Mosquito Systematics. 1980; 12:25-34.
- Smith GC, Seaman SR, Wood AM, Royston P, White IR. Correcting for optimistic prediction in small data sets. American Journal of Epidemiology. 2014; 180:318-324. DOI | PubMed
- Smith ME. Mountain mosquitoes of the gothic, Colorado, area. American Midland Naturalist. 1966; 76:125-150. DOI
- Snow WF, Boreham PFL. The feeding habits of some west african culex (Dipt., Culicidae) mosquitoes. Bulletin of Entomological Research. 1973; 62:517-526. DOI
- Snow WF, Boreham PFL. The host-feeding patterns of some culicine mosquitoes (Diptera: culicidae) in the Gambia. Bulletin of Entomological Research. 1978; 68:695-706. DOI
- Someren ECC. The female and early stages of culex (Culex) nakuruensis mattingly, with a description of a new subspecies of culex (Culex) shoae hamon & ovazza. Proceedings of the Royal Entomological Society of London. Series B, Taxonomy. 1967; 36:11-16. DOI
- Sommerman KM. Notes on activities of Alaskan Culiseta adults (Diptera: culicidae). Mosquito News. 1964; 24:60-64.
- Sriwichai P, Samung Y, Sumruayphol S, Kiattibutr K, Kumpitak C, Payakkapol A, Kaewkungwal J, Yan G, Cui L, Sattabongkot J. Natural human plasmodium infections in major anopheles mosquitoes in western Thailand. Parasites & Vectors. 2016; 9:17. DOI | PubMed
- Stein M, Zalazar L, Willener JA, Almeida FL, Almirón WR. Culicidae (Diptera) selection of humans, chickens and rabbits in three different environments in the province of chaco, Argentina. Memórias Do Instituto Oswaldo Cruz. 2013; 108:563-571. DOI | PubMed
- Steyn JJ, Schulz KH. Aëdes (Ochlerotatus) caballus theobald, the south african vector of rift valley fever. South African Medical Journal = Suid-Afrikaanse Tydskrif Vir Geneeskunde. 1955; 29:1114-1120. PubMed
- Suárez-Mutis MC, Fe NF, Alecrim W, Coura JR. Night and crepuscular mosquitoes and risk of vector-borne diseases in areas of piassaba extraction in the middle negro river basin, state of amazonas, brazil. Memórias Do Instituto Oswaldo Cruz. 2009; 104:11-17. DOI | PubMed
- Sudeep AB. Culex gelidus: an emerging mosquito vector with potential to transmit multiple virus infections. Journal of Vector Borne Diseases. 2014; 51:251-258. PubMed
- Sylla M, Ndiaye M, Black WC. Aedes species in treeholes and fruit husks between dry and wet seasons in southeastern senegal. Journal of Vector Ecology. 2013; 38:237-244. DOI | PubMed
- Takahashi M. Taxonomic and ecological notes on culex (Melanoconion) Spissipes (Theobald). Journal of Medical Entomology. 1968; 5:329-331. DOI | PubMed
- Tang Y, Diao Y, Chen H, Ou Q, Liu X, Gao X, Yu C, Wang L. Isolation and genetic characterization of a tembusu virus strain isolated from mosquitoes in Shandong, China. Transboundary and Emerging Diseases. 2015; 62:209-216. DOI | PubMed
- Taye A, Hadis M, Adugna N, Tilahun D, Wirtz RA. Biting behavior and plasmodium infection rates of anopheles arabiensis from Sille, Ethiopia. Acta Tropica. 2006; 97:50-54. DOI | PubMed
- Thomson MC, Doblas-Reyes FJ, Mason SJ, Hagedorn R, Connor SJ, Phindela T, Morse AP, Palmer TN. Malaria early warnings based on seasonal climate forecasts from multi-model ensembles. Nature. 2006; 439:576-579. DOI | PubMed
- Toma T, Miyagi I, Okazawa T, Kobayashi J, Saita S, Tuzuki A, Keomanila H, Nambanya S, Phompida S, Uza M, Takakura M. Entomological surveys of malaria in Khammouane Province, lao PDR, in 1999 and 2000. The Southeast Asian Journal of Tropical Medicine and Public Health. 2002; 33:532-546. PubMed
- Traoré-Lamizana M, Fontenille D, Diallo M, Ba Y, Zeller HG, Mondo M, Adam F, Thonon J, Maïga A. Arbovirus surveillance from 1990 to 1995 in the barkedji area (Ferlo) of Senegal, a possible natural focus of rift valley fever virus. Journal of Medical Entomology. 2001; 38:480-492. DOI | PubMed
- Tsunoda T, Fukuchi A, Nanbara S, Higa Y, Takagi M. Aedes mosquito larvae collected from Ishigaki-jima and Taketomi-jima islands in southern Japan. The Southeast Asian Journal of Tropical Medicine and Public Health. 2012; 43:1375-1379. PubMed
- Turell MJ, Dohm DJ, Sardelis MR, Oguinn ML, Andreadis TG, Blow JA. An update on the potential of north american mosquitoes (Diptera: culicidae) to transmit west nile virus. Journal of Medical Entomology. 2005; 42:57-62. DOI | PubMed
- Turell MJ, O’Guinn ML, Dohm DJ, Jones JW. Vector competence of north american mosquitoes (Diptera: culicidae) for west nile virus. Journal of Medical Entomology. 2001; 38:130-134. DOI | PubMed
- Van der Kuyp E. Notes on haemagogus anastasionis dyar of curaçao. Documenta Neerlandica Et Indonesica De Morbis Tropicis; Quarterly Journal of Tropical Medicine and Hygiene. 1949; 1:142-144. PubMed
- Van Regenmortel MHV, Fauquet CM, Bishop DHL. Virus Taxonomy : Classification and Nomenclature of Viruses : Seventh Report of the International Committee on Taxonomy of Viruses. Academic Press: San Diego; 2000.
- Ventim R, Ramos JA, Osório H, Lopes RJ, Pérez-Tris J, Mendes L. Avian malaria infections in western european mosquitoes. Parasitology Research. 2012; 111:637-645. DOI | PubMed
- Veronesi R, Gentile G, Carrieri M, Maccagnani B, Stermieri L, Bellini R. Seasonal pattern of daily activity of aedes caspius, aedes detritus, culex modestus, and culex pipiens in the po Delta of northern Italy and significance for vector-borne disease risk assessment. Journal of Vector Ecology. 2012; 37:49-61. DOI | PubMed
- Versteirt V, Boyer S, Damiens D, De Clercq EM, Dekoninck W, Ducheyne E, Grootaert P, Garros C, Hance T, Hendrickx G, Coosemans M, Van Bortel W. Nationwide inventory of mosquito biodiversity (Diptera: culicidae) in Belgium, Europe. Bulletin of Entomological Research. 2013; 103:193-203. DOI | PubMed
- Viana LA, Soares P, Paiva F, Lourenço-De-Oliveira R. Caiman-biting mosquitoes and the natural vectors of Hepatozoon caimani in brazil. Journal of Medical Entomology. 2010; 47:670-676. DOI | PubMed
- Waddell MB, Taylor RM. Studies on cyclic passage of yellow fever virus in south american mammals and mosquitoes – Marmosets (callithrix-Aurita) and Cebus monkeys (cebus-Versutus) in combination with Aedes-Aegypti and Haemagogus-Equinus. American Journal of Tropical Medicine. 1945; 25:225-230.
- Walter Reed Biosystematics Unit, W.D. Walter Reed biosystematics unit systematic catalog of Culicidae. 2016. Publisher Full Text
- Wang LY. Host preference of mosquito vectors of japanese encephalitis. Zhonghua Minguo Wei Sheng Wu Xue Za Zhi = Chinese Journal of Microbiology. 1975; 8:274-279. PubMed
- Wang ZM, Xing D, Wu ZM, Yao WJ, Gang W, Xin DS, Jiang YF, Xue RD, Dong YD, Li CX, Guo XX, Zhang YM, Zhao TY. Biting activity and host attractancy of mosquitoes (Diptera: culicidae) in Manzhouli, China. Journal of Medical Entomology. 2012; 49:1283-1288. DOI | PubMed
- Wanson M, Lebred eB. L’habitat des Phlebotomes cavernicoles de Thys-ville (Congo Beige). Archives De l’Institute Pasteur d’Algerie. 1946; 24:153-156.
- Weaver SC, Costa F, Garcia-Blanco MA, Ko AI, Ribeiro GS, Saade G, Shi PY, Vasilakis N. Zika Virus: history, emergence, biology, and prospects for control. Antiviral Research. 2016; 130:69-80. DOI | PubMed
- Weaver SC, Forrester NL. Chikungunya: evolutionary history and recent epidemic spread. Antiviral Research. 2015; 120:32-39. DOI | PubMed
- Weaver SC. Infectious Diseases From Nature: Mechanisms of Viral Emergence and Persistence. Springer Vienna: Springer-Verlag/Wien; 2005. DOI
- Webb C, Russell R, Doggett S. A Guide to Mosquitoes of Australia. Csiro Publishing; 2016.
- Wharton RH. The biology of mansonia mosquitoes in relation to the transmission of filariasis in Malaya. Bulletin – Institute for Medical Research, Kuala Lumpur. 1962; 11:1-114. PubMed
- Williams CR, Kokkinn MJ. Daily patterns of locomotor and sugar-feeding activity of the mosquito culex annulirostris from geographically isolated populations. Physiological Entomology. 2005; 30:309-316. DOI
- Williams CR. Timing of host-seeking behaviour of the mosquitoes anopheles annulipes sensu lato walker and Coquillettidia linealis (Skuse) (Diptera: culicidae) in the Murray River Valley, South Australia. Australian Journal of Entomology. 2005; 44:110-112. DOI
- Wright AE, Anderson S, Stanley NF, Liehne PF, Britten DK. A preliminary investigation of the ecology of arboviruses in the Derby area of the Kimberley region, Western Australia. Australian Journal of Experimental Biology and Medical Science. 1981; 59:357-367. DOI | PubMed
- Yamar BA, Diallo D, Kebe CM, Dia I, Diallo M. Aspects of bioecology of two rift valley fever virus vectors in Senegal (West africa): Aedes vexans and culex poicilipes (Diptera: culicidae). Journal of Medical Entomology. 2005; 42:739-750. DOI | PubMed
- Yee DA, Skiff JF. Interspecific competition of a new invasive mosquito, culex coronator, and two container mosquitoes, aedes albopictus and cx. quinquefasciatus (Diptera: culicidae), across different detritus environments. Journal of Medical Entomology. 2014; 51:89-96. DOI | PubMed
- Young EC. Mosquitoes of rarotonga, cook islands: a survey of breeding sites. New Zealand Journal of Zoology. 2007; 34:57-61. DOI
Fonte
Evans MV, Dallas TA, Han BA, Murdock CC, Drake JM, et al. () Data-driven identification of potential Zika virus vectors. eLife 6e22053. https://doi.org/10.7554/eLife.22053





