Introduzione
Le infezioni acute delle vie respiratorie sono una delle principali cause di morbilità e mortalità a livello globale e sono responsabili del 10% delle visite ambulatoriali e dei reparti di emergenza negli USA1 e di circa 2,65 milioni di decessi in tutto il mondo nel 2013.2 Studi osservazionali riportano associazioni indipendenti coerenti tra basse concentrazioni sieriche di 25-idrossivitamina D (il principale metabolita circolante della vitamina D) e la suscettibilità alle infezioni acute delle vie respiratorie. 34 La 25-idrossitamina D supporta l’induzione di peptidi antimicrobici in risposta a stimoli sia virali che batterici,567 suggerendo un potenziale meccanismo attraverso il quale potrebbe essere mediata una protezione inducibile della vitamina D contro gli agenti patogeni respiratori. Metaboliti della vitamina D sono stati riportati anche per indurre altri meccanismi innati di effettori antimicrobici, tra cui l’induzione di autofagia e la sintesi di intermedi di azoto reattivo e di intermedi di ossigeno reattivi. 8 Questi dati epidemiologici e in vitro hanno indotto numerosi studi controllati randomizzati a determinare se l’integrazione di vitamina D può ridurre il rischio di infezione acuta delle vie respiratorie. Finora sono state condotte un totale di cinque meta-analisi di dati aggregati che incorporano i dati di un massimo di 15 studi primari, di cui due riportano effetti protettivi statisticamente significativi910 e tre non riportano effetti statisticamente significativi. 111213 Tutte le meta-analisi11 di questi dati aggregati, tranne una, hanno riportato un’eterogeneità statisticamente significativa degli effetti tra gli studi primari.
Questa eterogeneità potrebbe essere il risultato della variazione delle caratteristiche dei partecipanti e dei regimi di dosaggio tra uno studio e l’altro, che possono modificare gli effetti dell’integrazione di vitamina D sull’immunità agli agenti patogeni respiratori. 14 Persone con malattia polmonare ostruttiva cronica che hanno uno stato basale di vitamina D inferiore sono state segnalate per ottenere maggiori benefici clinici dall’integrazione rispetto a quelle con uno stato basale più elevato,1516 e caratteristiche dei partecipanti come l’età e l’indice di massa corporea sono state segnalate per modificare la risposta della 25-idrossivitamina D all’integrazione di vitamina D. 1718 Il trattamento con boli di vitamina D di grandi dimensioni è stato associato ad una ridotta efficacia per gli effetti non classici,9 e in alcuni casi ad un aumento del rischio di esiti negativi. 19 Mentre i fattori a livello di studio sono suscettibili di essere esplorati attraverso la meta-analisi dei dati aggregati dei dati pubblicati, i potenziali modificatori di effetto che operano a livello individuale, come lo stato di base della vitamina D, possono essere esplorati solo utilizzando la meta-analisi dei dati dei singoli partecipanti (IPD). Questo perché i sottogruppi non sono costantemente disaggregati nei rapporti di prova e gli aggiustamenti per i potenziali confonditori non possono essere applicati in modo simile nei vari studi. 20 Per identificare i fattori che potrebbero spiegare l’eterogeneità osservata dei risultati degli studi randomizzati controllati, abbiamo intrapreso una meta-analisi IPD basata su tutti i 25 studi randomizzati controllati di integrazione di vitamina D per la prevenzione delle infezioni acute delle vie respiratorie che sono stati completati fino alla fine di dicembre 2015.
Metodi
Protocollo e registrazione
I metodi sono stati prespecificati in un protocollo che è stato registrato presso il PROSPERO International Prospective Register of Systematic Reviews (www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD42014013953). L’approvazione da parte di un comitato etico di ricerca per condurre questa meta-analisi non era richiesta nel Regno Unito; per gli studi di Camargo et al21 (il comitato di revisione etica del Ministero della Salute della Mongolia), Murdoch et al22 (Southern Health and Disability Ethics Committee, riferimento URB/09/10/050/AM02), Rees et al23 (Comitato per la protezione dei soggetti umani, Dartmouth College, USA); protocollo n. 24381), Tachimoto et al24 (comitato etico della Jikei University School of Medicine, riferimento 26-333: 7839), Tran et al25 (comitato etico per la ricerca umana dell’Istituto di ricerca medica QIMR Berghofer, P1570), e Urashima et al2627 (comitato etico della Scuola di Medicina dell’Università di Jikei, riferimento 26-333: 7839).
Coinvolgimento dei pazienti e del pubblico
Due rappresentanti dei pazienti e del pubblico sono stati coinvolti nello sviluppo delle domande di ricerca e nella scelta delle misure di esito specificate nel protocollo di studio. Non sono stati coinvolti nel reclutamento dei pazienti, poiché si tratta di una meta-analisi degli studi completati. I dati relativi all’onere dell’intervento sulla qualità della vita e sulla salute dei partecipanti non sono stati oggetto di meta-analisi. Dove possibile, i risultati di questa revisione sistematica e meta-analisi saranno diffusi ai singoli partecipanti attraverso i principali sperimentatori di ogni studio.
Criteri di ammissibilità
Gli studi randomizzati, in doppio cieco, controllati con placebo, di integrazione con vitamina D3 o vitamina D2 di qualsiasi durata erano ammissibili per l’inclusione se erano stati approvati da un comitato etico di ricerca e se i dati sull’incidenza di infezione acuta delle vie respiratorie erano stati raccolti prospetticamente e prespecificati come risultato di efficacia. L’ultimo requisito è stato imposto per ridurre al minimo gli errori di classificazione (gli strumenti progettati prospetticamente per catturare gli eventi di infezione acuta delle vie respiratorie sono stati considerati più sensibili e specifici per questo risultato). Abbiamo escluso gli studi che riportavano i risultati del follow-up a lungo termine di studi primari randomizzati controllati.
Identificazione e selezione dello studio
Due ricercatori (ARM e DAJ) hanno effettuato ricerche su Medline, Embase, il Cochrane Central Register of Controlled Trials (CENTRAL), Web of Science, ClinicalTrials.gov e l’International Standard Randomized Controlled Trials Number (ISRCTN) utilizzando le strategie di ricerca elettronica descritte nel materiale supplementare. Le ricerche sono state regolarmente aggiornate fino al 31 dicembre 2015 compreso. Non sono state imposte restrizioni linguistiche. Queste ricerche sono state integrate da ricerche di articoli di revisione e liste di riferimento di pubblicazioni di prova. Ai collaboratori è stato chiesto se erano a conoscenza di ulteriori prove. Due sperimentatori (ARM e CAC) hanno determinato quali prove soddisfacevano i criteri di idoneità.
Processi di raccolta dati
I DPI sono stati richiesti allo sperimentatore principale per ogni sperimentazione ammissibile e i termini della collaborazione sono stati specificati in un accordo di trasferimento dati, firmato da rappresentanti del fornitore di dati e del destinatario (Queen Mary University of London). I dati sono stati deidentificati alla fonte prima del trasferimento via e-mail. Al ricevimento, tre sperimentatori (DAJ, RLH e LG) hanno valutato l’integrità dei dati eseguendo controlli interni di coerenza e cercando di replicare i risultati dell’analisi per l’incidenza dell’infezione acuta delle vie respiratorie, laddove questa è stata pubblicata nel rapporto dello studio. Gli autori dello studio sono stati contattati per fornire i dati mancanti e per risolvere le domande derivanti da questi controlli di integrità. Una volta risolte le domande, i dati puliti sono stati caricati nel database principale dello studio, che si è tenuto in STATA IC v12 (College Station, TX).
I dati relativi alle caratteristiche dello studio sono stati estratti per le seguenti variabili: impostazione, criteri di ammissibilità, dettagli dei regimi di intervento e di controllo, durata dello studio e definizione dei casi di infezione acuta delle vie respiratorie. Sono stati estratti i dati IPD per le seguenti variabili, se disponibili: dati di base sono stati richiesti per l’età, il sesso, l’identificatore di cluster (solo studi randomizzati di cluster), l’origine razziale o etnica, lo stato di vaccinazione contro l’influenza, l’anamnesi dell’asma, l’anamnesi della malattia polmonare ostruttiva cronica, il peso corporeo, l’altezza (adulti e bambini in grado di stare in piedi) o la lunghezza (neonati), la concentrazione di siero 25-idrossivitamina D, l’assegnazione dello studio (vitamina D rispetto al placebo) e i dettagli di qualsiasi variabile di stratificazione o minimizzazione. Sono stati richiesti dati di follow-up per il numero totale di infezioni acute delle vie respiratorie (superiori o inferiori), infezioni delle vie respiratorie superiori e infezioni delle vie respiratorie inferiori sperimentate durante lo studio; tempo dalla prima dose di farmaco di studio alla prima infezione acuta delle vie respiratorie (superiore o inferiore), infezione delle vie respiratorie superiori o inferiore, se applicabile; numero totale di cicli di antibiotici assunti per l’infezione acuta delle vie respiratorie durante lo studio; numero totale di giorni di assenza dal lavoro o dalla scuola a causa di sintomi di infezione acuta delle vie respiratorie durante lo studio; concentrazione di siero 25-idrossivitamina D al follow-up finale; durata del follow-up; numero e natura degli eventi avversi gravi; numero di potenziali reazioni avverse (ipercalcemia incidente o calcoli renali); e status di partecipante alla fine dello studio (completato, ritirato, perso al follow-up, morto).
Rischio di valutazione del pregiudizio per gli studi individuali
Abbiamo utilizzato lo strumento Cochrane Collaboration risk of bias tool28 per valutare la generazione di sequenze, l’occultamento dell’allocazione, l’accecamento dei partecipanti, del personale e dei valutatori di esito, la completezza dei dati di esito e la prova della segnalazione selettiva degli esiti e di altre potenziali minacce alla validità. Due investigatori (ARM e DAJ) hanno valutato in modo indipendente la qualità dello studio, ad eccezione dei tre studi di Martineau e colleghi, che sono stati valutati dal CAC. Le discrepanze sono state risolte per consenso.
Definizione dei risultati
L’esito primario della meta-analisi è stata l’incidenza di un’infezione acuta delle vie respiratorie, che comprendeva eventi classificati come infezione delle vie respiratorie superiori, infezione delle vie respiratorie inferiori e infezione acuta delle vie respiratorie di posizione non classificata (cioè, infezione delle vie respiratorie superiori o inferiori, o entrambe). I risultati secondari sono stati l’incidenza di infezioni delle vie respiratorie superiori e inferiori, analizzate separatamente; l’incidenza della frequenza del pronto soccorso o del ricovero in ospedale, o di entrambi per l’infezione acuta delle vie respiratorie; l’uso di antimicrobici per il trattamento dell’infezione acuta delle vie respiratorie; l’assenza dal lavoro o dalla scuola a causa di un’infezione acuta delle vie respiratorie; l’incidenza e la natura di eventi avversi gravi; l’incidenza di potenziali reazioni avverse alla vitamina D (ipercalcemia o calcoli renali); e la mortalità (infezione acuta delle vie respiratorie correlata e tutte le cause).
Metodi di sintesi
LG e RLH hanno analizzato i dati. Il nostro approccio di meta-analisi IPD ha seguito le linee guida pubblicate. 20 Inizialmente abbiamo rianalizzato tutti gli studi separatamente; agli autori originali è stato chiesto di confermare l’accuratezza di questa rianalisi laddove era stata eseguita in precedenza, e le eventuali discrepanze sono state risolte. Poi abbiamo eseguito sia una meta-analisi IPD in un passo che due passi per ogni risultato separatamente, utilizzando un modello di effetti casuali adattati per età, sesso e durata dello studio per ottenere l’effetto dell’intervento in pool con un intervallo di confidenza del 95%. Non abbiamo corretto per altre covariate perché la mancanza di valori per alcuni partecipanti avrebbe portato alla loro esclusione dalle analisi statistiche. Nell’approccio in un’unica fase, abbiamo modellato l’IPD da tutti gli studi contemporaneamente, tenendo conto del raggruppamento dei partecipanti all’interno degli studi. Nell’approccio in due fasi abbiamo prima analizzato l’IPD per ogni studio separato in modo indipendente per produrre una stima dell’effetto del trattamento per quello studio; poi abbiamo sintetizzato questi dati in una seconda fase. 20 Per la meta-analisi IPD in una fase abbiamo valutato l’eterogeneità calcolando la deviazione standard degli effetti casuali; per la meta-analisi IPD in due fasi abbiamo riassunto l’eterogeneità utilizzando la statistica I2. Abbiamo calcolato il numero necessario per trattare per evitare che una persona abbia un’infezione acuta delle vie respiratorie (NNT) utilizzando il calcolatore Visual Rx NNT (www.nntonline.net/visualrx/), dove la meta-analisi dei risultati dicotomici ha rivelato un effetto benefico statisticamente significativo dell’allocazione alla vitamina D rispetto al placebo.
Esplorazione della variazione degli effetti
Per esplorare le cause dell’eterogeneità e identificare i fattori che modificano gli effetti dell’integrazione di vitamina D, abbiamo eseguito analisi di sottogruppi predefiniti estendendo il quadro di meta-analisi in un unico passaggio per includere i termini di interazione trattamento-covariata. I sottogruppi sono stati definiti in base allo stato di base della vitamina D (siero 25-idrossivitamina D <25 v ≥25 nmol/L), regime di dosaggio della vitamina D (giornaliero o settimanale senza dosaggio in bolo rispetto ad un regime che comprende almeno una dose in bolo di almeno 30.000 UI di vitamina D), dimensione della dose (equivalente giornaliero <800 UI, 800-1999 UI, ≥2000 UI), età (≤1 anno, 1.1-15,9 anni, 16-65 anni, >65 anni), indice di massa corporea (<25 v ≥25), e presenza rispetto all’assenza di asma, broncopneumopatia cronica ostruttiva e precedente vaccinazione antinfluenzale. Per garantire che gli effetti dei sottogruppi segnalati fossero indipendenti, abbiamo adeguato le analisi di interazione per i potenziali confonditori (età, sesso e durata dello studio). Il cut-off di 25 nmol/L per la concentrazione di base di 25-idrossivitamina D nelle analisi dei sottogruppi è stato selezionato sulla base del fatto che è la soglia per la carenza di vitamina D definita dal Ministero della Salute del Regno Unito,29 e il livello al di sotto del quale i partecipanti agli studi clinici hanno sperimentato i benefici più consistenti dell’integrazione. 30 Abbiamo anche eseguito un’analisi esplorativa che indaga gli effetti nei sottogruppi definiti utilizzando i cut-off 50 nmol/L e 75 nmol/L per la concentrazione di base di 25-idrossivitamina D circolante, perché studi osservazionali hanno riportato che stati meno profondi di carenza di vitamina D possono anche associarsi indipendentemente a un aumento del rischio di infezione acuta delle vie respiratorie. 3132 Per ridurre al minimo la possibilità di errore di tipo 1 derivante da analisi multiple, abbiamo dedotto la significatività statistica per le analisi di sottogruppo solo dove i valori P per i termini di interazione trattamento-covariata erano <0,05.
Valutazione della qualità attraverso gli studi
Per l’analisi primaria abbiamo indagato la probabilità di un pregiudizio di pubblicazione attraverso la costruzione di una trama a imbuto migliorato di contorno. 33 Abbiamo utilizzato le cinque considerazioni di GRADO (limiti dello studio, coerenza dell’effetto, imprecisione, indiretto e bias di pubblicazione)34 per valutare la qualità dell’insieme delle prove che contribuiscono all’analisi dei risultati primari di efficacia e dei principali risultati di sicurezza della nostra meta-analisi (vedi tabella supplementare S3).
Analisi supplementari
Abbiamo condotto analisi di sensibilità escludendo l’IPD dagli studi in cui l’infezione acuta delle vie respiratorie era un esito secondario (rispetto a un esito primario o co-primario), e in cui il rischio di parzialità è stato valutato come non chiaro. Abbiamo anche condotto un’analisi del responder nei partecipanti randomizzati al braccio di intervento di studi inclusi per i quali erano disponibili dati di studio finale su 25-idrossivitamina D, confrontando il rischio di infezione acuta delle vie respiratorie in coloro che hanno raggiunto un livello sierico di 75 nmol/L o più rispetto a coloro che non lo hanno fatto.
Risultati
Selezione dello studio e DPI ottenuti
La nostra ricerca ha individuato 532 studi unici che sono stati valutati per l’idoneità; di questi, 25 studi, per un totale di 11-321 partecipanti randomizzati, soddisfacevano i criteri di idoneità (fig. 1). Per tutti i 25 studi sono stati ricercati e ottenuti i DPI. I dati di risultato per l’analisi primaria della percentuale di partecipanti che hanno contratto almeno un’infezione acuta delle vie respiratorie sono stati ottenuti per 10 933 (96,6%) dei partecipanti randomizzati.

Fig 1 Flusso di selezione dello studio. IPD=dati dei singoli partecipanti

Fig 1 Flusso di selezione dello studio. IPD=dati dei singoli partecipanti
Caratteristiche dello studio e dei partecipanti
La Tabella 1 presenta le caratteristiche degli studi ammissibili e dei loro partecipanti. Le prove sono state condotte in 14 paesi di quattro continenti e hanno iscritto partecipanti di entrambi i sessi dalla nascita fino a 95 anni. Siero di base 25-idrossivitamina D concentrazioni di base sono state determinate in 19/25 prove: la concentrazione media di base variava da 18,9 a 88,9 nmol/L. Le caratteristiche di base dei partecipanti randomizzati all’intervento e al controllo erano simili (vedi tabella supplementare S1). Tutti gli studi hanno somministrato la vitamina D3 per via orale ai partecipanti al braccio di intervento: questa è stata somministrata sotto forma di dosi in bolo ogni mese a ogni tre mesi in sette studi, dosi settimanali in tre studi, una dose giornaliera in 12 studi e una combinazione di bolo e dosi giornaliere in tre studi. La durata dello studio variava da sette settimane a 1,5 anni. L’incidenza di un’infezione acuta delle vie respiratorie era l’esito primario o co-primario per 14 studi e un esito secondario per 11 studi.
| Riferimento | Impostazione (durata dello studio) | Partecipanti (maschio:femmina) | Età media (SD), anni (gamma) | 25(OH)D | No in intervento:gruppo di controllo | Dose orale di vitamina D3 | ARTI | Nessuna analisi primaria in ingresso/Non randomizzata (%) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Test, schema EQA | Livello di base medio (SD), nmol/L (intervallo) | Livello di base <25 nmol/L (%) | Definizione | Tipo di risultato | |||||||
| Li-Ng 200941 | USA (3 mesi) | Adulti sani (34:128) | 57.9 (13.6) (21.4-80.6) | RIA (DiaSorin), DEQAS | 63.7 (25.5) (16.0-156.0) | 3/150 (2.0) | 84:78 | 50 µg al giorno, placebo | URTI: ≥2 sintomi URTI in assenza di sintomi di allergia | Primario | 157/162 (96.9) |
| Urashima 201027 | Giappone (4 mesi) | Scolari (242:188) | 10.2 (2.3) (6.0-15.0) | — | ND | — | 217:213 | 30 µg al giorno, placebo | URTI: influenza A/B diagnosticata da RIDT o RIDT-negativo ILI | Primario | 334/430 (77.7) |
| Manaseki-Holland 201042 | Afghanistan (3 mesi) | Bambini in età prescolare con polmonite (257:196) | 1.1 (0.8) (0.1-3.3) | — | ND | — | 224:229 | 2,5 mg bolo una volta, placebo | LRTI: episodio ripetuto di tachipnea specifica per la polmonite senza ansimare | Secondario | 453/453 (100.0) |
| Laaksi 201037 | Finlandia (6 mesi) | Coscritti militari (164:0) | 19.1 (0.6) (18.0-21.0) | EIA (IDS OCTEIA) | 75.9 (18.7) (41.9-129.0) | 0/73 (0.0) | 80:84 | 10 µg al giorno, placebo | ARTI: diagnosi della cartella clinica | Primario | 164/164 (100.0) |
| Majak 201143 | Polonia (6 mesi) | Bambini con asma (32:16) | 10.9 (3.3) (6.0-17.0) | RIA (BioSource Europe), RIQAS | 88.9 (38.2) (31.5-184.7) | 0/48 (0.0) | 24:24 | 12,5 µg al giorno, placebo | ARTI: auto-relazione | Secondario | 48/48 (100.0) |
| Trilok-Kumar 201144 | India (6 mesi) | Neonati di basso peso alla nascita (970:1109) | 0.1 (0.0) (0.0-0.3) | — | ND | ND | 1039:1040 | 35 µg a settimana, placebo | ARTI: diagnosi della cartella clinica degli eventi che hanno portato al ricovero in ospedale | Secondario | 2064/2079 (99.3) |
| Lehouck 201215 | Belgio (1 anno) | Adulti con BPCO (145:37) | 67.9 (8.3) (48.0-86.0) | RIA (Diasorin), DEQAS | 49.8 (29.2) (9.0-159.7) | 31/182 (17.0) | 91:91 | 2,5 mg bolo mensile, placebo | URTI: auto-relazione | Secondario | 175/182 (96.2) |
| Manaseki-Holland 201235 | Afghanistan (1,5 anni) | Neonati (1591:1455) | 0.5 (0.3) (0.0-1.0) | — | ND | ND | 1524:1522 | 2,5 mg bolo 3 mesi, placebo | LRTI: polmonite confermata dalla radiografia toracica | Primario | 3011/3046 (98.9) |
| Camargo 201221 | Mongolia (7 settimane) | 3°/4° elementare (129:118) | 10.0 (0.9) (7.0-12.7) | LC-MS/MS, DEQAS | 18.9 (9.7) (3.3-61.2) | 192/245 (78.4) | 143:104 | 7,5 µg al giorno, placebo | ARTI: il genitore ha segnalato “infezioni al torace o raffreddori”. | Secondario | 244/247 (98.8) |
| Murdoch 201222 | Nuova Zelanda (1,5 anni) | Adulti sani (81:241) | 48.1 (9.7) (18.0-67.6) | LC-MS/MS, DEQAS | 72.1 (22.1) (13.0-142.0) | 5/322 (1.6) | 161:161 | 2×5 mg bolo mensile, poi 2,5 mg bolo mensile, placebo | URTI: valutata con il punteggio dei sintomi | Primario | 322/322 (100.0) |
| Bergman 201245 | Svezia (1 anno) | Adulti con maggiore suscettibilità all’ARTI (38:102) | 53.1 (13.1) (20.0-77.0) | CLA (DiaSorin), DEQAS | 49.3 (23.2) (8.0-135.0) | 15/131 (11.45) | 70:70 | 100 µg al giorno, placebo | URTI: valutata con il punteggio dei sintomi | Secondario | 124/140 (88.6) |
| Marchisio 201346 | Italia (6 mesi) | Bambini con otite media acuta ricorrente (64:52) | 2.8 (1.0) (1.3-4.8) | CLA (DiaSorin), ISO9001 | 65.3 (17.3) (24.7-120.6) | 2/116 (1.7) | 58:58 | 25 µg al giorno, placebo | URTI: medico con diagnosi di otite media acuta | Primario | 116/116 (100.0) |
| Rees 201323 | USA (13 mesi, media) | Adulti con precedente adenoma colorettale (438:321*) | 61.2 (6.6) (47.1-77.9) | RIA (IDS), DEQAS | 62.5 (21.3) (30.2-171.6) | 0/759 (0.0) | 399:360 | 25 µg al giorno, placebo | URTI: valutata dal diario giornaliero dei sintomi | Secondario | 759/759 (100.0) |
| Tran 201425 | Australia (1 anno) | Anziani sani (343:301) | 71.7 (6.9) (60.3-85.2) | CLA (DiaSorin), DEQAS | 41.7 (13.5) (12.6-105.0) | 66/643 (10.3) | 430:214 | 0,75 mg bolo v 1,5 mg bolo mensile, placebo | URTI: freddo autodichiarato | Secondario | 594/644 (92.2) |
| Goodall 201447 | Canada (8 settimane) | Studenti universitari sani (218:382) | 19.6 (2.2) (17.0-33.0) | — | ND | — | 300:300 | 0,25 mg a settimana (fattoriale con gargarismi), placebo | URTI: freddo autodichiarato | Primario | 492/600 (82.0) |
| Urashima 201426 | Giappone (2 mesi) | Studenti delle scuole superiori (162:85) | 16.5 (1.0) (15.0-18.0) | — | ND | — | 148:99 | 50 µg al giorno, placebo | URTI: influenza A diagnosticata da RIDT o RIDT negativo ILI | Primario | 247/247 (100.0) |
| Sovvenzione 201448 | Nuova Zelanda (9 mesi: 3 mesi di gravidanza + 6 mesi d’infanzia) | Donne incinte e figli (0:260 (madri) 121:128 (figli)) | unborn | LC-MS/MS, DEQAS | 54.8 (25.8) (8.0-128.0) | 30/200 (15.0) | 173:87 (madri) 164:85 (figli) | Madri: 25 µg v 50 µg al giorno Lattanti: 10 µg v 20 µg al giorno, placebo | ARTI: il medico ha diagnosticato l’ARTI che precipita la consultazione per le cure primarie | Secondario | 236/260 (90.8) |
| Martineau 2015a16 (ViDiCO) | Regno Unito (1 anno) | Adulti con BPCO (144:96) | 64.7 (8.5) (40.0-85.0) | LC-MS/MS, DEQAS | 46.1 (25.7) (0.0-160.0) | 50/240 (20.8) | 122:118 | 3 mg bolo 2 mesi, placebo | URTI: valutata dal diario giornaliero dei sintomi | Coprimaria | 240/240 (100.0) |
| Martineau 2015b49 (ViDiA) | Regno Unito (1 anno) | Adulti con asma (109:141) | 47.9 (14.4) (16.0-78.0) | LC-MS/MS, DEQAS | 49.6 (24.7) (0.0-139.0) | 36/250 (14.4) | 125:125 | 3 mg bolo 2 mesi, placebo | URTI: valutata dal diario giornaliero dei sintomi | Coprimaria | 250/250 (100.0) |
| Martineau 2015c50 (ViDiFlu) | Regno Unito (1 anno) | Anziani e i loro accompagnatori (82:158) | 67.1 (13.0) (21.4-94.0) | LC-MS/MS, DEQAS | 42.9 (23.0) (0.0-128.0) | 60/240 (25.0) | 137:103 | Adulti anziani: 2,4 mg bolo 2 mesi+10 µg al giorno. Badanti: 3 mg 2 mesi, adulti anziani: placebo+10 µg al giorno. Badanti: placebo | URTI e LRTI, entrambi valutati dal diario giornaliero dei sintomi | Coprimaria | 240/240 (100.0) |
| Simpson 201551 | Australia (17 settimane) | Adulti sani (14:20) | 32.2 (12.2) (18.0-52.0) | LC-MS/MS, DEQAS | 67.9 (23.0) (32.0-132.0) | 0/33 (0.0) | 18:16 | 0,5 mg alla settimana, placebo | ARTI valutata con il punteggio dei sintomi | Primario | 34/34 (100.0) |
| Dubnov-Raz 201536 | Israele (12 settimane) | Nuotatori adolescenti con insufficienza di vitamina D (34:20) | 15.2 (1.6) (12.9-18.6) | RIA (DiaSorin), DEQAS | 60.4 (11.9) (28.0-74.6) | 0/54 (0.0) | 27:27 | 50 µg al giorno, placebo | URTI valutata con il punteggio dei sintomi | Primario | 25/54 (46.3) |
| Denlinger 201652 | USA (28 settimane) | Adulti con asma (130:278) | 39.2 (12.9) (18.0-85.0) | CLA (DiaSorin), VDSP | 47.0 (16.9) (10.0-74.6) | 55/408 (13.5) | 201:207 | 2,5 mg bolo poi 100 µg al giorno, placebo | URTI valutata con il punteggio dei sintomi | Secondario | 408/408 (100.0) |
| Tachimoto 201624 | Giappone (6 mesi) | Bambini con asma (50:39) | 9.9 (2.3) (6.0-15.0) | RIA (DiaSorin), CAP | 74.9 (24.6) (20.0-187.2) | 1/89 (1.1) | 54:35 | 20 µg al giorno, primi 2 mesi, placebo | URTI: valutato con il punteggio dei sintomi | Secondario | 89/89 (100.0) |
| Ginde, 201653 | USA (1 anno) | Residenti di case di riposo per anziani (45:62) | 80.7 (9.9) (60.0-95.0) | LC-MS/MS, VDSP | 57.3 (22.7) (11.7-106.1) | 12/107 (11.2) | 55:52 | 2,5 mg bolo mensile+≤25 µg al giorno equivalente, placebo+10-25 µg al giorno equivalente | ARTI: diagnosi della cartella clinica | Primario | 107/107 (100.0) |
L’integrità dell’IPD è stata confermata dalla replica delle analisi primarie in documenti pubblicati, ove applicabile. Il processo di controllo dell’IPD ha individuato tre errori tipografici nei rapporti pubblicati. Per la sperimentazione 2012 di Manaseki-Holland et al,35 il numero corretto di episodi ripetuti di radiografia toracica ha confermato la polmonite 134, anziché 138 come riportato. Per lo studio di Dubnov-Raz et al,36 il numero di pazienti randomizzati al braccio di intervento è stato di 27, invece di 28 come riportato. Per lo studio di Laaksi et al,37 la proporzione di uomini randomizzati al placebo che non hanno avuto alcuna infezione acuta delle vie respiratorie è stata di 30/84, invece di 30/80 come riportato.
Rischio di distorsione all’interno degli studi
La tabella supplementare S2 fornisce dettagli sul rischio di valutazione del rischio di distorsione. Tutti gli studi, tranne due, sono stati valutati a basso rischio di distorsione per tutti gli aspetti valutati. Due studi sono stati valutati come a rischio di distorsione non chiaro a causa di alti tassi di perdita per il follow-up. Nello studio di Dubnov-Raz et al,36 il 52% dei partecipanti non ha completato tutti i questionari sui sintomi. Nello studio di Laaksi et al,37 il 37% dei partecipanti randomizzati ha perso il follow-up.
Incidenza di infezione acuta delle vie respiratorie
Risultati complessivi
La tabella 2 presenta i risultati della meta-analisi IPD in un unico passaggio che analizza gli effetti della vitamina D sulla percentuale di tutti i partecipanti che hanno contratto almeno un’infezione acuta delle vie respiratorie, adattandola all’età, al sesso e alla durata dello studio. L’integrazione di vitamina D ha portato ad una riduzione statisticamente significativa della percentuale di partecipanti che hanno contratto almeno un’infezione acuta delle vie respiratorie (odds ratio corretto 0,88, intervallo di confidenza del 95% da 0,81 a 0,96, P=0,003; P per l’eterogeneità <0,001; NNT=33, intervallo di confidenza del 95% da 20 a 101; 10-933 partecipanti in 25 studi; vedere il grafico di Cates, figura supplementare S1). Effetti protettivi statisticamente significativi della vitamina D sono stati osservati anche per un’analisi in un unico passaggio del tasso di infezione acuta delle vie respiratorie (rapporto di incidenza regolato 0,96, intervallo di confidenza del 95% 0,92 a 0,997, P = 0,04; P per l’eterogeneità <0.001; 10 703 partecipanti a 25 studi), ma non per l’analisi del tempo fino alla prima infezione acuta delle vie respiratorie (rapporto di pericolo regolato 0,95, intervallo di confidenza del 95% da 0,89 a 1,01, P=0,09; P per l’eterogeneità <0,001; 9108 partecipanti a 18 studi). Le analisi in due fasi hanno anche mostrato effetti coerenti per la percentuale di partecipanti che hanno avuto almeno un’infezione acuta delle vie respiratorie (odds ratio corretto 0,80, 0,69 a 0,93, P=0,004; P per l’eterogeneità 0,001; 10-899 partecipanti in 24 studi; fig 2), tasso di infezione acuta delle vie respiratorie (rapporto di incidenza corretto 0.91, da 0,84 a 0,98, P=0,018; P per l’eterogeneità <0,001; 10 703 partecipanti a 25 studi), e dal tempo alla prima infezione acuta delle vie respiratorie (rapporto di rischio corretto 0,92, da 0,85 a 1,00, P=0,051; P per l’eterogeneità 0,14; 9108 partecipanti a 18 studi). Queste prove sono state valutate di alta qualità (vedi tabella supplementare S3).
| Variabili | N. di prove* | Proporzione con ≥1 ARTI, gruppo di controllo (%) | Proporzione con ≥1 ARTI, gruppo di intervento (%) | Quota corretta (95% CI)† | Valore P | Valore P per l’interazione |
|---|---|---|---|---|---|---|
| Complessivamente | 25 | 2204/5225 (42.2) | 2303/5708 (40.3) | 0,88 (0,81 a 0,96) | 0.003 | — |
| Linea di base 25(OH)D (nmol/L): | ||||||
| <25 | 14 | 137/249 (55.0) | 117/289 (40.5) | 0,58 (0,40 a 0,82) | 0.002 | 0.01 |
| ≥25 | 19 | 1027/1639 (62.7) | 1179/1995 (59.1) | 0,89 (0,77 a 1,04) | 0.15 | |
| Tipo di regime di dosaggio: | ||||||
| Dose di bulus ≥ 30.000 UI data | 10 | 994/2786 (35.7) | 1097/3014 (36.4) | 0,97 (0,86 a 1,10) | 0.67 | 0.05 |
| Dose di bulus non somministrata | 15 | 1210/2439 (49.6) | 1206/2694 (44.8) | 0,81 (0,72 a 0,91) | <0.001 | |
| Dose giornaliera equivalente (µg): | ||||||
| <20 | 5 | 629/1321 (47.6) | 619/1435 (43.1) | 0,80 (0,68 a 0,94) | 0.006 | 0.12 |
| 20-50 | 9 | 945/2796 (33.8) | 1023/3077 (33.2) | 0,90 (da 0,79 a 1,01) | 0.08 | |
| ≥50 | 11 | 630/1108 (56.9) | 661/1196 (55.3) | 0,98 (0,81 a 1,18) | 0.84 | |
| Età (anni): | ||||||
| ≤1 | 4 | 832/2744 (30.3) | 854/2827 (30.2) | 0,94 (da 0,83 a 1,06) | 0.33 | 0.61 |
| 1.1-15.9 | 8 | 241/513 (47.0) | 194/566 (34.3) | 0,60 (0,46 a 0,77) | <0.001 | |
| 16-65 | 17 | 854/1459 (58.5) | 885/1592 (55.6) | 0,93 (da 0,79 a 1,10) | 0.41 | |
| >65 | 11 | 277/509 (54.4) | 370/723 (51.2) | 0,86 (0,67 a 1,09) | 0.21 | |
| Indice di massa corporea (kg/m2): | ||||||
| <25 | 19 | 972/1943 (50.0) | 956/2074 (46.1) | 0,85 (0,74 a 0,97) | 0.02 | 0.29 |
| ≥25 | 17 | 659/1039 (63.4) | 754/1235 (61.1) | 0,95 (da 0,79 a 1,14) | 0.58 | |
| Asma: | ||||||
| No | 11 | 518/1008 (51.4) | 520/1101 (47.2) | 0,82 (0,68 a 0,99) | 0.04 | 0.48 |
| Sì | 11 | 296/534 (55.4) | 285/542 (52.6) | 0,95 (0,73 a 1,25) | 0.73 | |
| COPD: | ||||||
| No | 7 | 477/763 (62.5) | 493/791 (62.3) | 1,00 (da 0,80 a 1,26) | 0.98 | 0.38 |
| Sì | 6 | 122/230 (53.0) | 120/238 (50.4) | 0,84 (da 0,57 a 1,24) | 0.38 | |
| Vaccinazione antinfluenzale: | ||||||
| No | 10 | 255/373 (68.4) | 253/407 (62.2) | 0,74 (0,52 a 1,03) | 0.08 | 0.51 |
| Sì | 10 | 564/779 (72.4) | 577/826 (69.9) | 0,86 (0,68 a 1,09) | 0.22 |
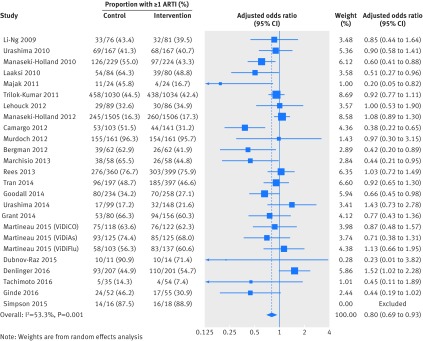
Fig. 2 Meta-analisi dei dati dei singoli partecipanti in due fasi: percentuale di partecipanti con almeno un’infezione acuta delle vie respiratorie (ARTI). I dati della sperimentazione di Simpson et al non sono stati inclusi in questa meta-analisi in due fasi, in quanto non è stato possibile ottenere una stima dell’effetto dell’intervento nello studio nel modello di regressione a causa delle piccole dimensioni del campione.

Fig. 2 Meta-analisi dei dati dei singoli partecipanti in due fasi: percentuale di partecipanti con almeno un’infezione acuta delle vie respiratorie (ARTI). I dati della sperimentazione di Simpson et al non sono stati inclusi in questa meta-analisi in due fasi, in quanto non è stato possibile ottenere una stima dell’effetto dell’intervento nello studio nel modello di regressione a causa delle piccole dimensioni del campione.
Analisi dei sottogruppi
Per esplorare le ragioni dell’eterogeneità, abbiamo condotto analisi di sottogruppo per indagare se gli effetti dell’integrazione di vitamina D sul rischio di infezione acuta delle vie respiratorie differiscono a seconda dello stato di base della vitamina D, della frequenza di dosaggio, della dimensione della dose, dell’età, dell’indice di massa corporea, della presenza o meno di comorbilità (asma o malattia polmonare ostruttiva cronica) e dello stato di vaccinazione contro l’influenza. La razza o l’etnia non è stata studiata come potenziale modificatore di effetto, in quanto mancavano i dati per questa variabile per 3680/10933 (34%) partecipanti e il potere per le analisi dei sottogruppi era limitato da piccoli numeri in molti sottogruppi razziali o etnici che non potevano essere significativamente combinati. La tabella 2 presenta i risultati. L’analisi dei sottogruppi ha rivelato un forte effetto protettivo della supplementazione di vitamina D tra quelli con baseline circolanti 25-idrossivitamina D livelli inferiori a 25 nmol/L (rapporto di quote corrette 0,58, 0,40 a 0,82, NNT = 8, 5 a 21; 538 partecipanti in 14 studi; all’interno del sottogruppo P = 0.002; vedi grafico Cates, figura supplementare S1) e nessun effetto statisticamente significativo tra quelli con livelli di base di 25 o più nmol/L (rapporto di quote corrette 0,89, 0,77 a 1,04; 3634 partecipanti a 19 studi; all’interno del sottogruppo P = 0,15; P per l’interazione 0,01). Questa prova è stata valutata come di alta qualità (vedi tabella supplementare S3). Un’analisi esplorativa testare gli effetti della supplementazione di vitamina D in quelli con baseline 25-idrossitamina D concentrazioni di base 25-49,9 nmol / L, 50-74,9 nmol / L, e 75 o più nmol / L non ha rivelato la prova di una interazione statisticamente significativa (vedi tabella supplementare S4).
Meta-analisi dei dati di studi in cui la vitamina D è stata somministrata utilizzando un regime giornaliero o settimanale senza dosi bolo supplementare ha rivelato un effetto protettivo contro l’infezione acuta delle vie respiratorie (rapporto corretto quote 0,81, 0,72 a 0,91, NNT = 20, 13 a 43; 5133 partecipanti a 15 studi; all’interno del sottogruppo P<0,001; vedi trama Cates, figura supplementare S1). Nessun effetto protettivo di questo tipo è stato visto tra i partecipanti agli studi in cui è stata somministrata almeno una dose di vitamina D in bolo (odds ratio corretto 0,97, 0,86 a 1,10; 5800 partecipanti a 10 studi; all’interno del sottogruppo P=0,67; P per l’interazione 0,05). Questa prova è stata valutata come di alta qualità (vedi tabella supplementare S3). I valori P per l’interazione sono stati più di 0,05 per tutti gli altri potenziali modificatori di effetto esaminati. Per entrambe queste analisi di sottogruppo, sono stati osservati effetti ampiamente coerenti per l’analisi del tasso di evento (vedi tabella supplementare S5) e per l’analisi della sopravvivenza (vedi tabella supplementare S6).
Dopo aver identificato due potenziali fattori che hanno modificato l’influenza dell’integrazione di vitamina D sul rischio di infezione acuta delle vie respiratorie (cioè, lo stato di base della vitamina D e la frequenza di dosaggio), abbiamo poi proceduto a indagare se questi fattori agivano come modificatori di effetto indipendenti, o se erano confusi l’uno dall’altro o da un altro potenziale modificatore di effetto, come l’età. Le trame a punti hanno rivelato una tendenza verso una minore concentrazione mediana del siero di base 25-idrossivitamina D e una maggiore età mediana per gli studi che impiegano bolo rispetto al dosaggio giornaliero o settimanale (vedi figure supplementari S2 e S3). Per stabilire quale di questi potenziali modificatori di effetto agisce in modo indipendente, abbiamo ripetuto l’analisi per includere i termini di interazione trattamento-covariata per lo stato della vitamina D di base, la frequenza di dosaggio e l’età. In questo modello, i termini di interazione per lo stato di base della vitamina D e la frequenza di dosaggio erano statisticamente significativi (P = 0,01 e P = 0,004, rispettivamente), ma il termine di interazione per l’età non era (P = 0,20), coerente con l’ipotesi che lo stato di base della vitamina D e la frequenza di dosaggio, ma non l’età, ha modificato in modo indipendente l’effetto della supplementazione di vitamina D sul rischio di infezione acuta delle vie respiratorie.
Abbiamo quindi proceduto a stratificare l’analisi dei sottogruppi presentata nella tabella 2 in base alla frequenza di dosaggio, per fornire uno sguardo “più pulito” ai risultati delle analisi dei sottogruppi nell’ipotesi che l’uso di dosi in bolo fosse inefficace. La tabella 3 presenta i risultati: questi rivelano che il trattamento giornaliero o settimanale di vitamina D è stato associato ad un grado ancora maggiore di protezione contro le infezioni acute delle vie respiratorie tra i partecipanti con baseline circolanti 25-idrossivitamina D concentrazioni inferiori a 25 nmol/L rispetto all’analisi non stratificata (adjusted odds ratio 0.30, 0.17 a 0.53; NNT = 4, 3 a 7; 234 partecipanti in sei studi; all’interno del sottogruppo P<0.001; vedi Cates trama, figura supplementare S4). Inoltre, l’uso di vitamina D giornaliera o settimanale anche protetto contro l’infezione acuta delle vie respiratorie tra i partecipanti con più alte concentrazioni di base 25-idrossivitamina D (rapporto di quote corrette 0,75, 0,60 a 0,95; NNT = 15, 9 a 86; 1603 partecipanti in sei studi; all’interno del sottogruppo P = 0,02; vedi Cates trama, figura supplementare S4). Il valore P per l’interazione per questa analisi del sottogruppo era 0,006, indicando che gli effetti protettivi dell’integrazione giornaliera o settimanale di vitamina D erano statisticamente significativamente maggiori nel sottogruppo dei partecipanti con profonda carenza di vitamina D. Nessun’altra interazione statisticamente significativa è stata osservata; in particolare, l’integrazione di vitamina D in bolo non ha offerto alcuna protezione contro l’infezione acuta delle vie respiratorie anche quando somministrato a coloro che hanno circolato 25-idrossivitamina D concentrazioni inferiori a 25 nmol/L (odds ratio corretto 0,82, 0,51 a 1,33; 304 partecipanti in otto studi; all’interno del sottogruppo P = 0,43).
| Variabili | Dosaggio del bolo | Dosaggio giornaliero o settimanale | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N. di prove* | Proporzione con ≥1 ARTI, gruppo di controllo (%) | Proporzione con ≥1 ARTI, gruppo di intervento (%) | Quota corretta (95% CI)† | Valore P | Valore P per l’interazione | N. di prove* | Proporzione con ≥1 ARTI, gruppo di controllo (%) | Proporzione con ≥1 ARTI, gruppo di intervento (%) | Quota corretta (95% CI)† | Valore P | Valore P per l’interazione | ||
| Complessivamente | 10 | 994/2786 (35.7) | 1097/3014 (36.4) | 0,97 (da 0,86 a 1,10) | 0.67 | — | 15 | 1210/2439 (49.6) | 1206/2694 (44.8) | 0,81 (0,72 a 0,91) | 0.001 | — | |
| Linea di base 25(OH)D (nmol/L): | |||||||||||||
| <25 | 8 | 73/142 (51.4) | 77/162 (47.5) | 0,82 (0,51 a 1,33) | 0.43 | 0.42 | 6 | 64/107 (59.8) | 40/127 (31.5) | 0,30 (da 0,17 a 0,53) | <0.001 | 0.006 | |
| ≥25 | 8 | 550/910 (60.4) | 663/1121 (59.1) | 1,02 (0,83 a 1,24) | 0.87 | 11 | 477/729 (65.4) | 516/874 (59.0) | 0,75 (da 0,60 a 0,95) | 0.02 | |||
| Dose giornaliera equivalente (µg): | |||||||||||||
| <20 | . | . | . | . | . | 0.56 | 5 | 629/1321 (47.6) | 619/1435 (43.1) | 0,80 (0,68 a 0,94) | 0.006 | 0.82 | |
| 20-50 | 3 | 467/1931 (24.2) | 542/2127 (25.5) | 0,95 (da 0,81 a 1,10) | 0.50 | 6 | 478/865 (55.3) | 481/950 (50.6) | 0,81 (0,66 a 1,01) | 0.06 | |||
| ≥50 | 7 | 527/855 (61.6) | 555/887 (62.6) | 1,03 (0,83 a 1,28) | 0.81 | 4 | 103/253 (40.7) | 106/309 (34.3) | 0,85 (0,58 a 1,24) | 0.39 | |||
| Età (anni): | |||||||||||||
| ≤1 | 2 | 321/1634 (19.6) | 322/1637 (19.7) | 0,99 (0,83 a 1,19) | 0.93 | 0.72 | 2 | 511/1110 (46.0) | 532/1190 (44.7) | 0,91 (da 0,77 a 1,08) | 0.30 | 0.37 | |
| 1.1-15.9 | 1 | 50/100 (50.0) | 35/93 (37.6) | 0,62 (0,35 a 1,11) | 0.11 | 7 | 191/413 (46.2) | 159/473 (33.6) | 0,59 (0,45 a 0,79) | <0.001 | |||
| 16-65 | 8 | 432/678 (63.7) | 466/716 (65.1) | 1,15 (da 0,90 a 1,48) | 0.27 | 9 | 422/781 (54.0) | 419/876 (47.8) | 0,79 (0,63 a 0,99) | 0.04 | |||
| >65 | 8 | 191/374 (51.1) | 274/568 (48.2) | 0,85 (0,65 a 1,12) | 0.25 | 3 | 86/135 (63.7) | 96/155 (61.9) | 0,88 (da 0,52 a 1,52) | 0.66 | |||
| Indice di massa corporea (kg/m2): | |||||||||||||
| <25 | 8 | 215/372 (57.8) | 231/417 (55.4) | 1,01 (0,72 a 1,40) | 0.97 | 0.70 | 11 | 757/1571 (48.2) | 725/1657 (43.8) | 0,82 (da 0,71 a 0,95) | 0.009 | >0.99 | |
| ≥25 | 8 | 406/677 (60.0) | 509/867 (58.7) | 1,00 (da 0,80 a 1,25) | 0.98 | 9 | 253/358 (70.7) | 245/367 (66.8) | 0,83 (da 0,59 a 1,17) | 0.30 | |||
| Asma: | |||||||||||||
| No | 5 | 303/484 (62.6) | 323/523 (61.8) | 0,95 (da 0,71 a 1,28) | 0.75 | 0.40 | 6 | 215/524 (41.0) | 197/578 (34.1) | 0,74 (0,58 a 0,95) | 0.02 | 0.40 | |
| Sì | 4 | 224/371 (60.4) | 232/364 (63.7) | 1,18 (0,85 a 1,65) | 0.32 | 7 | 72/163 (44.2) | 53/178 (29.8) | 0,60 (0,37 a 0,98) | 0.04 | |||
| COPD: | |||||||||||||
| No | 5 | 410/632 (64.9) | 436/656 (66.5) | –‡ | –‡ | –‡ | 2 | 67/131 (51.1) | 57/135 (42.2) | –‡ | –‡ | –‡ | |
| Sì | 4 | 117/223 (52.5) | 119/231 (51.5) | –‡ | –‡ | –‡ | 2 | 5/7 (71.4) | 1/7 (14.3) | –‡ | –‡ | –‡ | |
| Vaccinazione antinfluenzale | |||||||||||||
| No | 5 | 119/163 (73.0) | 121/178 (68.0) | –‡ | –‡ | –‡ | 5 | 136/210 (64.8) | 132/229 (57.6) | –‡ | –‡ | –‡ | |
| Sì | 5 | 286/396 (72.2) | 294/421 (69.8) | . | . | . | 5 | 278/383 (72.6) | 283/405 (69.9) | ||||
Risultati secondari
Efficacia
La tabella 4 presenta i risultati della meta-analisi dell’IPD in un unico passaggio dei risultati secondari. Quando tutti gli studi sono stati analizzati insieme, non si è visto alcun effetto statisticamente significativo della vitamina D sulla percentuale di partecipanti con almeno un’infezione delle vie respiratorie superiori, un’infezione delle vie respiratorie inferiori, un ricovero in ospedale o la partecipazione al pronto soccorso per un’infezione acuta delle vie respiratorie, un corso di antimicrobici per un’infezione acuta delle vie respiratorie, o l’assenza dal lavoro o dalla scuola a causa di un’infezione acuta delle vie respiratorie. Tuttavia, quando questa analisi è stata stratificata in base alla frequenza di dosaggio, è stato osservato un effetto protettivo statisticamente significativo dell’integrazione giornaliera o settimanale di vitamina D contro l’infezione delle vie respiratorie superiori (odds ratio corretto 0,88, 0,78 a 1,00; 4483 partecipanti a 11 studi, P=0,05; tabella 5).
| Risultati | N. di prove | Proporzione con evento ≥1 | Quota corretta (95% CI)* | Valore P | |
|---|---|---|---|---|---|
| Gruppo di controllo (%) | Gruppo d’intervento (%) | ||||
| Infezione delle vie respiratorie superiori | 19 | 1656/3286 (50.4) | 1807/3733 (48.4) | 0,93 (da 0,83 a 1,03) | 0.15 |
| Infezione delle vie respiratorie inferiori | 9 | 542/3285 (16.5) | 561/3413 (16.4) | 0,96 (0,83 a 1,10) | 0.52 |
| Ricovero in ospedale o assistenza al pronto soccorso a causa dell’ARTI | 11 | 47/3886 (1.2) | 40/3986 (1.0) | 0,83 (0,54 a 1,27) | 0.39 |
| Uso di antimicrobici per il trattamento dell’ARTI | 9 | 397/983 (40.4) | 413/1121 (36.8) | 0,84 (0,69 a 1,03) | 0.10 |
| Assenza al lavoro o alla scuola a causa di ARTI | 7 | 321/632 (50.8) | 319/684 (46.6) | 0,87 (da 0,69 a 1,09) | 0.22 |
| Grave evento avverso di qualsiasi causa | 25 | 216/5371 (4.0) | 221/5853 (3.8) | 0,98 (0,80 a 1,20) | 0.83 |
| Morte per ARTI o insufficienza respiratoria | 25 | 7/5330 (0.1) | 6/5802 (0.1) | 0,70 (0,23 a 2,20) | 0.55 |
| Morte per qualsiasi infezione | 25 | 15/5338 (0.3) | 16/5812 (0.3) | 0,95 (0,46 a 1,99) | 0.90 |
| Morte per qualsiasi causa | 25 | 48/5371 (0.9) | 56/5853 (1.0) | 1,39 (da 0,85 a 2,27) | 0.18 |
| Ipercalcemia | 14 | 9/1739 (0.5) | 12/2111 (0.6) | –† | –† |
| Pietre renali | 14 | 4/1707 (0.2) | 2/2134 (0.1) | –† | –† |
| Risultati | Dosaggio del bolo | Dosaggio giornaliero o settimanale | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N. di prove | Proporzione con evento ≥1, gruppo di controllo (%) | Proporzione con evento ≥1, gruppo di intervento (%) | Quota corretta (95% CI)* | Valore P | N. di prove | Proporzione con evento ≥1, gruppo di controllo (%) | Proporzione con evento ≥1, gruppo di intervento (%) | Quota corretta (95% CI)* | Valore P | ||
| Infezione delle vie respiratorie superiori | 8 | 606/1052 (57.6) | 730/1284 (56.9) | 1,03 (0,86 a 1,24) | 0.72 | 11 | 1050/2234 (47.0) | 1077/2449 (44.0) | 0,88 (0,78 a 1,00) | 0.05 | |
| Infezione delle vie respiratorie inferiori | 4 | 424/1889 (22.4) | 427/1922 (22.2) | 0,96 (da 0,82 a 1,13) | 0.60 | 5 | 118/1396 (8.5) | 134/1491 (9.0) | 0,98 (da 0,75 a 1,28) | 0.88 | |
| Uso di antimicrobici per il trattamento dell’ARTI | 4 | 201/348 (57.8) | 203/367 (55.3) | 0,79 (0,56 a 1,10) | 0.16 | 5 | 196/635 (30.9) | 210/754 (27.9) | 0,87 (da 0,67 a 1,13) | 0.31 | |
| Assenze dal lavoro o dalla scuola a causa di ARTI | 4 | 219/409 (53.5) | 196/411 (47.7) | 0,78 (0,59 a 1,04) | 0.10 | 3 | 102/223 (45.7) | 123/273 (45.1) | 1,03 (0,71 a 1,48) | 0.88 | |
| Grave evento avverso di qualsiasi causa | 10 | 107/2822 (3.8) | 115/3070 (3.7) | 1,00 (0,74 a 1,35) | 0.99 | 15 | 109/2549 (4.3) | 106/2783 (3.8) | 0,97 (0,73 a 1,30) | 0.86 | |
| Morte per qualsiasi causa | 10 | 29/2822 (1.0) | 35/3070 (1.1) | 1,29 (da 0,71 a 2,35) | 0.40 | 15 | 19/2549 (0.7) | 21/2783 (0.8) | –† | –† | |
| Morte per ARTI o insufficienza respiratoria | 10 | 4/2797 (0.1) | 3/3038 (0.1) | 0,61 (0,12 a 3,02) | 0.54 | 15 | 3/2533 (0.1) | 3/2765 (0.1) | –† | –† | |
| Morte dovuta a qualsiasi infezione | 10 | 8/2801 (0.3) | 5/3040 (0.2) | 0,55 (0,17 a 1,80) | 0.32 | 15 | 7/2537 (0.3) | 11/2773 (0.4) | –† | –† | |
| Ricovero in ospedale o assistenza al pronto soccorso a causa dell’ARTI | 6 | 4/2081 (0.2) | 6/2124 (0.3) | –† | –† | 5 | 43/1805 (2.4) | 34/1862 (1.8) | –† | –† | |
| Ipercalcemia | 8 | 8/1062 (0.8) | 11/1303 (0.8) | –† | –† | 6 | 1/677 (0.1) | 1/808 (0.1) | –† | –† | |
| Pietre renali | 6 | 0/764 (0.0) | 1/1011 (0.1) | –† | –† | 8 | 4/943 (0.4) | 1/1123 (0.1) | –† | –† | |
Sicurezza
L’uso della vitamina D non ha influenzato il rischio di gravi eventi avversi di qualsiasi causa (odds ratio corretto 0,98, 0,80 a 1,20; 11-224 partecipanti a 25 studi) o di morte per qualsiasi causa (1,39, 0,85 a 2,27; 11-224 partecipanti a 25 studi) (tabella 4). I casi di potenziali reazioni avverse alla vitamina D sono stati rari. L’ipercalcemia è stata rilevata nel 21/3850 (0,5%) e i calcoli renali sono stati diagnosticati nel 6/3841 (0,2%); entrambi gli eventi sono stati rappresentati in modo uniforme tra l’intervento e i bracci di controllo (tabella 4). La stratificazione di questa analisi per frequenza di dosaggio non ha rivelato alcun aumento statisticamente significativo del rischio di eventi avversi con il dosaggio in bolo o con l’integrazione giornaliera o settimanale (tabella 5).
Rischio di distorsioni tra gli studi
Un grafico ad imbuto per la percentuale di partecipanti che hanno avuto almeno un’infezione acuta delle vie respiratorie ha mostrato un certo grado di asimmetria, aumentando la possibilità che piccoli studi che mostravano effetti avversi della vitamina D potrebbero non essere stati inclusi nella meta-analisi (vedi figura supplementare S5).
Analisi del rispondente
La tabella supplementare S7 presenta i risultati delle analisi dei risponditori. Tra i partecipanti randomizzati al braccio di intervento di studi inclusi per i quali erano disponibili dati di fine studio su 25-idrossivitamina D, non è stata osservata alcuna differenza di rischio di infezione acuta delle vie respiratorie tra coloro che hanno raggiunto una concentrazione sierica di 75 o più nmol/L rispetto a coloro che non lo hanno fatto.
Analisi della sensibilità
La meta-analisi IPD della percentuale di partecipanti che hanno avuto almeno un’infezione acuta delle vie respiratorie, escludendo due studi valutati come a rischio non chiaro di polarizzazione,3637 ha rivelato effetti protettivi dell’integrazione di vitamina D coerenti con l’analisi principale (odds ratio corretto 0,82, 0,70 a 0,95, 10-744 partecipanti, P=0,01). L’analisi di sensibilità per lo stesso risultato, limitato ai 14 studi che hanno studiato l’infezione acuta delle vie respiratorie come risultato primario o coprimario, ha anche rivelato effetti protettivi dell’integrazione di vitamina D coerenti con l’analisi principale (0,82, 0,68 a 1,00, 5739 partecipanti, P=0,05).
Discussione
In questa meta-analisi dei dati dei singoli partecipanti (IPD) di studi randomizzati controllati, l’integrazione di vitamina D ha ridotto il rischio di contrarre almeno un’infezione acuta delle vie respiratorie. L’analisi dei sottogruppi ha rivelato che l’integrazione giornaliera o settimanale di vitamina D senza dosi aggiuntive di bolo proteggeva dall’infezione acuta delle vie respiratorie, mentre i regimi contenenti grandi dosi di bolo non lo facevano. Tra coloro che ricevono quotidianamente o settimanalmente la vitamina D, gli effetti protettivi sono stati più forti in quelli con una profonda carenza di vitamina D al basale, anche se quelli con concentrazioni di base più elevate di 25-idrossivitamina D hanno anche sperimentato un beneficio. Questa prova è stata valutata come di alta qualità, utilizzando i criteri di GRADO. 34 Poiché lo stato della vitamina D al basale e l’uso di dosi in bolo variava considerevolmente tra uno studio e l’altro, i nostri risultati suggeriscono che l’elevato grado di eterogeneità tra gli studi può essere almeno in parte attribuibile a questi fattori. L’uso della vitamina D era sicuro: le potenziali reazioni avverse erano rare e il rischio di tali eventi era lo stesso tra i partecipanti randomizzati alle braccia di intervento e di controllo.
Perché l’uso di dosi di vitamina D in bolo potrebbe essere inefficace per la prevenzione delle infezioni acute delle vie respiratorie? Una spiegazione si riferisce agli effetti potenzialmente negativi delle ampie fluttuazioni delle concentrazioni di 25-idrossivitamina D in circolazione, che si vedono dopo l’uso di dosi di bolo ma non con un’integrazione giornaliera o settimanale. Vieth ha proposto che alte concentrazioni circolanti dopo il dosaggio in bolo possono disregolare cronicamente l’attività degli enzimi responsabili della sintesi e della degradazione del metabolita attivo della vitamina D 1,25-diidrossitamina D, con conseguente diminuzione delle concentrazioni di questo metabolita nei tessuti extrarenali. 38 Un tale effetto potrebbe attenuare la capacità della 25-idrossitamina D di sostenere le risposte immunitarie protettive agli agenti patogeni respiratori. Una maggiore efficacia dell’integrazione di vitamina D in coloro che hanno uno stato basale di vitamina D inferiore è più facilmente spiegabile, in base al principio che le persone che sono le più carenti di un micronutriente saranno le più propense a rispondere alla sua sostituzione.
Punti di forza e limiti di questo studio
Il nostro studio ha diversi punti di forza. Abbiamo ottenuto l’IPD per tutti i 25 studi identificati dalla nostra ricerca; la percentuale di partecipanti randomizzati con dati di esito mancanti era piccola (3,4%); sono stati rappresentati partecipanti con caratteristiche diverse in contesti multipli; e sono stati misurati 25 livelli di idrossitamina D con saggi convalidati in laboratori che hanno partecipato a schemi esterni di valutazione della qualità. I nostri risultati hanno quindi un alto grado di validità interna ed esterna. Inoltre, gli effetti del sottogruppo che riportiamo soddisfano i “criteri di credibilità” pubblicati relativi alla progettazione dello studio, all’analisi e al contesto. 39 In particolare, i modificatori di effetto rilevanti sono stati specificati a priori e misurati alla linea di base, i valori P per l’interazione sono rimasti significativi dopo l’aggiustamento per i potenziali confonditori, e gli effetti del sottogruppo sono stati coerenti quando sono stati analizzati come proporzioni e tassi di evento. L’analisi di sopravvivenza ha rivelato tendenze coerenti che non hanno raggiunto una significatività statistica, probabilmente a causa della mancanza di potenza (meno studi hanno fornito dati alle analisi di sopravvivenza rispetto alle analisi delle proporzioni e dei tassi di evento). I concetti che l’integrazione di vitamina D può essere più efficace se somministrata a coloro che hanno livelli di base più bassi di 25-idrossivitamina D e meno efficace quando vengono somministrate dosi in bolo, sono anche biologicamente plausibili. Una recente revisione Cochrane di studi controllati randomizzati che hanno riportato che l’integrazione di vitamina D riduce il rischio di gravi esacerbazioni dell’asma, che sono comunemente precipitate da infezioni virali del tratto respiratorio superiore, aggiunge ulteriore peso al caso per la plausibilità biologica. 40 Sebbene i risultati siano coerenti con l’ipotesi che lo stato di base della vitamina D e il regime di dosaggio modificano in modo indipendente gli effetti dell’integrazione di vitamina D, non possiamo escludere la possibile influenza di altri modificatori di effetti legati a questi due fattori. Il rischio di confusione residua da parte di altri modificatori d’effetto è aumentato per le analisi in cui relativamente pochi studi sono rappresentati all’interno di un sottogruppo, ad esempio, dove le analisi dei sottogruppi sono state stratificate dal regime di dosaggio. Si consiglia quindi cautela nell’interpretare i risultati della tabella 3.
Il nostro studio ha alcuni limiti. Una spiegazione per il grado di asimmetria visto nella trama ad imbuto è che alcuni piccoli studi che mostrano effetti negativi della vitamina D potrebbero essere sfuggiti alla nostra attenzione. Per quanto riguarda il potenziale di dati mancanti, ci siamo impegnati a fondo per identificare i dati pubblicati e (all’epoca) quelli non pubblicati, come dimostra il fatto che la nostra meta-analisi include i dati di 25 studi-10 in più rispetto alla più grande meta-analisi aggregata di dati sull’argomento. 13 Tuttavia, se dovessero emergere uno o due piccoli studi che mostrano grandi effetti avversi della vitamina D, non prevediamo che essi altererebbero notevolmente i risultati della meta-analisi IPD in un solo passo, poiché qualsiasi segnale negativo proveniente da un modesto numero di partecipanti aggiuntivi verrebbe probabilmente diluito dal robusto segnale protettivo generato dall’analisi dei dati di quasi 11.000 partecipanti. Una seconda limitazione è che il nostro potere di rilevare gli effetti dell’integrazione di vitamina D è stato limitato per alcuni sottogruppi (ad esempio, gli individui con concentrazioni di base di 25-idrossivitamina D <25 nmol/L che ricevono regimi di dosaggio in bolo) e per alcuni esiti secondari (ad esempio, l’incidenza di infezione delle vie respiratorie inferiori). Risultati statisticamente significativi per l’analisi di questi esiti possono essere risultati nulli e borderline come conseguenza di un errore di tipo 2. Sono in corso ulteriori studi randomizzati controllati che indagano gli effetti della vitamina D sul rischio di infezione acuta delle vie respiratorie e l’inclusione dei dati di questi studi in future meta-analisi ha il potenziale di aumentare la potenza statistica per testare gli effetti dei sottogruppi. Tuttavia, tutti e tre i più grandi studi di questo tipo (NCT01169259, ACTRN12611000402943, e ACTRN12613000743763) vengono condotti in popolazioni in cui la carenza profonda di vitamina D è rara e due utilizzano regimi di dosaggio in bolo intermittente: è quindi improbabile che i risultati possano alterare la nostra scoperta di benefici in persone che sono molto carenti di vitamina D o che ricevono un’integrazione giornaliera o settimanale. Un terzo potenziale limite è che i dati relativi all’adesione ai farmaci di studio non erano disponibili per tutti i partecipanti. Tuttavia, l’inclusione di partecipanti che non aderiscono all’analisi influenzerebbe i risultati della nostra intenzione di trattare l’analisi verso la nullità: pertanto, concludiamo che gli effetti della vitamina D in coloro che aderiscono pienamente all’integrazione non saranno inferiori a quelli riportati per la popolazione dello studio nel suo complesso. Infine, avvertiamo che le definizioni dello studio di infezione acuta delle vie respiratorie erano diverse, e la conferma virologica, microbiologica o radiologica è stata ottenuta per la minoranza degli eventi. L’infezione acuta delle vie respiratorie è spesso una diagnosi clinica nella pratica, tuttavia, e poiché tutti gli studi sono stati condotti in doppio cieco e controllati con placebo, le differenze di incidenza degli eventi tra i bracci dello studio non possono essere attribuite a distorsioni di osservazione.
Conclusioni e implicazioni politiche
Il nostro studio riporta una nuova importante indicazione per l’integrazione di vitamina D: la prevenzione delle infezioni acute delle vie respiratorie. Dimostriamo anche che le persone che sono molto carenti di vitamina D e quelle che ricevono un’integrazione giornaliera o settimanale senza dosi aggiuntive di bolo ne traggono particolare beneficio. I nostri risultati si aggiungono al corpus di prove a sostegno dell’introduzione di misure di salute pubblica come il rafforzamento alimentare per migliorare lo stato della vitamina D, in particolare in ambienti in cui è comune una profonda carenza di vitamina D.
Ciò che è già noto su questo argomento
- Prove controllate randomizzate di integrazione di vitamina D per la prevenzione delle infezioni acute delle vie respiratorie hanno dato risultati contraddittori
- La meta-analisi dei dati dei singoli partecipanti (IPD) ha il potenziale di identificare i fattori che possono spiegare questa eterogeneità, ma non è stata effettuata in precedenza.
Cosa aggiunge questo studio
- La meta-analisi dell’IPD di 10 933 partecipanti a 25 studi randomizzati controllati ha mostrato un effetto protettivo complessivo dell’integrazione di vitamina D contro le infezioni acute delle vie respiratorie (numero necessario per il trattamento (NNT)=33)
- Il beneficio è stato maggiore in coloro che hanno ricevuto giornalmente o settimanalmente la vitamina D senza dosi aggiuntive di bolo (NNT=20), e gli effetti protettivi contro le infezioni acute delle vie respiratorie in questo gruppo sono stati più forti in quelli con una profonda carenza di vitamina D al basale (NNT=4)
- Questi risultati supportano l’introduzione di misure di salute pubblica come il rafforzamento alimentare per migliorare lo stato della vitamina D, in particolare in ambienti in cui è comune una profonda carenza di vitamina D
References
- JAMA. 2009; 302:758-66. Publisher Full Text | DOI | PubMed
- Lancet. 2015; 385:117-71. Publisher Full Text | DOI | PubMed
- Epidemiol Infect. 2006; 134:1129-40. Publisher Full Text | DOI | PubMed
- J Steroid Biochem Mol Biol. 2013; 136:321-9. Publisher Full Text | DOI | PubMed
- J Immunol. 2008; 181:7090-9. Publisher Full Text | DOI | PubMed
- J Infect Dis. 2013; 208:1474-81. Publisher Full Text | DOI | PubMed
- Nutrients. 2015; 7:4240-70. Publisher Full Text | DOI | PubMed
- Nat Rev Endocrinol. 2011; 7:337-45. Publisher Full Text | DOI | PubMed
- PLoS One. 2013; 8:e65835. Publisher Full Text | DOI | PubMed
- J Pharmacol Pharmacother. 2012; 3:300-3. Publisher Full Text | DOI | PubMed
- Scand J Infect Dis. 2013; 45:696-702. Publisher Full Text | DOI | PubMed
- Br J Nutr. 2015; 114:1026-34. Publisher Full Text | DOI | PubMed
- PLoS One. 2016; 11:e0162996. Publisher Full Text | DOI | PubMed
- Lancet. 2012; 379:1373-5. Publisher Full Text | DOI | PubMed
- Ann Intern Med. 2012; 156:105-14. Publisher Full Text | DOI | PubMed
- Lancet Respir Med. 2015; 3:120-30. Publisher Full Text | DOI | PubMed
- PLoS One. 2015; 10:e0117123. Publisher Full Text | DOI | PubMed
- J Clin Endocrinol Metab. 2014; 99:E1332-40. Publisher Full Text | DOI | PubMed
- JAMA. 2010; 303:1815-22. Publisher Full Text | DOI | PubMed
- BMJ. 2010; 340:c221. Publisher Full Text | DOI | PubMed
- Pediatrics. 2012; 130:e561-7. Publisher Full Text | DOI | PubMed
- JAMA. 2012; 308:1333-9. Publisher Full Text | DOI | PubMed
- Clin Infect Dis. 2013; 57:1384-92. Publisher Full Text | DOI | PubMed
- Allergy. 2016; 71:1001-9. Publisher Full Text | DOI | PubMed
- Am J Clin Nutr. 2014; 99:156-61. Publisher Full Text | DOI | PubMed
- Food Funct. 2014; 5:2365-70. Publisher Full Text | DOI | PubMed
- Am J Clin Nutr. 2010; 91:1255-60. Publisher Full Text | DOI | PubMed
- BMJ. 2011; 343:d5928. Publisher Full Text | DOI | PubMed
- Lancet Diabetes Endocrinol. 2016; 4:376-7. Publisher Full Text | DOI | PubMed
- Arch Intern Med. 2009; 169:384-90. Publisher Full Text | DOI | PubMed
- PLoS One. 2010; 5:e11088. Publisher Full Text | DOI | PubMed
- J Clin Epidemiol. 2008; 61:991-6. Publisher Full Text | DOI | PubMed
- BMJ. 2008; 336:924-6. Publisher Full Text | DOI | PubMed
- Lancet. 2012; 379:1419-27. Publisher Full Text | DOI | PubMed
- Pediatr Exerc Sci. 2015; 27:113-9. Publisher Full Text | DOI | PubMed
- J Infect Dis. 2010; 202:809-14. Publisher Full Text | DOI | PubMed
- Anticancer Res. 2009; 29:3675-84. Publisher Full Text | PubMed
- BMJ. 2010; 340:c117. Publisher Full Text | DOI | PubMed
- Cochrane Database Syst Rev. 2016; 9:CD011511. Publisher Full Text | PubMed
- Epidemiol Infect. 2009; 137:1396-404. Publisher Full Text | DOI | PubMed
- Trop Med Int Health. 2010; 15:1148-55. Publisher Full Text | DOI | PubMed
- J Allergy Clin Immunol. 2011; 127:1294-6. Publisher Full Text | DOI | PubMed
- BMJ. 2011; 342:d2975. Publisher Full Text | DOI | PubMed
- BMJ Open. 2012; 2:e001663. Publisher Full Text | DOI
- Pediatr Infect Dis J. 2013; 32:1055-60. Publisher Full Text | DOI | PubMed
- BMC Infect Dis. 2014; 14:273. Publisher Full Text | DOI | PubMed
- Acta Paediatr. 2015; 104:396-404. Publisher Full Text | DOI | PubMed
- Thorax. 2015; 70:451-7. Publisher Full Text | DOI | PubMed
- Thorax. 2015; 70:953-60. Publisher Full Text | DOI | PubMed
- BMC Nutr. 2015; 1
- Am J Respir Crit Care Med. 2016; 193:634-41. Publisher Full Text | DOI | PubMed
- J Am Geriatr Soc. 2016. Publisher Full Text | DOI
Fonte
Martineau AR, Jolliffe DA, Hooper RL, Greenberg L, Aloia JF, et al. (2017) Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. The BMJ 356i6583. https://doi.org/10.1136/bmj.i6583





