Abstract
Introduzione
La causa della perdita di memoria nella malattia di Alzheimer rimane un’importante incognita che ha un impatto negativo sullo sviluppo della terapia (DeStrooper e Karran, 2016). L’amiloide Aß che si accumula nel cervello umano riduce la funzione sinaptica eccitatoria (Shankaret al., 2008) e i modelli murini di amiloidosi di Aß documentano che Aß provoca indebolimento e perdita di sinapsi eccitatorie (Kamenetz et al., 2003; Um et al., 2013 ). Aß aumenta anche l’eccitabilità dei neuroni piramidali a seguito della riduzione della regolazione del canale ionico Nav1.1, sensibile alla tensione, nei interneuroni inibitori del fotovoltaico (Verretet al., 2012). Tuttavia, gli studi umani indicano che l’accumulo di amiloide precede tipicamente il fallimento cognitivo di molti anni(Jack e Holtzman, 2013). Inoltre, i casi studio riportano pazienti che erano cognitivamente normali alla morte ma che mostrano una placca di Aß pronunciata e grovigli neurofibrillari coerenti con l’AD (Driscolle Troncoso, 2011). I modelli topici di amiloidosi di Aß mostrano un miglioramento cognitivo in seguito all’inibizione degli enzimi che generano Aß o alle terapie di riduzione dell’amiloide (Comery etal., 2005; Kimura et al., 2010; Townsend et al., 2010), ma successi simili non sono stati riportati in studi sull’uomo. Questa discrepanza evidenzia la necessità di una maggiore comprensione del fallimento cognitivo nell’AD umano.
Abbiamo concentrato l’attenzione su campioni di cervello umano e di liquido cerebrospinale accuratamente archiviati per valutare i meccanismi importanti per le funzioni cognitive in AD. Estendendoci alle osservazioni dell’attività cerebrale alterata e al suo possibile contributo alla progressione dell’AD nell’uomo(Buckner et al., 2009, Buckner et al., 2005) abbiamo analizzato le proteine della classe dei geni primitivi immediati cellulari (IEG), che mediano la plasticità dipendente dall’attività, importante per la funzione della memoria, e possono essere analizzate nel tessuto umano post-mortem(Wu et al., 2011). Qui, si segnala che la pentraxina neuronale 2 (NPTX2; anche chiamato Narp e NP2) è down-regolato nel cervello di soggetti umani con malattia di Alzheimer (AD). NPTX2 è un membro di una famiglia di pentrassine neuronali ‘lungo’ che comprende la pentrassina neuronale 1 (NPTX1) e recettore della pentrassina neuronale (NPTXR). NPTX1, NPTX2 e NPTXR formano complessi NPTX misti e non solforati, collegati tra loro, che trafficano verso la superficie extracellulare in sinapsi eccitatorie(Xu et al., 2003) dove legano i recettori del glutammato di tipo AMPA e contribuiscono a forme multiple di plasticità sinaptica evolutiva e adulta(Chang et al., 2010; Cho et al., 2008; Gu et al., 2013; Lee et al., 2017; O’Brien et al., 2002, 1999; Pelkey et al., 2015, 2016). Le NPTX legano direttamente i recettori del glutammato di tipo AMPA e possono agire in ‘trans’ come fattori presinaptici che inducono sinapsi eccitatorie postsinaptiche (Lee et al., 2017; O’Brien et al ., 2002, 1999; Sia et al., 2007). NPTX2 espresso da neuroni piramidali e secreto da terminali assonali media in modo univoco il rafforzamento, dipendente dall’attività, delle sinapsi eccitatorie dei neuroni piramidali su GABAergic PV-interneurons(Chang et al., 2010). Questo rafforzamento adattativo della sinapsi neurone-PV interneuron piramidale media la scalatura omeostatica del circuito, un processo implicato nella capacità dei circuiti di codificare le informazioni(Turrigiano, 2012). Abbiamo esaminato la conseguenza della riduzione di NPTX2 in un modello murino di AD e abbiamo trovato che l’amiloidosi insieme a Nptx2-/-provoca una riduzione sinergica della funzione inibitoria del circuito in combinazione con una riduzione del recettore del glutammato di tipo AMPA GluA4. GluA4 è preferenzialmente espresso in PV-interneuroni a sinapsi eccitatorie dove è co-localizzato con NPTX2 (fonte presinaptica)(Chang et al., 2010) e conferisce inattivazione rapida canale(Angulo et al., 1997; Geiger et al., 1995) che è essenziale per il picco veloce e contributi di interneuroni PV alla ritmicità del circuito ippocampale e la memoria(Fuchs et al., 2007). La riduzione dipendente da Nptx2-/-di GluA4 è stata precedentemente descritta in un diverso modello di mouse(Nptx2-/-; Nptxr-/-) dove l’analisi ha suggerito che NTPX2 è necessario per legare e stabilizzare l’espressione postsinaptica di GluA4 negli interneuroni PV in condizioni di attività alterata(Pelkey et al., 2015, 2016). Nel cervello umano GluA4 è anche espresso selettivamente in PV-INs ed è ridotto nelle regioni cerebrali AD dove i livelli sono correlati all’interno dei campioni a NPTX2. Questo suggerisce che la riduzione di NPTX2 nel cervello umano AD è legata alla perturbazione dei circuiti neuronali piramidali-PV interneuron. Per valutare la relazione tra NPTX2 e la funzione cognitiva nei soggetti umani, abbiamo determinato che NPTX2 è presente nel liquor e i livelli sono rappresentativi del cervello NPTX2 poiché il liquor NPTX2 discrimina l’AD clinicamente definito rispetto ai controlli di età. È importante notare che i livelli di NPTX2 nei soggetti con AD sono correlati con le prestazioni cognitive, utilizzando test psicometrici completi, tra cui la Dementia Rating Scale, e hanno superato le prestazioni di altri marcatori del liquor, tra cui Aß42, tau e p-tau. I livelli di NPTX2 sono anche correlati con le misure di risonanza magnetica del volume dell’ippocampo, che è considerato un marker di neurodegenerazione ed è legato al declino cognitivo(Jack et al., 2010; Weiner et al., 2015). NPTX2 non è down-regolato in un modello di amiloidosi del topo ampiamente utilizzato ed è distinto da altri marcatori del liquor attribuito alla neurodegenerazione tra cui tau e p-tau in quanto NPTX2 è un indicatore di sinapsi eccitatorie specifiche piuttosto che generali. Gli studi sostengono l’ipotesi che NPTX2 down-regolazione NPTX2 risultati in interruzione dei circuiti piramidali neurone-PV interneuron che sono importanti per la ritmicità cerebrale e l’omeostasi di eccitabilità, e rappresenta un meccanismo precedentemente non riconosciuto importante per le disfunzioni cognitive umane e la progressione in AD.
Risultati
NPTX2 è ridotto nel cervello umano AD e sindrome di Down
La proteina NPTX2 è stata analizzata da western blot (WB) nel cervello umano da individui con patologicamente confermato l’insorgenza tardiva della malattia di Alzheimer (AD) rispetto ai controlli di età corrispondenti (Figura 1A e B, Figura 1-figure supplement 1 e Figura 1-source data 1). NPTX2 è stato ridotto in tutte le regioni corticali, comprese quelle aree che mostrano importanti cambiamenti neuropatologici classici in AD, così come le aree che sono in genere meno colpiti come la corteccia occipitale. Ippocampo non era disponibile per molti casi e non poteva essere sistematicamente esaminato. Riduzioni di NPTX2 erano evidenti se si fa riferimento a actina(Figura 1-figure supplemento 1A) o PSD95 (Figura 1B), quest’ultimo indica che NPTX2 down-regolazione è distinto da una riduzione generale di marcatori sinaptici eccitatori. Nptx2 mRNA è stato anche notevolmente ridotto nelle regioni saggiate(Figura 1C). Pentraxina neuronale 1 (NPTX1) e recettore della pentraxina neuronale (NPTXR) non sono stati ridotti negli stessi campioni cerebrali(Figura 1D ed E). Per valutare ulteriormente la specificità della down-regolazione NPTX2 abbiamo determinato che altre IEG tra cui Arc e Egr-1 non sono stati ridotti(Figura 1-figure supplement 1B). NPTX2 non è stato ridotto nel cervello di soggetti che erano cognitivamente normali alla morte, ma il cui cervello mostra la patologia tipica di AD tra cui la placca Aß e grovigli [AD asintomatico (ASYMAD) o preAD (Codispotiet al., 2012; Driscoll et al., 2006; Driscoll e Troncoso, 2011) (Figura 1F e G, e Figura 1 – dati fonte 1). Nptx2 proteina e mRNA sono stati ridotti anche nel giro mediano frontale della sindrome di Down (DS) soggetti di età compresa tra 19 y/o a 40 y/o rispetto ai controlli di età corrispondenti(Figura 1H a 1J e Figura 1-source dati 2). I soggetti affetti da DS presentano un alto rischio di AD dopo i 40 anni(Zigman e Lott, 2007). La proteina Nptx2 (normalizzata all’actina) e l’mRNA sono stati analogamente ridotti negli individui DS più anziani con AD(Figura 1-figure supplement 2 e Figura 1-source data 3).10.7554/eLife.23798.002Figure 1.NPTX2 livelli sono ridotti nel cervello umano post-mortem AD e DS, ma non nel cervello ASYMAD.(A,B,D e E) Immagini rappresentative western blot (A) e la quantificazione di NPTX2 (B), NPTX1(D) e NPTXR(E) normalizzato a PSD95 nella corteccia frontopolare (FPC), precuneus (PCU), giro occipitale (OCC), giro frontale medio (MFG), giro temporale medio (MTG) e giro parietale (PAR) da controlli e soggetti AD. NPTX2 è down-regolato in tutte le regioni cerebrali saggiate di individui AD. FPC: controllo, n = 7; AD, n = 8. PCU: controllo, n = 15; AD, n = 19. OCC: controllo, n = 7; AD, n = 7. MFG: controllo, n = 9; AD, n = 16. MTG: controllo, n = 10; AD, n = 18. PAR: controllo, n = 5; AD, n = 5.(C) Nptx2 mRNA è ridotto nel cervello di AD. FPC: controllo, n = 9; AD, n = 16. PCU: controllo, n = 7; AD, n = 6.(F,G) I saggi Western blot non rivelano alcun cambiamento significativo dell’espressione NPTX2 in MFG da soggetti con AD asintomatico (ASYMAD). Controllo, n = 8; ASYMAD, n = 10.(H, I) I Western blot test mostrano una riduzione significativa di NPTX2 nel MFG dei soggetti con sindrome di Down (DS). Controllo, n = 6; DS, n = 6.(J) Nptx2 mRNA è ridotto in MFG di individui con DS. Controllo, n = 5; DS, n = 5. *p<0.05, **p<0.01, ***p<0.001 con test t a due code. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.00210.7554/eLife.23798.003Figure1-source data 1.Informazioni cliniche e istopatologiche degli individui ASYMAD e AD per l’analisi del cervello.DOI:http://dx.doi.org/10.7554/eLife.23798.00310.7554/eLife.23798.004Figure1-source data 2.Informazioni di individui con sindrome di Down per l’analisi del cervello.DOI:http://dx.doi.org/10.7554/eLife.23798.00410.7554/eLife.23798.005Figure1-source data 3.Informazioni di individui con sindrome di Down e malattia di Alzheimer per l’analisi del cervello.DOI:http://dx.doi.org/10.7554/eLife.23798.00510.7554/eLife.23798.006FigureSupplemento a 1 cifra 1.Espressione genica precoce immediata nel cervello umano post-mortem AD. (A) I livelli NPTX2 sono ridotti nel cervello umano post-mortem AD. Quantificazione dei livelli NPTX2, NPTX1 e NPTXR nella figura 1A con actina come proteina di riferimento. NPTX2 è down-regolato in tutte le regioni cerebrali saggiate di individui AD quando si fa riferimento all’actina. Corteccia frontopolare (FPC): controllo, n = 7; AD, n = 8. Precuneus (PCU): controllo, n = 15; AD, n = 19. Giro occipitale (OCC): controllo, n = 7; AD, n = 7. Giro frontale centrale (MFG): controllo, n = 9; AD, n = 16. Giro temporale medio (MTG): controllo, n = 10; AD, n = 18. Giro pararietale (PAR): controllo, n = 5; AD, n = 5.(B) Egr1 e l’espressione Arco in diverse regioni cerebrali di controllo e soggetti AD. Macchie occidentali mostrano che l’espressione di Egr1 e Arc non sono significativamente alterati nella maggior parte delle aree cerebrali testate da individui AD. FPC: controllo, n = 7; AD, n = 8. PCU: controllo, n = 15; AD, n = 19. OCC: controllo, n = 7; AD, n = 7. MFG: controllo, n = 9; AD, n = 16. MTG: controllo, n = 10; AD, n = 18. PAR: controllo, n = 5; AD, n = 5. *p<0.05, **p<0.01, ***p<0.001 da test t a due code. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.00610.7554/eLife.23798.007FigureI livelli di supplemento a 1 cifra 2.NPTX2 sono ridotti nel cervello umano post-mortem DS-AD.(A) I test Western blot test mostrano una riduzione NPTX2 nel giro frontale superiore (SFG) di individui con sindrome di Down e malattia di Alzheimer (DS-AD). Controllo, n = 8; DS-AD, n = 12.(B) Nptx2 mRNA è ridotto in SFG di individui con DS-AD. Controllo, n = 8; DS-AD, n = 12. *p<0,05, con test t a due code. I dati rappresentano la media ± SEM. Vedere le informazioni sui pazienti nella Figura 1 – dati fonte 3.DOI:http://dx.doi.org/10.7554/eLife.23798.007
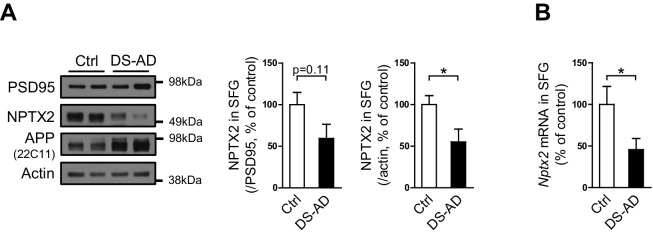
Figura 1-figure supplement 2.I livelli di NPTX2 sono ridotti nel cervello umano post-mortem AD e DS, ma non nel cervello ASYMAD.informazioni cliniche e istopatologiche di ASYMAD e AD per l’analisi del cervello.informazioni di individui con sindrome di Down per l’analisi del cervello.informazioni di individui con sindrome di Down e malattia di Alzheimer per l’analisi del cervello.Informazioni cliniche e istopatologiche di ASYMAD e AD per l’analisi del cervello.informazioni di individui con sindrome di Down per l’analisi del cervello.informazioni di individui con sindrome di Down e malattia di Alzheimer per l’analisi del cervello.espressione genica precoce immediata nel cervello umano post-mortem AD.i livelli NPTX2 sono ridotti nel cervello umano post-mortem DS-AD.(A, B, D e E) immagini rappresentative macchia occidentale(A) e la quantificazione di NPTX2 (B), NPTX1(D) e NPTXR(E) normalizzato a PSD95 nella corteccia frontopolare (FPC), precuneus (PCU), giro occipitale (OCC), giro frontale medio (MFG), giro temporale medio (MTG) e giro parietale (PAR) da controlli e soggetti AD. NPTX2 è down-regolato in tutte le regioni cerebrali saggiate di individui AD. FPC: controllo, n = 7; AD, n = 8. PCU: controllo, n = 15; AD, n = 19. OCC: controllo, n = 7; AD, n = 7. MFG: controllo, n = 9; AD, n = 16. MTG: controllo, n = 10; AD, n = 18. PAR: controllo, n = 5; AD, n = 5.(C) Nptx2 mRNA è ridotto nel cervello di AD. FPC: controllo, n = 9; AD, n = 16. PCU: controllo, n = 7; AD, n = 6.(F,G) I saggi Western blot non rivelano alcun cambiamento significativo dell’espressione NPTX2 in MFG da soggetti con AD asintomatico (ASYMAD). Controllo, n = 8; ASYMAD, n = 10.(H, I) I Western blot test mostrano una riduzione significativa di NPTX2 nel MFG dei soggetti con sindrome di Down (DS). Controllo, n = 6; DS, n = 6.(J) Nptx2 mRNA è ridotto in MFG di individui con DS. Controllo, n = 5; DS, n = 5. *p<0.05, **p<0.01, ***p<0.001 con test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.00210.7554/eLife.23798.003Cifre 1-source data 1.Informazioni cliniche e istopatologiche di ASYMAD e individui AD per l’analisi del cervello.DOI:http://dx.doi.org/10.7554/eLife.23798.003DOI:
http://dx.doi.org/10.7554/eLife.23798.00310.7554/eLife.23798.004Figure 1-source data 2.Information of individuals with Down syndrome for brain analysis.DOI:http://dx.doi.org/10.7554/eLife.23798.004DOI:
http://dx.doi.org/10.7554/eLife.23798.00410.7554/eLife.23798.005Figure 1-source data 3.Information of individuals with Down syndrome and Alzheimer’s disease for brain analysis.DOI:http://dx.doi.org/10.7554/eLife.23798.005DOI:
http://dx.doi.org/10.7554/eLife.23798.005DOI:
http://dx.doi.org/10.7554/eLife.23798.003DOI:
http://dx.doi.org/10.7554/eLife.23798.004DOI:
http://dx.doi.org/10.7554/eLife.23798.005(A) I livelli di NPTX2 sono ridotti nel cervello umano post mortem AD. Quantificazione dei livelli NPTX2, NPTX1 e NPTXR nella Figura 1A con actina come proteina di riferimento. NPTX2 è down-regolato in tutte le regioni cerebrali saggiate di individui AD quando si fa riferimento all’actina. Corteccia frontopolare (FPC): controllo, n = 7; AD, n = 8. Precuneus (PCU): controllo, n = 15; AD, n = 19. Giro occipitale (OCC): controllo, n = 7; AD, n = 7. Giro frontale centrale (MFG): controllo, n = 9; AD, n = 16. Giro temporale medio (MTG): controllo, n = 10; AD, n = 18. Giro pararietale (PAR): controllo, n = 5; AD, n = 5.(B) Egr1 e l’espressione Arco in diverse regioni cerebrali di controllo e soggetti AD. Macchie occidentali mostrano che l’espressione di Egr1 e Arc non sono significativamente alterati nella maggior parte delle aree cerebrali testate da individui AD. FPC: controllo, n = 7; AD, n = 8. PCU: controllo, n = 15; AD, n = 19. OCC: controllo, n = 7; AD, n = 7. MFG: controllo, n = 9; AD, n = 16. MTG: controllo, n = 10; AD, n = 18. PAR: controllo, n = 5; AD, n = 5. *p<0.05, **p<0.01, ***p<0.001 da test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.006(A) I saggi Western blot test mostrano un down-regolazione NPTX2 nel giro frontale superiore (SFG) di individui con sindrome di Down e malattia di Alzheimer (DS-AD). Controllo, n = 8; DS-AD, n = 12.(B) Nptx2 mRNA è ridotto in SFG di individui con DS-AD. Controllo, n = 8; DS-AD, n = 12. *p<0,05, con test t a due code. I dati rappresentano la media ± SEM. Vedere le informazioni sui pazienti nella Figura 1 – dati fonte 3.DOI:
http://dx.doi.org/10.7554/eLife.23798.007
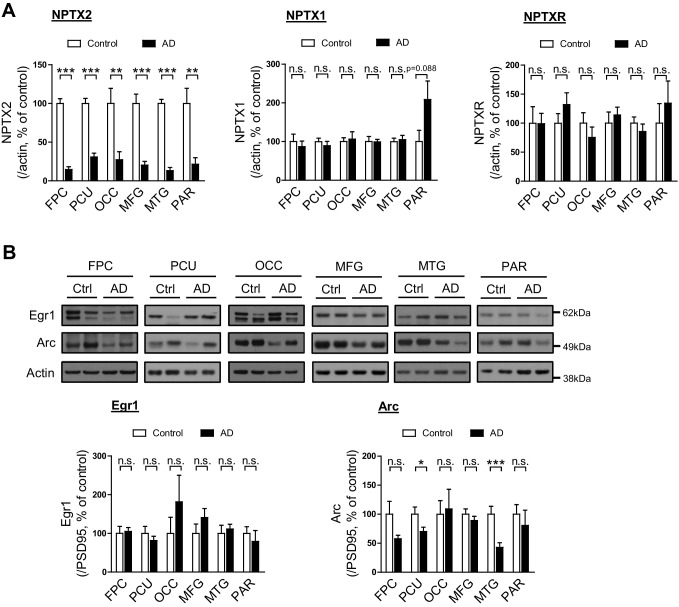
Figura 1-figure supplement 1.Immediata espressione genica precoce nel cervello umano post-mortem AD.(A) I livelli di NPTX2 sono ridotti nel cervello umano post-mortem AD. Quantificazione dei livelli NPTX2, NPTX1 e NPTXR nella Figura 1A con actina come proteina di riferimento. NPTX2 è down-regolato in tutte le regioni cerebrali saggiate di individui AD quando si fa riferimento all’actina. Corteccia frontopolare (FPC): controllo, n = 7; AD, n = 8. Precuneus (PCU): controllo, n = 15; AD, n = 19. Giro occipitale (OCC): controllo, n = 7; AD, n = 7. Giro frontale centrale (MFG): controllo, n = 9; AD, n = 16. Giro temporale medio (MTG): controllo, n = 10; AD, n = 18. Giro pararietale (PAR): controllo, n = 5; AD, n = 5.(B) Egr1 e l’espressione Arco in diverse regioni cerebrali di controllo e soggetti AD. Macchie occidentali mostrano che l’espressione di Egr1 e Arc non sono significativamente alterati nella maggior parte delle aree cerebrali testate da individui AD. FPC: controllo, n = 7; AD, n = 8. PCU: controllo, n = 15; AD, n = 19. OCC: controllo, n = 7; AD, n = 7. MFG: controllo, n = 9; AD, n = 16. MTG: controllo, n = 10; AD, n = 18. PAR: controllo, n = 5; AD, n = 5. *p<0.05, **p<0.01, ***p<0.001 da test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.006

Figura 1-figure supplement 2.I livelli di NPTX2 sono ridotti nel cervello umano post-mortem DS-AD.(A) Western blot test mostrano NPTX2 down-regolazione NPTX2 in giro frontale superiore (SFG) di individui con sindrome di Down e il morbo di Alzheimer (DS-AD). Controllo, n = 8; DS-AD, n = 12.(B) Nptx2 mRNA è ridotto in SFG di individui con DS-AD. Controllo, n = 8; DS-AD, n = 12. *p<0,05, con test t a due code. I dati rappresentano la media ± SEM. Vedere le informazioni sui pazienti nella Figura 1 – dati fonte 3.DOI:
http://dx.doi.org/10.7554/eLife.23798.007
Un meccanismo di microRNA di NPTX2 down-regolazione NPTX2 nel cervello umano AD
Abbiamo esaminato i determinanti di Nptx2 mRNA down-regolazione mRNA nel cervello umano. Trascrizione Nptx2 è regolato da metilazione di sequenze genomiche di fianco a fianco in cellule pancreatiche(Zhang et al., 2012), tuttavia, Nptx2 metilazione saggiato da pirosequenziamento è stato basso nel cervello umano e non è diverso tra i soggetti di controllo e AD(Figura 2-figure supplemento 1). Inoltre, Nptx2 espressione pre-mRNA non era diverso tra i soggetti di controllo e AD(Figura 2A) suggerendo trascrizione Nptx2 è mantenuto in AD, e che mRNA ridotto è conseguente a ridotto pre-mRNA elaborazione (es. splicing) o la stabilità mRNA. Le IEG sono bersagli del controllo del miRNA(Huang et al., 2012) e TargetScan ha previsto diversi miRNA candidati che hanno come bersaglio Nptx2 3′ UTR (Figura 2B). Abbiamo determinato che miR-1271 così come la sua origine pri-miR, pre-mRNA e mRNA[miR-1271 è generato da introne del gene umano Arl10 (ADP-ribosilazione fattore simile 10)] sono stati aumentati nella corteccia frontale AD dove i livelli nei singoli campioni individuali correlati con Nptx2 mRNA(Figura 2C, e Figura 2-figure supplemento 2A). Analisi del giro precuneus AD rilevato conservazione simile di Nptx2 pre-mRNA(Figura 2-figure supplemento 2B), e gli aumenti di pri-miR-1271 , Arl10 pre-mRNA e mRNA, così come gli aumenti di miR-182 (Figura 2-figure supplemento 2C). Per confronto, abbiamo esaminato la corteccia frontale dei casi DS e confermato up-regolazione del triploide miR-155 (controllo positivo) insieme ad aumenti di miR-96 e miR-182(Figura 2D). miR-96, miR-182 e miR-1271 target la stessa sequenza in Nptx2 3’UTR (Figura 2E). Abbiamo confermato in cellule eterologhe che tutti e tre i miR riducono l’espressione di una fusione luciferasi codifica umana Nptx2 3’UTR rispetto ad un punto mutante 3′ UTR che impedisce il targeting miR (Figura 2-figuresupplement 2E-F). miRs espresso come pri-miRs da lentivirus in neuroni corticali di topo in coltura topo corticale ridotto espressione proteica NPTX2 topo nativo(Figura 2F a 2 H). miR-96 è stato più efficace e inoltre ridotto Nptx2 mRNA ma non pre-mRNA. Caveats per questi esperimenti includono il livello artificialmente elevato di espressione miR lentivirale, possibili differenze di specie nella risposta, e l’acutezza della manipolazione relativa alla malattia umana. Tuttavia, questi studi indicano che NPTX2 down-regolazione NPTX2 nel cervello umano AD e DS si verifica a seguito di disregolazione di mRNA dopo la trascrizione e suggeriscono un ruolo per i meccanismi miR.10.7554/eLife.23798.008Figure 2.miRNAs disregolazione e NPTX2 down-regolazione nel cervello AD.(A) Nptx2 livelli di pre-mRNA sono identici nella corteccia frontopolare (FPC) dei soggetti AD e di controllo. Controllo, n = 9; AD, n = 16.(B) microRNAs previsto per legare con Nptx2 3’UTR da TargetScan.(C) I saggi Taqman mostrano che miR-182 e miR-1271 sono aumentati in FPC degli individui AD. Controllo, n = 9; AD, n = 16. *p<0,05, **p<0,01 con test t a due code.(D) miR-96, miR-152 e miR-182 sono up-regolati in individui con sindrome di Down (DS). Il triploide miR-155 è servito come controllo positivo. Controllo, n = 14; DS, n = 18. *p<0.05, **p<0.01, ***p<0.001 da test t a due code.(E) miR-96, miR-182 e miR-1271 mirano alla stessa sequenza in Nptx2 3’UTR.(F-H) I neuroni corticali del topo coltivato sono trasdotti con lentivirus che esprimono miRNA non bersaglio (LV-NT) o miR-96 , miR-1271 e miR-182 .(F) L’espressione di miR-96, miR-1271 e miR-182 riduce il livello di proteina NPTX2.(G) MiR-96 riduce il mRNA Nptx2.(H) Nptx2 pre-mRNA è conservato da miR-96 e miR-1271 espressione. n = 5 pozzetti da tre colture indipendenti tranne n = 4 pozzetti per il gruppo LV-NT in Figura 2G. *p<0.05, ***p<0.001 per ANOVA non parametrico a senso unico con Tukey post hoc test. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.00810.7554/eLife.23798.009Figure2-figure supplemento 1.Methylation 1.Methylation di promotore Nptx2 nel cervello umano. (A) rappresentativo pirosequenziamento tracce mostrano alta metilazione del promotore Nptx2 in linea cellulare pancreatica AsPC1 cellule del pancreas, e la bassa metilazione nel cervello umano.(B) Nptx2 promotore metilazione Nptx2 nel cervello non è diverso tra i soggetti di controllo e AD. n = 8 per gruppo. Due-coda t test è stato eseguito. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.00910.7554/eLife.23798.010Figure2-figure supplemento 2.Nptx2mRNA è mirato da miRNA che sono up-regolamentati nel cervello AD. (A)miR-1271 up-regolamentazionemiR-1271 correla con ridotto mRNA Nptx2 mRNA. Controllo, n = 9; AD, n = 16. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(B,C) Analisi di Nptx2 mRNA e miRNA nella regione di AD precuneus (PCU).(B) Nptx2 mRNA è ridotto nella zona PCU di soggetti AD con conservato Nptx2 pre-mRNA. Controllo, n = 7; AD, n = 6.(C) miR-152 e miR-182 sono aumentati nella regione PCU AD rispetto al controllo. n = 7 per gruppo. *p<0.05, **p<0.01, ***p<0.001 per test t a due code.(D) Nptx2 pre-mRNA è ridotto nel giro frontale superiore (SFG) dei soggetti con sindrome di Down. Controllo, n = 14; DS, n = 18. **p<0,01 con test t a due code.(E,F) miRNAs miRNAs direttamente bersaglio Nptx2 3’UTR.(E) Wild-type (WT) o miR-binding site mutated (Mut) Nptx2 3’UTR 3’UTR è inserito a valle di un segnalatore luciferasi. I nucleotidi mutati sono in rosso.(F) miRNA imita sono in grado di ridurre l’attività della luciferasi nelle cellule HEK293, e questo effetto è parzialmente abolito dalla mutazione del sito di legame miRNA su Nptx2 3’UTR. n = 9-16 pozzi. * miRNA mimica vs controllo RNA; # WT Nptx2 vs mutante Nptx2. Test t a due code.(G) I test Western blot non mostrano cambiamenti significativi di Gefirina e Omero1, che sono bersagli previsti di miR-1271, nel cervello umano post mortem. Corteccia frontopolare (FPC): controllo, n = 7; AD, n = 8. Giro Precuneus (PCU): controllo, n = 15; AD, n = 18.(H) i livelli di mRNA di Gefirina e Omero1 nel cervello non sono significativamente alterati nei soggetti AD. FPC: controllo, n = 9; AD, n = 16. PCU: controllo, n = 7; AD, n = 6. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.010
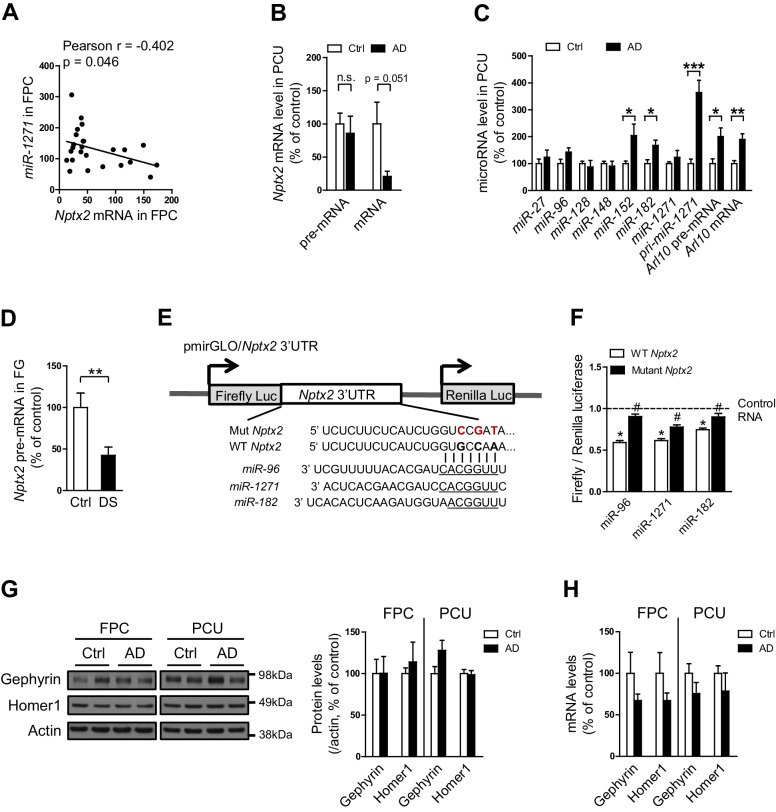
Figura 2-figure supplement 2.miRNAs disregolazione e NPTX2 down-regolazione miRNAs nel cervello AD. metilazione del promotore Nptx2 nel cervello umano.Nptx2 mRNA è bersaglio di miRNA che sono up-regolamentati nel cervello AD.(A) Nptx2 livelli di pre-mRNA sono identici nella corteccia frontopolare (FPC) dei soggetti AD e di controllo. Controllo, n = 9; AD, n = 16.(B) microRNAs previsto per legare con Nptx2 3’UTR da TargetScan.(C) I saggi Taqman mostrano che miR-182 e miR-1271 sono aumentati in FPC degli individui AD. Controllo, n = 9; AD, n = 16. *p<0,05, **p<0,01 con test t a due code.(D) miR-96, miR-152 e miR-182 sono up-regolati in individui con sindrome di Down (DS). Il triploide miR-155 è servito come controllo positivo. Controllo, n = 14; DS, n = 18. *p<0.05, **p<0.01, ***p<0.001 da test t a due code.(E) miR-96, miR-182 e miR-1271 mirano alla stessa sequenza in Nptx2 3’UTR.(F-H) I neuroni corticali del topo coltivato sono trasdotti con lentivirus che esprimono miRNA non bersaglio (LV-NT) o miR-96 , miR-1271 e miR-182 .(F) L’espressione di miR-96, miR-1271 e miR-182 riduce il livello di proteina NPTX2.(G) MiR-96 riduce il mRNA Nptx2.(H) Nptx2 pre-mRNA è conservato da miR-96 e miR-1271 espressione. n = 5 pozzetti da tre colture indipendenti tranne n = 4 pozzetti per il gruppo LV-NT in Figura 2G. *p<0.05, ***p<0.001 per ANOVA non parametrico a senso unico con Tukey post hoc test. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.008(A) rappresentativo pirosequenziamento tracce mostrano alta metilazione del promotore Nptx2 in linea cellulare pancreatica AsPC1 cellule del pancreas, e la metilazione bassa nel cervello umano.(B) Nptx2 promotore metilazione Nptx2 nel cervello non è diverso tra i soggetti di controllo e AD. n = 8 per gruppo. Due-coda t test è stato eseguito. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.009(A) miR-1271 up-regolamentazione correla con Nptx2 mRNA ridotto. Controllo, n = 9; AD, n = 16. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(B,C) Analisi di Nptx2 mRNA e miRNA nella regione di AD precuneus (PCU).(B) Nptx2 mRNA è ridotto nella zona PCU di soggetti AD con conservato Nptx2 pre-mRNA. Controllo, n = 7; AD, n = 6.(C) miR-152 e miR-182 sono aumentati nella regione PCU AD rispetto al controllo. n = 7 per gruppo. *p<0.05, **p<0.01, ***p<0.001 per test t a due code.(D) Nptx2 pre-mRNA è ridotto nel giro frontale superiore (SFG) dei soggetti con sindrome di Down. Controllo, n = 14; DS, n = 18. **p<0,01 con test t a due code.(E,F) miRNAs miRNAs direttamente bersaglio Nptx2 3’UTR.(E) Wild-type (WT) o miR-binding site mutated (Mut) Nptx2 3’UTR 3’UTR è inserito a valle di un segnalatore luciferasi. I nucleotidi mutati sono in rosso.(F) miRNA imita sono in grado di ridurre l’attività della luciferasi nelle cellule HEK293, e questo effetto è parzialmente abolito dalla mutazione del sito di legame miRNA su Nptx2 3’UTR. n = 9-16 pozzi. * miRNA mimica vs controllo RNA; # WT Nptx2 vs mutante Nptx2. Test t a due code.(G) I test Western blot non mostrano cambiamenti significativi di Gefirina e Omero1, che sono bersagli previsti di miR-1271, nel cervello umano post mortem. Corteccia frontopolare (FPC): controllo, n = 7; AD, n = 8. Giro Precuneus (PCU): controllo, n = 15; AD, n = 18.(H) i livelli di mRNA di Gefirina e Omero1 nel cervello non sono significativamente alterati nei soggetti AD. FPC: controllo, n = 9; AD, n = 16. PCU: controllo, n = 7; AD, n = 6. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.010
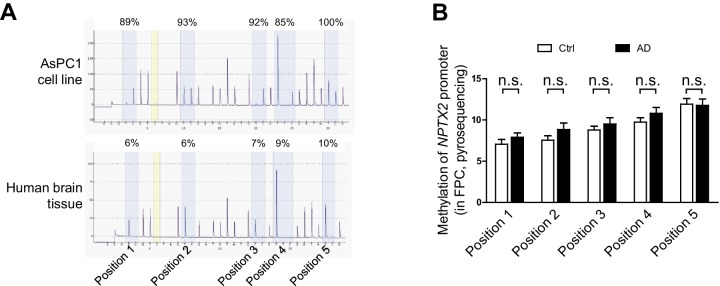
Figura 2-figure supplement 1.1. Metilazione del promotore Nptx2 nel cervello umano.(A) rappresentativo pirosequenziamento tracce mostrano alta metilazione del promotore Nptx2 in linea cellulare pancreatica AsPC1 cellule del pancreas, e la metilazione bassa nel cervello umano.(B) Nptx2 promotore metilazione Nptx2 nel cervello non è diverso tra i soggetti di controllo e AD. n = 8 per gruppo. Due-coda t test è stato eseguito. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.009

Figura 2-figure supplement 2.Nptx2 mRNA è bersaglio di miRNA che sono upregulated nel cervello AD.(A) miR-1271 up-regolamentazione miR-1271 correla con ridotto Nptx2 mRNA. Controllo, n = 9; AD, n = 16. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(B,C) Analisi di Nptx2 mRNA e miRNA nella regione di AD precuneus (PCU).(B) Nptx2 mRNA è ridotto nella zona PCU di soggetti AD con conservato Nptx2 pre-mRNA. Controllo, n = 7; AD, n = 6.(C) miR-152 e miR-182 sono aumentati nella regione PCU AD rispetto al controllo. n = 7 per gruppo. *p<0.05, **p<0.01, ***p<0.001 per test t a due code.(D) Nptx2 pre-mRNA è ridotto nel giro frontale superiore (SFG) dei soggetti con sindrome di Down. Controllo, n = 14; DS, n = 18. **p<0,01 con test t a due code.(E,F) miRNAs miRNAs direttamente bersaglio Nptx2 3’UTR.(E) Wild-type (WT) o miR-binding site mutated (Mut) Nptx2 3’UTR 3’UTR è inserito a valle di un segnalatore luciferasi. I nucleotidi mutati sono in rosso.(F) miRNA imita sono in grado di ridurre l’attività della luciferasi nelle cellule HEK293, e questo effetto è parzialmente abolito dalla mutazione del sito di legame miRNA su Nptx2 3’UTR. n = 9-16 pozzi. * miRNA mimica vs controllo RNA; # WT Nptx2 vs mutante Nptx2. Test t a due code.(G) I test Western blot non mostrano cambiamenti significativi di Gefirina e Omero1, che sono bersagli previsti di miR-1271, nel cervello umano post mortem. Corteccia frontopolare (FPC): controllo, n = 7; AD, n = 8. Giro Precuneus (PCU): controllo, n = 15; AD, n = 18.(H) i livelli di mRNA di Gefirina e Omero1 nel cervello non sono significativamente alterati nei soggetti AD. FPC: controllo, n = 9; AD, n = 16. PCU: controllo, n = 7; AD, n = 6. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.010
Nptx2 ko e Aß amiloidosi disturbano sinergicamente la ritmicità ippocampale
NPTX2 non è ridotto nel cervello ditopi APPswe/PS1∆E9 di 6 mesi (qui chiamato hAPP ) (Borcheltet al., 1997) (Figura 3-figure supplement 1). Per valutare il possibile impatto del down-regolamentazione NPTX2 nel cervello umano AD, abbiamo creato un modello di mouse che combina l’amiloidosi(APPswe/PS1∆E9; qui chiamato hAPP ) e Nptx2-/- .L’amiloidosi in un modello murino simile aumenta l’eccitabilità dell’ippocampo riducendo l’eccitabilità degli intrneuroni fotovoltaici(Palop et al., 2007; Verret et al., 2012). Di conseguenza, abbiamo considerato la possibilità che la perdita di NPTX2 riduca ulteriormente la funzione dei neuroni fotovoltaici. Abbiamo preparato fette di ippocampo acuto da topi di 3-4 mesi e registrato potenziali di campo extracellulare da strato piramidale di CA3 da WT, Nptx2-/- , hAPP e hAPP/Nptx2-/-.Spontanee ondulazioni d’onda acuta (SWR) erano evidenti in tutti e quattro i gruppi(Figura 3-figure supplement 2A-2D). SWR sono correnti oscillatorie spontanee che dipendono dalla funzione PV-interneuron(Csicsvari et al., 1999; Ellender et al., 2010) e riflettono la cottura quasi sincrona di gruppi di neuroni piramidali. SWR si è verificato ad una incidenza significativamente più alta, ma con una frequenza di picco inferiore, in hAPP / Nptx2-/- topi(Figura 3-figure supplemento 2E-2F). Abbiamo poi monitorato le oscillazioni gamma indotte da bagno applicazione di carbachol(Fisahn et al., 1998). Le oscillazioni gamma sono potenziali di campo registrati vicino al soma dei neuroni piramidali e riflettono le correnti inibitorie sincronizzate create dal PV interneuron synaptic drive(Buzsáki e Wang, 2012). In entrambi i topi WT e Nptx2-/-, le oscillazioni gamma sono state osservate con una frequenza di picco da 30 a 40 Hz(Figura 3A e B). i topi hAPP mostravano un ritmo gamma regolare, ma ad una frequenza più bassa(Figura 3C). hAPP/Nptx2-/- mostravano un’oscillazione ‘gamma’ ancora più lenta con una potenza di picco significativamente ridotta (Figura3D a 3F). Inoltre, la ritmicità è stata interrotta da prominenti scoppi ipersincroni(Figura 3D) indicativa di una maggiore eccitabilità della rete.10.7554/eLife.23798.011Figure 3.Circuit Rhythmicity e l’espressione GluA4 sono interrotti nei topi hAPP/Nptx2-/-.(A-D) Esempi di potenziali di campo extracellulare (i) con area tratteggiata mostrata su una base temporale estesa (ii) per topi WT (A),Nptx2-/-(B),hAPP( C ) ehAPP/Nptx2-/-(D ). Per la traccia hAPP/Nptx2-/-, la traccia grigia in (ii) mostra la traccia su base temporale espansa e la traccia nera mostra l’asse della tensione espansa per mostrare oscillazioni di tipo gamma annidate all’interno di picchi di popolazione.(E) Spettri di potenza per topi WT, Nptx2-/-, hAPP, e hAPP/Nptx2-/-, presi da 400 s di registrazione, normalizzati alla potenza tra 3 e 300 Hz.(F) La potenza normalizzata delle oscillazioni di tipo gamma è stata significativamente ridotta nei topi hAPP/Nptx2-/-(z-score; WT, 5,1 ± 0.73; Nptx2-/-, 3,8 ± 0,63; hAPP, 3,9 ± 0, 79; hAPP/Nptx2-/-, 1,7 ± 0,68; p=0, 0199, ANOVAunidirezionale). **, p<0,01 vs WT, test di confronto multiplo post-hoc.(G) L’espressione GluA4 non è alterata in Nptx2-/-corteccia di topo di 6 mesi. n = 4 per WT e n = 3 per Nptx2-/-.(H) Immagini rappresentative western blot e la quantificazione di GluA4 nel proencefalo di 6 mesi, WT, hAPP e hAPP/Nptx2-/- topi. hAPP/Nptx2-/- topi mostrano GluA4 ridotto nel cervello. WT, n = 4; hAPP, n = 6; hAPP/Nptx2-/-, n = 4 . **p<0,01 per ANOVA non parametrico a senso unico con Tukey post hoc test.DOI:http://dx.doi.org/10.7554/eLife.23798.01110.7554/eLife.23798.012Figuresupplemento a 3 cifre 1.NPTX2 espressione a 1.NPTX2 nel modello di topo amiloidosi.I test Western blot non mostrano alcun cambiamento significativo dell’espressione NPTX2 nel cervello ditopo APPswe/PS1∆E9 (hAPP) maschio di 6 mesi rispetto al wildtype (WT). n = 3. Il test t a due code è stato eseguito. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.01210.7554/eLife.23798.013Figure 3-figure supplement 2.Spontaneous sharp-wave ripples (SWRs) si verificano più frequentemente nei topi hAPP/Nptx2-/-.(A-D) Esempi di registrazioni di campo extracellulare che mostrano i SWR in tracce non filtrate (i), con l’area inscatolata filtrata (da 100 a 250 Hz) per mostrare un singolo SWR (ii) e la corrispondente trasformazione wavelet della traccia non filtrata (iii) per topi WT (A),Nptx2-/-(B ),hAPP( C ), e hAPP/Nptx2-/- (D).(E) L’incidenza dei SWR era significativamente maggiore nei topi hAPP/Nptx2-/-(WT, 0,55 ± 0,13 Hz, n = 12; Nptx2-/-, 0,28 ± 0,10 Hz, n = 10; hAPP, 0.59 ± 0,14 Hz, n = 17; hAPP/Nptx2-/-, 1,46 ± 0, 32 Hz,n = 14; p=0,0010, ANOVA unidirezionale; **, p<0,01 vs WT nel test di confronto multiplo di Dunnet post hoc) .(F) La frequenza di picco se i SWR sono stati significativamente ridotti in topi hAPP/Nptx2-/-(WT, 198,7 ± 2,7 Hz; Nptx2-/-, 198,7 ± 3,4; hAPP, 192.6 ± 2,2 Hz; hAPP/Nptx2-/-, 188,2± 3,4 Hz; p=0,0384, ANOVA unidirezionale; *, p<0,05 vs WT nel test di confronto multiplo post hoc Dunnets ).(G,H) Non sono state osservate differenze significative né nell’ampiezza del picco SWR (G) (WT, 17,9 ± 2,3 µV; Nptx2-/-, 18.4 ± 4,3 µV; hAPP, 20,3 ± 4,4 µV ; hAPP/Nptx2-/-, 24,6 ± 4.6 µV; p=0,6773, ANOVA unidirezionale), o durata (H) (WT, 26,6 ± 1,4 ms; Nptx2-/-, 27,0 ± 1.3 ms; hAPP, 27,4 ± 1,1 ms; hAPP/Nptx2-/-, 29,1± 1,4 ms; p=0,5609, ANOVA unidirezionale).DOI:http://dx.doi.org/10.7554/eLife.23798.013
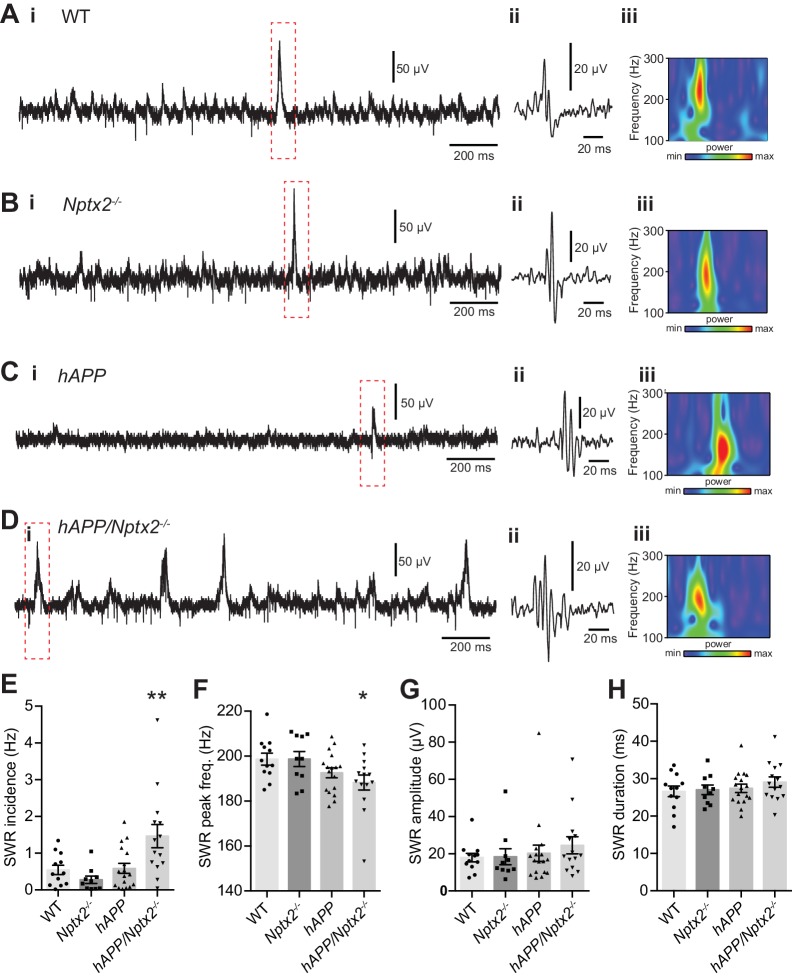
Figura 3-figure supplement 2.Figura 3— supplemento alla figura 2. Ritmicità del circuito e l’espressione GluA4 sono interrotti in hAPP/Nptx2-/- topi.espressione NPTX2 in modello di topo amiloidosi.le ondulazioni spontanee delle onde acute (SWR) si verificano più frequentemente nei topi hAPP/Nptx2-/-.(A-D) Esempi di potenziali di campo extracellulare (i) con area tratteggiata mostrata su una base temporale estesa (ii) per topi WT (A),Nptx2-/-(B),hAPP( C ) e hAPP/Nptx2-/-(D). Per la traccia hAPP/Nptx2-/-, la traccia grigia in (ii) mostra la traccia su base temporale espansa e la traccia nera mostra l’asse della tensione espansa per mostrare oscillazioni di tipo gamma annidate all’interno di picchi di popolazione.(E) Spettri di potenza per topi WT, Nptx2-/-, hAPP, e hAPP/Nptx2-/-, presi da 400 s di registrazione, normalizzati alla potenza tra 3 e 300 Hz.(F) La potenza normalizzata delle oscillazioni di tipo gamma è stata significativamente ridotta nei topi hAPP/Nptx2-/-(z-score; WT, 5,1 ± 0.73; Nptx2-/-, 3,8 ± 0,63; hAPP, 3,9 ± 0, 79; hAPP/Nptx2-/-, 1,7 ± 0,68; p=0, 0199, ANOVAunidirezionale). **, p<0,01 vs WT, test di confronto multiplo post-hoc.(G) L’espressione GluA4 non è alterata in Nptx2-/-corteccia di topo di 6 mesi. n = 4 per WT e n = 3 per Nptx2-/-.(H) Immagini rappresentative western blot e la quantificazione di GluA4 nel proencefalo di 6 mesi, WT, hAPP e hAPP/Nptx2-/- topi. hAPP/Nptx2-/- topi mostrano GluA4 ridotto nel cervello. WT, n = 4; hAPP, n = 6; hAPP/Nptx2-/-, n = 4 . **p<0,01 per ANOVA non parametrico a senso unico con Tukey post hoc test.DOI:
http://dx.doi.org/10.7554/eLife.23798.011I test Western blot non mostrano alcun cambiamento significativo dell’espressione NPTX2 in un cervello di topo maschio di 6 mesi APPswe/PS1∆E9 (hAPP) rispetto a quello di tipo selvaggio (WT). n = 3. È stato eseguito il test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.012(A-D) Esempi di registrazioni di campo extracellulare che mostrano i SWR in tracce non filtrate (i), con l’area inscatolata filtrata (da 100 a 250 Hz) per mostrare un singolo SWR (ii) e la corrispondente trasformazione wavelet della traccia non filtrata (iii) per topi WT (A),Nptx2-/-(B ),hAPP( C ), e hAPP/Nptx2-/- (D).(E) L’incidenza dei SWR era significativamente maggiore nei topi hAPP/Nptx2-/-(WT, 0,55 ± 0,13 Hz, n = 12; Nptx2-/-, 0,28 ± 0,10 Hz, n = 10; hAPP, 0.59 ± 0,14 Hz, n = 17; hAPP/Nptx2-/-, 1,46 ± 0, 32 Hz,n = 14; p=0,0010, ANOVA unidirezionale; **, p<0,01 vs WT nel test di confronto multiplo di Dunnet post hoc) .(F) La frequenza di picco se i SWR sono stati significativamente ridotti in topi hAPP/Nptx2-/-(WT, 198,7 ± 2,7 Hz; Nptx2-/-, 198,7 ± 3,4; hAPP, 192.6 ± 2,2 Hz; hAPP/Nptx2-/-, 188,2± 3,4 Hz; p=0,0384, ANOVA unidirezionale; *, p<0,05 vs WT nel test di confronto multiplo post hoc Dunnets ).(G,H) Non sono state osservate differenze significative né nell’ampiezza del picco SWR (G) (WT, 17,9 ± 2,3 µV; Nptx2-/-, 18.4 ± 4,3 µV; hAPP, 20,3 ± 4,4 µV ; hAPP/Nptx2-/-, 24,6 ± 4.6 µV; p=0,6773, ANOVA unidirezionale), o durata (H) (WT, 26,6 ± 1,4 ms; Nptx2-/-, 27,0 ± 1.3 ms; hAPP, 27,4 ± 1,1 ms; hAPP/Nptx2-/-, 29,1± 1,4 ms; p=0,5609, ANOVA unidirezionale).DOI:
http://dx.doi.org/10.7554/eLife.23798.013
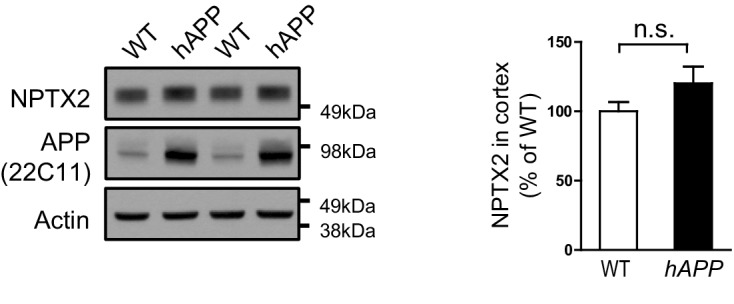
Figura 3-figure supplement 1.Espressione NPTX2 nel modello murino dell’amiloidosi.I test Western blot non mostrano alcun cambiamento significativo dell’espressione NPTX2 nel cervello di topo maschio di 6 mesi di età APPswe/PS1∆E9 (hAPP) rispetto a quello di tipo selvatico (WT). n = 3. È stato eseguito il test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.012

Figura 3-figure supplement 2.Le ondulazioni spontanee ad onda acuta (SWR) si verificano più frequentemente nei topi hAPP/Nptx2-/-.(A-D) Esempi di registrazioni di campo extracellulare che mostrano i SWR in tracce non filtrate (i), con l’area inscatolata filtrata (da 100 a 250 Hz) per mostrare un singolo SWR (ii) e la corrispondente trasformazione wavelet della traccia non filtrata (iii) per topi WT (A),Nptx2-/-(B),hAPP( C ), e hAPP/Nptx2-/- (D).(E) L’incidenza dei SWR era significativamente maggiore nei topi hAPP/Nptx2-/-(WT, 0,55 ± 0,13 Hz, n = 12; Nptx2-/-, 0,28 ± 0,10 Hz, n = 10; hAPP, 0.59 ± 0,14 Hz, n = 17; hAPP/Nptx2-/-, 1,46 ± 0, 32 Hz,n = 14; p=0,0010, ANOVA unidirezionale; **, p<0,01 vs WT nel test di confronto multiplo di Dunnet post hoc) .(F) La frequenza di picco se i SWR sono stati significativamente ridotti in topi hAPP/Nptx2-/-(WT, 198,7 ± 2,7 Hz; Nptx2-/-, 198,7 ± 3,4; hAPP, 192.6 ± 2,2 Hz; hAPP/Nptx2-/-, 188,2± 3,4 Hz; p=0,0384, ANOVA unidirezionale; *, p<0,05 vs WT nel test di confronto multiplo post hoc Dunnets ).(G,H) Non sono state osservate differenze significative né nell’ampiezza del picco SWR (G) (WT, 17,9 ± 2,3 µV; Nptx2-/-, 18.4 ± 4,3 µV; hAPP, 20,3 ± 4,4 µV ; hAPP/Nptx2-/-, 24,6 ± 4.6 µV; p=0,6773, ANOVA unidirezionale), o durata (H) (WT, 26,6 ± 1,4 ms; Nptx2-/-, 27,0 ± 1.3 ms; hAPP, 27,4 ± 1,1 ms; hAPP/Nptx2-/-, 29,1± 1,4 ms; p=0,5609, ANOVA unidirezionale).DOI:
http://dx.doi.org/10.7554/eLife.23798.013
Nptx2 ko e Aß amiloidosi interferiscono sinergicamente con l’espressione dell’ippocampo GluA4
Abbiamo cercato la prova di un ruolo specifico per Nptx2-/-sulla funzione interneurone-PV neuronale piramidale nei topi hAPP/Nptx2-/-. NPTX2 è richiesto per la regolazione omeostatica di GluA4 a sinapsi eccitatorie su interneuroni PV in risposta all’aumento dell’attività dei neuroni piramidali(Chang et al., 2010). GluA4 espressione non è sostanzialmente alterato nel cervello di NPTX2-/-topi(Figura 3G), tuttavia, GluA4 è notevolmente ridotto in Nptx2-/-/Nptxr-/-topi(Pelkey et al., 2015, 2016). Poiché NPTXR è necessario per mGluR-LTD(Cho et al., 2008), Nptxr-/-presumibilmente aumenta l’eccitabilità dei neuroni piramidali e la domanda di NPTX2 per legare e stabilizzare GluA4. Abbiamo monitorato l’espressione di GluA4 e abbiamo trovato una marcata riduzione di hAPP/Nptx2-/- rispetto al controllo WT o hAPP(Figura 3H). Né Nptx2-/-da solo(Figura 3G)(Pelkey et al., 2015, 2016) né hAPP da solo(Figura 3H) ha ridotto l’espressione GluA4 indicando che la riduzione di GluA4 in hAPP/Nptx2-/- rappresenta un fenotipo emergente che impatta la funzione interneuron PV. Mentre ci sono importanti limitazioni di hAPP/Nptx2-/- topi come modello di AD compresi i livelli sovrapatofisiologici di Aß e la cancellazione completa di NPTX2, questi studi identificano l’espressione GluA4 e gli effetti sulla funzione del circuito inibitorio come conseguenze dell’azione combinata di amiloidosi e NPTX2 down-regolazione.
GluA4 espressione GluA4 correla con NPTX2 in entrambi i soggetti anziani controllo umano e AD
Come nel cervello del topo, l’espressione di GluA4 è arricchita selettivamente in PV-interneuroni nel cervello umano(Figura 4A). Abbiamo esaminato l’espressione GluA4 in regioni cerebrali multiple in entrambi i soggetti AD e controlli di età corrispondenti. GluA4 espressione GluA4 è stata ridotta nelle regioni cerebrali AD tra cui precuneus e mediale giroscopio frontale(Figura 4B e C). Il giro precuneus (Brodmann Area 7) risiede nella corteccia parietale e fa parte della ‘rete di default’ con forti connessioni con l’ippocampo (Buckneret al., 2008; Greicius et al. , 2004; Vincent et al., 2006) ed è notevole per gli elevati livelli di amiloide rilevati dalla PET nei soggetti AD e alcuni individui di controllo anziani (Sperling et al.,2009). L’istopatologia del giro precuneus in AD non è diversa dalle regioni cerebrali circostanti(Nelson et al., 2009). Interessante, quando l’espressione GluA4 è stata valutata separatamente nei controlli e nei soggetti AD c’era una forte correlazione con l’espressione NPTX2 in entrambi i gruppi, anche se i livelli di NPTX2 e GluA4 erano più bassi in AD(Figura 4D). Nel cervello giovane adulto GluA4 espressione GluA4 non ha correlato con NPTX2(Figura 4E e F), e l’espressione NPTX2 era superiore a quella dei controlli di età(Figura 4G e H, e Figura 4 dati fonte 1). Queste osservazioni suggeriscono che l’espressione NPTX2 si riduce con il normale invecchiamento e diventa un fattore determinante dell’espressione di GluA4 indipendentemente dalla malattia cognitiva evidente. GluA4 è ulteriormente ridotto in AD da NPTX2 down-regolazione NPTX2 nel contesto di amiloidosi.10.7554/eLife.23798.014Figure 4.GluA4 livelli sono ridotti nel cervello umano post mortem AD.(A) Immunostaining di GluA4 dimostra GluA4 è arricchito su PV-IN nella corteccia umana. I dati sono stati raccolti da quattro casi tra cui giro occipitale e giro parietale.(B e C) rappresentative immagini western blot(B) e la quantificazione di GluA4(C) nella corteccia frontopolare (FPC), precuneus (PCU), giro frontale medio (MFG) e giro temporale medio (MTG) da controlli e soggetti AD. GluA4 è significativamente down-regolato in PCU e MFG di individui AD. FPC: controllo, n = 7; AD, n = 8. PCU: controllo, n = 15; AD, n = 19. MFG: controllo, n = 9; AD, n = 16. MTG: controllo, n = 10; AD, n = 18. *p<0,05 con test t a due code. I dati rappresentano la media ± SEM.(D) I livelli GluA4 sono correlati con NPTX2 sia nel controllo che nel gruppo AD. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(E e F) GluA4 espressione non ha correlato con NPTX2 nel cervello giovane adulto. n = 10. Pearson analisi del coefficiente di correlazione è stata eseguita.(G e H) l’espressione NPTX2 nel cervello di un giovane adulto era superiore a quella dei controlli di età. Giovane, n = 12; Invecchiato, n = 15. **p<0,01 da test t a due code. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.01410.7554/eLife.23798.015Figuredati a 4 fonti 1.Informazioni sui controlli giovani sani e sui controlli sani di età per l’analisi del cervello.DOI:http://dx.doi.org/10.7554/eLife.23798.015
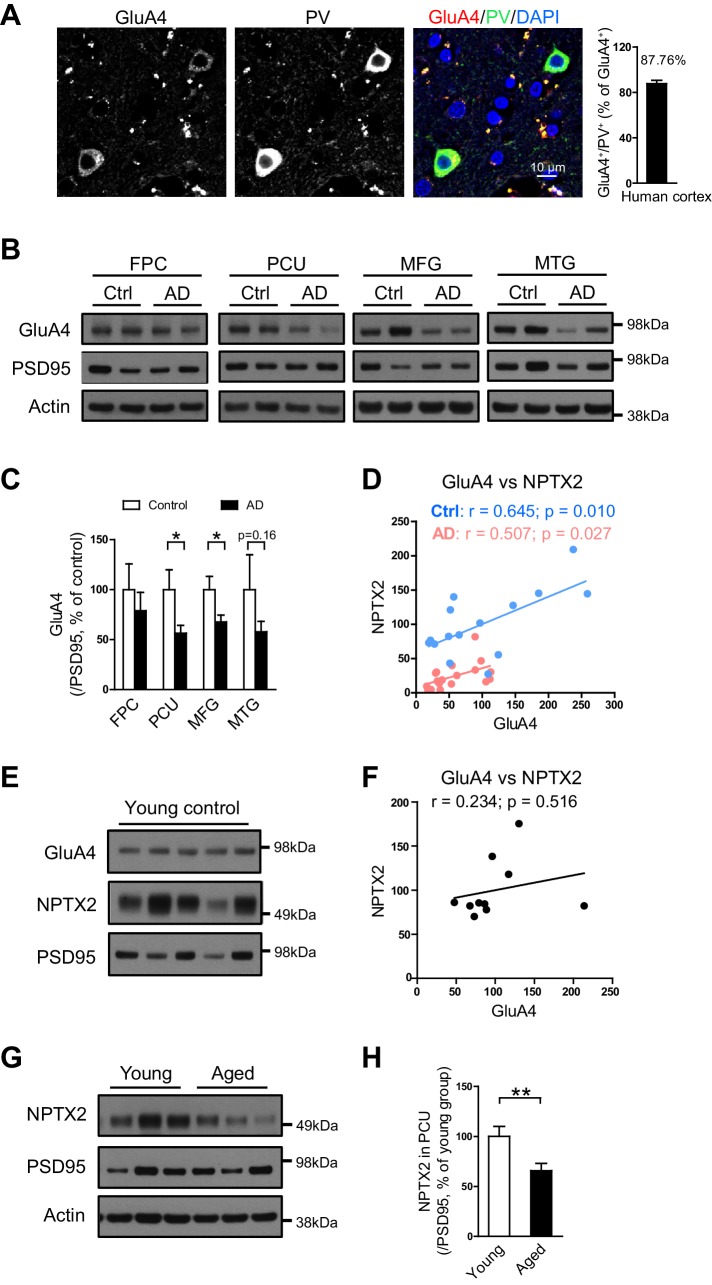
Figura 4 dati fonte 1.I livelli di GluA4 sono ridotti nel cervello umano post-mortem AD.informazioni di giovani controlli sani e anziani controlli sani per l’analisi del cervello.informazioni di giovani controlli sani e anziani controlli sani per l’analisi del cervello.(A) L’immunocolorazione di GluA4 dimostra che GluA4 è arricchito su PV-IN nella corteccia umana. I dati sono stati raccolti da quattro casi tra cui giro occipitale e giro parietale.(B e C) Immagini rappresentative western blot(B) e la quantificazione di GluA4(C) nella corteccia frontopolare (FPC), precuneus (PCU), giro frontale medio (MFG) e giro temporale medio (MTG) da controlli e soggetti AD. GluA4 è significativamente down-regolato in PCU e MFG di individui AD. FPC: controllo, n = 7; AD, n = 8. PCU: controllo, n = 15; AD, n = 19. MFG: controllo, n = 9; AD, n = 16. MTG: controllo, n = 10; AD, n = 18. *p<0,05 con test t a due code. I dati rappresentano la media ± SEM.(D) I livelli GluA4 sono correlati con NPTX2 sia nel controllo che nel gruppo AD. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(E e F) GluA4 espressione non ha correlato con NPTX2 nel cervello giovane adulto. n = 10. Pearson analisi del coefficiente di correlazione è stata eseguita.(G e H) l’espressione NPTX2 nel cervello di un giovane adulto era superiore a quella dei controlli di età. Giovane, n = 12; Invecchiato, n = 15. **p<0,01 da test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.01410.7554/eLife.23798.015Figure 4-source data 1.Information of young healthy controls and aged healthy controls for brain analysis.DOI:http://dx.doi.org/10.7554/eLife.23798.015DOI:
http://dx.doi.org/10.7554/eLife.23798.015DOI:
http://dx.doi.org/10.7554/eLife.23798.015
CSF NPTX2 fornisce un biomarcatore del cervello NPTX2
Per valutare la relazione tra NPTX2 e le prestazioni cognitive, abbiamo dovuto stabilire un biotest del cervello NPTX2 che potesse essere misurato in soggetti viventi per i quali erano disponibili i punteggi dei test comportamentali e altre informazioni. Abbiamo rilevato NPTX2 nel liquor CSF da WB, coerente con la sua secrezione naturale alle sinapsi eccitatorie e la sua associazione potenzialmente reversibile con le reti di glicoproteine che circondano in modo unico gli introneuroni fotovoltaici(Chang et al., 2010). I livelli di CSF NPTX2 sono stati ridotti nei soggetti AD(Figura 5A e B, e Figura 5 – dati fonte 1). I livelli di CSF NPTX1 e NPTXR sono stati ridotti anche negli stessi campioni di CSF(Figura 5A e B, e Figura 5—dati fonte 1). NPTXR in CSF è stato rilevato in WB come tre bande corrispondenti a tutta la lunghezza (60 kDa) e presunti prodotti di scissione a 45 kDa e 30 kDa e tutti e tre sono stati ridotti in AD CSF (Figura 5-figure supplement 1). NPTX1 e NPTXR sono ampiamente espressi in sinapsi eccitatorie(Lee et al., 2017; Xu et al., 2003) e la loro riduzione nel liquor nonostante i livelli conservati nel cervello AD suggerisce che la loro espressione nel liquor deriva da una fonte discreta. Abbiamo determinato che NPTX1 e NPTX2 nel liquor umano sono oligomeri disolfuro-collegati(Figura 5-figure supplemento 2A) coerente con il loro noto co-assemblaggio nel cervello (Xuet al., 2003). Inoltre, i livelli di CSF NPTX1 e NPTXR fortemente correlati con il CSF NPTX2 nei singoli campioni(Figura 5-figure supplement 2B). Dal momento che NPTX2 si accumula selettivamente sugli introneuroni fotovoltaici, ne deduciamo che questa è la fonte principale di NPTX1, NPTX2 e NPTXR in CSF.10.7554/eLife.23798.016Figure 5.NPTX livelli sono ridotti in CSF da individui con diagnosi clinica di AD.(A,B) Western blot test di NPTX2, NPTX1 e NPTXR nel liquido cerebrospinale lombare (CSF) dai controlli di età corrispondenti e pazienti con diagnosi clinica di AD. I pazienti con AD mostrano livelli ridotti di NPTX2, NPTX1 e NPTXR nel liquido cerebrospinale lombare. Controllo, n = 36; AD, n = 30.(C) ELISA è stato sviluppato per quantificare la proteina NPTX2 nel CSF. NPTX2 saggiato da ELISA corrisponde strettamente con i livelli definiti da WB. n = 64. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(D) ELISA mostra una riduzione significativa di NPTX2 nel liquor CSF da pazienti con AD clinicamente diagnosticato. Controllo, n = 36; AD, n = 28.(E) Il saggio ELISA ha confermato la riduzione di NPTX2 in AD nel secondo set di campioni di CSF. n = 36 per il controllo, n = 30 per AD.(F) I livelli di NPTX2 del liquor CSF sono significativamente ridotti in individui con un lieve deterioramento cognitivo (MCI) rispetto ai controlli sani. Controllo, n = 72; MCI, n = 17.(G-L) Analisi della curva caratteristica operativa del ricevitore (ROC) del CSF Aβ42 (G), tau(H), p-tau181 (I), NPTX2 (J), tau/NPTX2 (K) e p-tau/NPTX2 (L) come biomarcatori diagnostici dell’AD per distinguere l’AD dal controllo. I valori di cut off sono stati determinati massimizzando il valore dell’indice di Youden. L’analisi ROC di tau/NPTX2 indica che la sua potenza diagnostica è superiore al solo NPTX2, Aß42, tau o p-tau. AUC: area sotto la curva ROC. Controllo, n = 61-72; AD, n = 50-58. **p<0.01, ***p<0.001 con test t a due code. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.01610.7554/eLife.23798.017FigureDati a 5 fonti 1.Sommario delle analisi del liquor umano nella malattia di Alzheimer (prima coorte).DOI:http://dx.doi.org/10.7554/eLife.23798.01710.7554/eLife.23798.018Figure5 dati fonte;dati fonte 2.Riassunto dell’analisi del liquor umano nella malattia di Alzheimer (seconda coorte).DOI:http://dx.doi.org/10.7554/eLife.23798.01810.7554/eLife.23798.019Figuresupplemento a 5 cifre 1.Riduzione dei livelli di NPTXR nel liquido cerebrospinale lombare (CSF) da individui con AD. (A) Immagini rappresentative western blot mostrano tre bande principali con campioni di CSF umano da anticorpo NPTXR.(B) I pazienti con diagnosi clinica di AD hanno ridotto i livelli di NPTXR nel liquido cerebrospinale rispetto ai controlli sani. Controllo, n = 31; AD, n = 28. ***p<0,001 per test a due code t. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.01910.7554/eLife.23798.020Figuresupplemento a 5 cifre 2.Detection di NPTX in CSF umano.(A) NPTX2 e NPTX1 sono rilevati nel CSF lombare di soggetti umani come un complesso ad alto peso molecolare che viene risolto in NPTX individuali con reagente riducente su SDS-PAGE. Le frecce indicano il monomero NPTX2 e NPTX1. BME: β-mercaptoetanolo.(B) L’espressione NPTX2 nel CSF è correlata ai livelli di CSF NPTX1 e NPTXR nei singoli campioni. n = 66. L’analisi del coefficiente di correlazione Pearson è stata eseguita.DOI:http://dx.doi.org/10.7554/eLife.23798.02010.7554/eLife.23798.021FigureSupplemento a 5 cifre 3.Sviluppo del saggio ELISA NPTX2.(A,B) Generazione di anticorpi monoclonali di topo NPTX2 (A) e purificazione della proteina NPTX2 (B) per il saggio ELISA. Le macchie occidentali che utilizzano l’anticorpo monoclonale NPTX2 del topo mostrano una banda di 50 kDa nel lisato cerebrale WT che è assente in Nptx2-/-e Nptx1-/-; Nptx2-/-; Nptxr-/-(triplo knockout, TKO) (A).DOI:http://dx.doi.org/10.7554/eLife.23798.02110.7554/eLife.23798.022Figuresupplemento a 5 cifre 4.Riduzione dei livelli di NPTX nel secondo set di liquor lombare da parte di individui con AD.Immagini rappresentative western blot e quantificazione di NPTX2, NPTX1 e NPTXR nel secondo set di liquor lombare da parte di pazienti con diagnosi clinica di AD. I pazienti con AD mostrano livelli ridotti di NPTX2, NPTX1 e NPTXR nel liquor lombare rispetto ai controlli sani. Controllo, n = 36; AD, n = 30. *p<0,05, **p<0,01 con test t a due code. I dati rappresentano la media ± SEM.DOI:http://dx.doi.org/10.7554/eLife.23798.02210.7554/eLife.23798.023Figuresupplemento a 5 cifre 5.Correlazione positiva di NPTXs con il CSF tau e p-tau.(A-C) I livelli diCSF NPTX2 sono correlati con il CSF Tau (B) e p-Tau (C), ma non con il CSF Aβ42 (A) nei pazienti con AD. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(D-F) I livelli di CSF NPTX1 correlano con CSF Tau (E) e p-Tau (F), ma non con CSF Aβ42 (D) nei pazienti con DA. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(G-I) I livelli di CSF NPTXR correlano con CSF Tau (H) e p-Tau (I), ma non con CSF Aβ42 (G) nei pazienti con DA. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.DOI:http://dx.doi.org/10.7554/eLife.23798.023
Abbiamo sviluppato un ELISA a sandwich per quantificare la proteina NPTX2 nel CSF(Figura 5-figure supplement 3) e abbiamo confermato una stretta corrispondenza con i livelli misurati da WB (Figura 5C). Il livello medio NPTX2 nel CSF di controllo era 1067 pg/ml rispetto a 296 pg/ml in AD(Figura 5D). Coerentemente con gli standard attuali per documentare un nuovo biomarcatore(Noel-Storr et al., 2014) abbiamo vagliato un secondo set indipendente di campioni di CSF dei pazienti da WB e ELISA e abbiamo confermato la coerenza dei livelli nei controlli e la riduzione di NPTX2 in AD(Figura 5E, Figura 5-figure supplement 4, e Figura 5-source data 2). L’ELISA NPTX2 di campioni di pazienti con MCI ha dimostrato una riduzione di NPTX2 rispetto ai controlli(Figura 5F).
Abbiamo confrontato le prestazioni di NPTX2 con i biomarcatori standard del CSF di AD. L’analisi delle caratteristiche operative del ricevitore (ROC) ha rivelato la specificità, la sensibilità e l’accuratezza di NPTX2 era simile a Aß42 e superiore a tau e p-tau per distinguere i controlli da AD (Figura 5G-J). Un rapporto di tau o p-tau diviso per NPTX2 ha mostrato un miglioramento delle prestazioni(Figura 5K e L). I livelli NPTX1/2/R non sono stati correlati con Aß42, ma sono stati correlati positivamente con tau e p-tau nei singoli pazienti con AD (Figura 5-figure supplement 5) e controlli (NPTX2 vs tau, r = 0,4625, p=0,0002; NPTX2 vs p-tau, r = 0,3607, p=0,0043, analisi del coefficiente di correlazione Pearson). Questo suggerisce che l’aspetto tau nel CSF può essere collegato alla funzione del circuito NPTX2 e PV, tuttavia, poiché cambiano in direzioni opposte in AD e tuttavia sono positivamente correlati in entrambi i controlli e AD la loro associazione appare complessa. Inoltre, la loro complementarietà nelle prestazioni diagnostiche suggerisce che essi rilevano processi distinti.
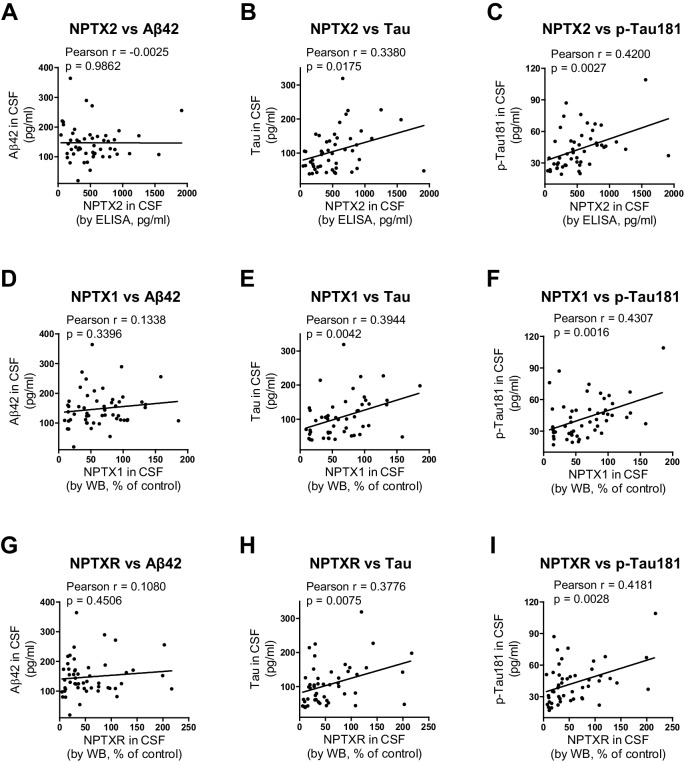
Figura 5-figure supplement 5.Figura 5—figura supplemento 5. I livelli di NPTX sono ridotti nel liquor del liquor di individui con diagnosi clinica di AD.riassunto dell’analisi del liquor umano nella malattia di Alzheimer (prima coorte).riassunto dell’analisi del liquor umano nella malattia di Alzheimer (seconda coorte).riassunto dell’analisi del liquor umano nella malattia di Alzheimer (prima coorte).riassunto dell’analisi del liquor umano nella malattia di Alzheimer (prima coorte).Riduzione dei livelli di NPTXR nel liquido cerebrospinale lombare (CSF) da individui con AD.rilevazione di NPTX nel CSF umano.sviluppo del saggio ELISA NPTX2.riduzione dei livelli di NPTX nel secondo set di CSF da individui con AD.correlazione positiva di NPTXs con CSF tau e p-tau.riduzione dei livelli di NPTX nel secondo set di CSF da individui con AD.correlazione positiva di NPTXs con CSF tau e p-tau.(A,B) Western blot test di NPTX2, NPTX1 e NPTXR nel liquido cerebrospinale lombare (CSF) da controlli in base all’età e pazienti con diagnosi clinica di AD. I pazienti con AD mostrano livelli ridotti di NPTX2, NPTX1 e NPTXR nel liquido cerebrospinale lombare. Controllo, n = 36; AD, n = 30.(C) ELISA è stato sviluppato per quantificare la proteina NPTX2 nel CSF. NPTX2 saggiato da ELISA corrisponde strettamente con i livelli definiti da WB. n = 64. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(D) ELISA mostra una riduzione significativa di NPTX2 nel liquor CSF da pazienti con AD clinicamente diagnosticato. Controllo, n = 36; AD, n = 28.(E) Il saggio ELISA ha confermato la riduzione di NPTX2 in AD nel secondo set di campioni di CSF. n = 36 per il controllo, n = 30 per AD.(F) I livelli di NPTX2 del liquor CSF sono significativamente ridotti in individui con un lieve deterioramento cognitivo (MCI) rispetto ai controlli sani. Controllo, n = 72; MCI, n = 17.(G-L) Analisi della curva caratteristica operativa del ricevitore (ROC) del CSF Aβ42 (G), tau(H), p-tau181 (I), NPTX2 (J), tau/NPTX2 (K) e p-tau/NPTX2 (L) come biomarcatori diagnostici dell’AD per distinguere l’AD dal controllo. I valori di cut off sono stati determinati massimizzando il valore dell’indice di Youden. L’analisi ROC di tau/NPTX2 indica che la sua potenza diagnostica è superiore al solo NPTX2, Aß42, tau o p-tau. AUC: area sotto la curva ROC. Controllo, n = 61-72; AD, n = 50-58. **p<0.01, ***p<0.001 con test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.01610.7554/eLife.23798.017Figure 5-source data 1.Summary of human CSF analysis in Alzheimer’s disease (prima coorte).DOI:http://dx.doi.org/10.7554/eLife.23798.017DOI:
http://dx.doi.org/10.7554/eLife.23798.01710.7554/eLife.23798.018Figure 5-source data 2.Summary of human CSF analysis in Alzheimer’s disease (seconda coorte).DOI:http://dx.doi.org/10.7554/eLife.23798.018DOI:
http://dx.doi.org/10.7554/eLife.23798.018DOI:
http://dx.doi.org/10.7554/eLife.23798.017DOI:
http://dx.doi.org/10.7554/eLife.23798.018(A) Le immagini rappresentative del Western Blot mostrano tre bande principali con campioni di CSF umano da anticorpo NPTXR.(B) I pazienti con AD clinicamente diagnosticato hanno ridotto i livelli di NPTXR nel liquor CSF rispetto ai controlli sani. Controllo, n = 31; AD, n = 28. ***p<0,001 per test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.019(A) NPTX2 e NPTX1 sono rilevati nel liquor lombare di soggetti umani come un complesso ad alto peso molecolare che viene risolto in singoli NPTX con reagente riducente su SDS-PAGE. Le frecce indicano il monomero NPTX2 e NPTX1. BME: β-mercaptoetanolo.(B) L’espressione NPTX2 nel CSF è correlata ai livelli di CSF NPTX1 e NPTXR nei singoli campioni. n = 66. L’analisi del coefficiente di correlazione Pearson è stata eseguita.DOI:
http://dx.doi.org/10.7554/eLife.23798.020(A,B) Generazione di anticorpi monoclonali di topo NPTX2(A) e purificazione della proteina NPTX2(B) per il saggio ELISA. Le macchie occidentali che utilizzano l’anticorpo monoclonale NPTX2 del topo mostrano una banda di 50 kDa nel lisato cerebrale WT che è assente in Nptx2-/-e Nptx1-/-; Nptx2-/-; Nptxr-/-(triplo knockout, TKO) (A).DOI:
http://dx.doi.org/10.7554/eLife.23798.021Immagini rappresentative del Western Blot e quantificazione di NPTX2, NPTX1 e NPTXR in un secondo set di liquido lombare di pazienti con diagnosi clinica di AD. I pazienti con AD mostrano livelli ridotti di NPTX2, NPTX1 e NPTXR nel liquor lombare rispetto ai controlli sani. Controllo, n = 36; AD, n = 30. *p<0,05, **p<0,01 con test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.022(A-C) I livelli diCSF NPTX2 sono correlati con CSF Tau (B) e p-Tau (C), ma non con CSF Aβ42 (A) nei pazienti con AD. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(D-F) I livelli di CSF NPTX1 correlano con CSF Tau (E) e p-Tau (F), ma non con CSF Aβ42 (D) nei pazienti con DA. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(G-I) I livelli di CSF NPTXR correlano con CSF Tau (H) e p-Tau (I), ma non con CSF Aβ42 (G) nei pazienti con DA. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.DOI:
http://dx.doi.org/10.7554/eLife.23798.023
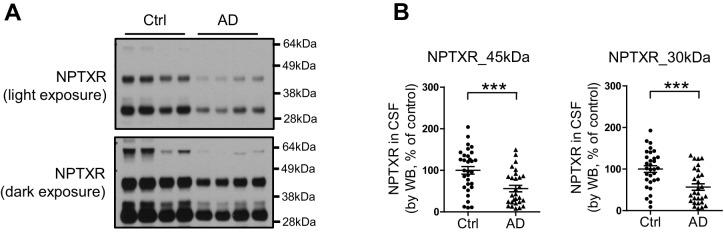
Figura 5-figure supplement 1.1. Riduzione dei livelli di NPTXR nel liquido cerebrospinale lombare (CSF) da individui con AD.(A) rappresentative immagini western blot mostrano tre bande principali con campioni di CSF umano da anticorpi NPTXR.(B) I pazienti con diagnosi clinica di AD hanno ridotto i livelli di NPTXR nel liquido cerebrospinale rispetto ai controlli sani. Controllo, n = 31; AD, n = 28. ***p<0,001 per test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.019
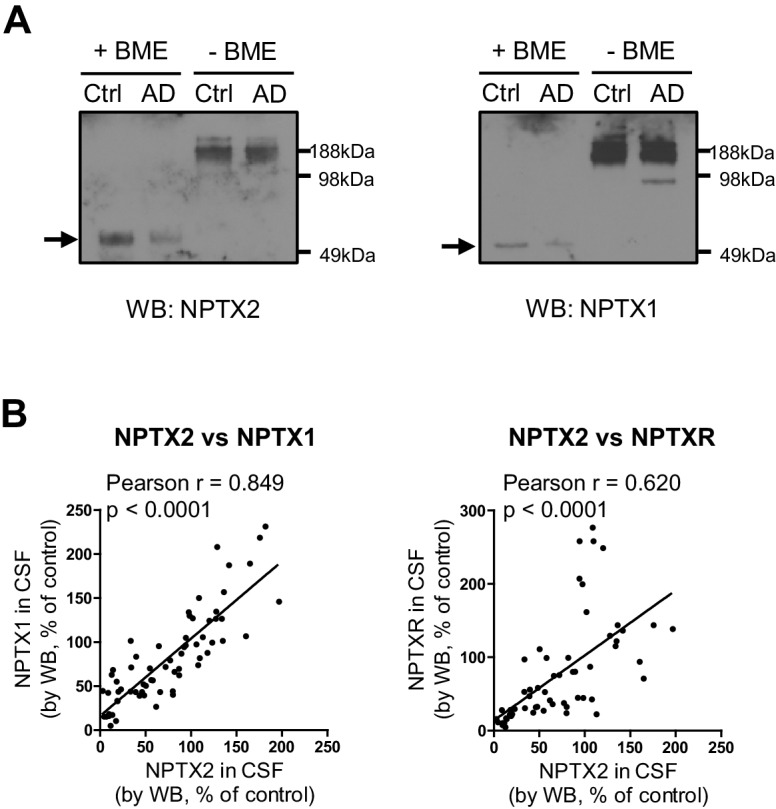
Figura 5-figure supplement 2.Rilevamento di NPTX nel liquido cerebrospinale umano.(A) NPTX2 e NPTX1 sono rilevati nel liquor lombare di soggetti umani come un complesso ad alto peso molecolare che viene risolto in singoli NPTX con reagente riducente su SDS-PAGE. Le frecce indicano il monomero NPTX2 e NPTX1. BME: β-mercaptoetanolo.(B) L’espressione NPTX2 nel CSF è correlata ai livelli di CSF NPTX1 e NPTXR nei singoli campioni. n = 66. L’analisi del coefficiente di correlazione Pearson è stata eseguita.DOI:
http://dx.doi.org/10.7554/eLife.23798.020
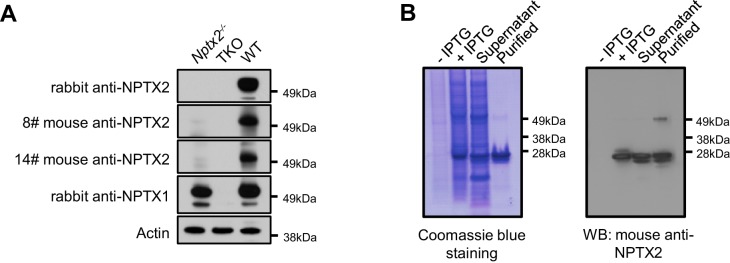
Figura 5-figure supplement 3.Sviluppo del saggio ELISA NPTX2.(A,B) Generazione di anticorpi monoclonali di topo NPTX2(A) e purificazione della proteina NPTX2(B) per il saggio ELISA. Le macchie occidentali che utilizzano l’anticorpo monoclonale NPTX2 del topo mostrano una banda di 50 kDa nel lisato cerebrale WT che è assente in Nptx2-/-e Nptx1-/-; Nptx2-/-; Nptxr-/-(triplo knockout, TKO) (A).DOI:
http://dx.doi.org/10.7554/eLife.23798.021
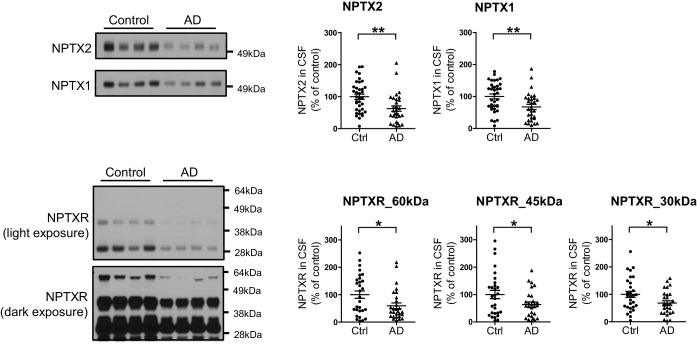
Figura 5-figure supplement 4.Riduzione dei livelli NPTX nel secondo set di CSF da individui con AD.5. Immagini rappresentative western blot e quantificazione di NPTX2, NPTX1 e NPTXR in seconda serie di CSF lombare da pazienti con diagnosi clinica di AD. I pazienti con AD mostrano livelli ridotti di NPTX2, NPTX1 e NPTXR nel liquor lombare rispetto ai controlli sani. Controllo, n = 36; AD, n = 30. *p<0,05, **p<0,01 con test t a due code. I dati rappresentano la media ± SEM.DOI:
http://dx.doi.org/10.7554/eLife.23798.022

Figura 5-figure supplement 5.Correlazione positiva di NPTXs con CSF tau e p-tau.(A-C) I livelli di CSF NPTX2 sono correlati con il CSF Tau (B) e p-Tau (C), ma non con il CSF Aβ42 (A) nei pazienti con AD. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(D-F) I livelli di CSF NPTX1 correlano con CSF Tau (E) e p-Tau (F), ma non con CSF Aβ42 (D) nei pazienti con DA. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.(G-I) I livelli di CSF NPTXR correlano con CSF Tau (H) e p-Tau (I), ma non con CSF Aβ42 (G) nei pazienti con DA. n = 49-51. L’analisi del coefficiente di correlazione Pearson è stata eseguita.DOI:
http://dx.doi.org/10.7554/eLife.23798.023
L’espressione NPTX2 è correlata alle prestazioni cognitive e alle misure del volume dell’ippocampo
I dati cognitivi dettagliati disponibili per il secondo gruppo di soggetti AD hanno rivelato correlazioni positive (p < 0.05) di NPTX2 con la Dementia Rating Scale (DRS)(Mattis, 1988), sostituzione del simbolo digitale(Wechsler, 1981), Wisconsin Card Sorting Task modificato(Nelson, 1976), Block design Subtest (Wechsler,1974), Test di riproduzione visiva [Russell Adaptation WMS;(Wechsler, 1945), fluidità semantica verbale [SVF(Borkowski et al., 1967), test di apprendimento verbale in California [CVLT(Delis et al., 1987)(Figura 6 e Tabella 1). Al contrario, i livelli di Aß42 correlavano con SVF e CVLT, mentre tau e p-tau non correlavano con questi test comportamentali (Tabella1). NPTX2 livelli anche correlati con l’occupazione dell’ippocampo(Heister et al., 2011), una misura del volume dell’ippocampo, mentre Aß42, tau e p-tau non ha fatto (Figura 6I e J, Tabella 1). Misure di volume dell’ippocampo mostrano associazioni robuste con le prestazioni cognitive e la progressione AD(Fjell et al., 2010; Heister et al., 2011; Jack et al., 1999). Questi risultati dimostrano l’associazione unica di CSF NPTX2 espressione con le prestazioni cognitive e la fisiopatologia AD.10.7554/eLife.23798.024Figure 6.NPTX2 espressione correla con le prestazioni cognitive e le misure di volume dell’ippocampo.(A) espressione NPTX2 in CSF correla con la funzione cognitiva saggiato da DRS nel gruppo AD. n = 30. p = 0,0093 da Pearson analisi coefficiente di correlazione Pearson. DRS: scala di valutazione della demenza.(B-D) Non è stata osservataalcuna correlazione tra il CSF Aβ42 (B), tau(C) o p-tau181 (D) conDRS nel gruppo AD. n = 28.(E-H) L’espressioneNPTX2 nel CSF è correlata con il test delle funzioni cognitive testato con WCST (E), test di fluenza semantica verbale (F), testVRT(G) e test CVLT (H).n= 20-28. WCST: Wisconsin Card Sorting Task; AFV: Semantic Verbal Fluency Test (‘Animals’, ‘Fruits’, ‘Vegetables’); VRT: Visual Reproduction Test; CVLT: California Verbal Learning Test. È stata eseguita l’analisi del coefficiente di correlazione Pearson.(I) Immagini rappresentative di immagini di risonanza magnetica del cervello umano.(J) NPTX2 livelli di NPTX2 in CSF correlare con l’occupazione ippocampale. n = 25 soggetti AD. HOC: occupazione dell’ippocampo.DOI:http://dx.doi.org/10.7554/eLife.23798.02410.7554/eLife.23798.025Table1.Analisi di correlazione dei biomarcatori del liquor con le dimensioni dell’ippocampo e test clinici cognitivi nei soggetti AD dalla seconda coorte.DOI:http://dx.doi.org/10.7554/eLife.23798.025VsCSF NPTX2Vs CSF aβ42Vs CSF tauVs CSF p-TaunPearson rp valueenPearson rp valueenPearson rp valueenPearson rp valueenPearson rp valueAverage Hippocampal Occupancy250.4830.015250.1890.36724-0.0830.701240.3600.084Dementia Rating Scale300.4670.009280.2250.24927-0.1370.497270.2960.134Digit Symbol Substitution240.4460.029230.1270.565220.0950.673220.0430.849Boston Naming Test280.2080.288270.0980.62826-0.0840.682260.2880.154Test di fluidità verbale fonemica280.2000.30827-0.0790.69426-0.2070.310260.1330.519Test di fluidità verbale semantico280.3850.043270.3960.041260.1210.557260.0360.863Wisconsin Card Sorting Task_categories raggiunto220.4450.038210.0460.84220-0.1790.45320-0.0570.812Wisconsin Card Sorting Task_perseverative errori22-0.3240.142210.1470.526200.0130.0130.95620-0.1530.519 Test di riproduzione visiva_richiamo immediato240.4320.035230.1490.497220.3250.140220.2920.187 Test di riproduzione visiva_richiamo ritardato240.3450.099230.1230.57722-0.3920.07222-0.0130.955Block Design280.4460.017270.0820.68326-0.1110.590260.0040.984Clock Drawing_command280.3370.079270.0400.84526-0.1190.563260.0870.673Clock Drawing_copy280.0110.955270.1060.60026-0.2460.225260.1610.434California Verbal Learning Test_list B recall200.5200.019200.6680.001190.2000.41119-0.1240.613California Verbal Learning Test_recognition200.1090.64720-0.0960.687190.0460.851190.2210.364Correlazioni significative (p < 0,05) sono evidenziate in giallo.
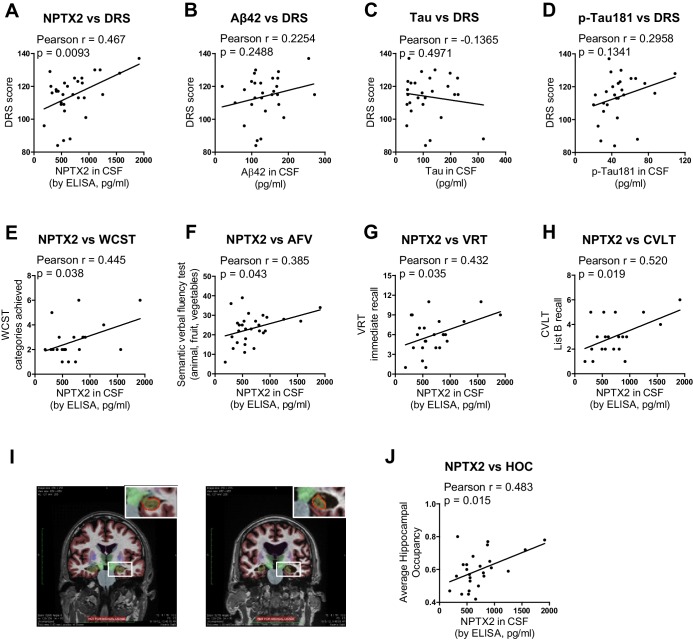
Figura 6.NPTX2 espressione correla con le prestazioni cognitive e le misure di volume dell’ippocampo.(A) NPTX2 espressione espressione in CSF correla con la funzione cognitiva saggiato da DRS nel gruppo AD. n = 30. p = 0,0093 da Pearson analisi coefficiente di correlazione Pearson. DRS: scala di valutazione della demenza.(B-D) Non è stata osservataalcuna correlazione tra il CSF Aβ42 (B), tau(C) o p-tau181 (D) conDRS nel gruppo AD. n = 28.(E-H) L’espressioneNPTX2 nel CSF è correlata con il test delle funzioni cognitive testato con WCST (E), test di fluenza semantica verbale (F), testVRT(G) e test CVLT (H).n= 20-28. WCST: Wisconsin Card Sorting Task; AFV: Semantic Verbal Fluency Test (‘Animals’, ‘Fruits’, ‘Vegetables’); VRT: Visual Reproduction Test; CVLT: California Verbal Learning Test. È stata eseguita l’analisi del coefficiente di correlazione Pearson.(I) Immagini rappresentative di immagini di risonanza magnetica del cervello umano.(J) NPTX2 livelli di NPTX2 in CSF correlare con l’occupazione ippocampale. n = 25 soggetti AD. HOC: occupazione dell’ippocampo.DOI:
http://dx.doi.org/10.7554/eLife.23798.024
Discussione
Il presente studio identifica NPTX2 down-regolazione NPTX2 come un importante meccanismo nella patogenesi AD che è strettamente legato al deterioramento cognitivo. Le riduzioni osservate della proteina NPTX2 nel cervello umano e nel liquor, e la correlazione del liquor NPTX2 con lo stato cognitivo e il volume ippocampale forniscono un supporto per l’idea che NPTX2 potrebbe essere un biomarcatore informativo per l’AD. Il valore potenziale di NPTX2 come biomarcatore è ulteriormente avanzato dall’osservazione che NPTX2 appare ‘ortogonale’ ad Aß e tau poiché NPTX2 non è ridotto come diretta conseguenza di Aß amiloide nei modelli murini, appare indipendente da Aß in AD asintomatico umano (pre AD), e le riduzioni del liquor NPTX2 non sono correlate con la riduzione del liquor Aß42 o gli aumenti di tau/p-tau. A causa degli effetti sinergici dell’amiloidosi e della regolazione della riduzione di NPTX2, i livelli di CSF di NPTX2 potrebbero distinguere i soggetti che saranno più sensibili alla terapia di riduzione dell’amiloide. Uno studio recente ha riportato che il liquor NPTX2 può anticipare la progressione della malattia(Swanson et al., 2016). Ma la conclusione che NPTX2 è semplicemente un interessante biomarcatore in AD non ha l’opportunità di implicare un nuovo meccanismo che è alla base del fallimento cognitivo. In particolare, proponiamo che un’importante causa prossimale di declino cognitivo in AD è il fallimento della funzione adattiva dei neuroni piramidali di modificare la spinta eccitatoria di interneuroni di parvalbumina (PV) a picco veloce.
Il meccanismo proposto si basa su studi precedenti che dimostrano che NPTX2 è espresso nei neuroni piramidali come IEG(Tsui et al., 1996), ed è richiesto per la scalatura omeostatica delle sinapsi eccitatorie dei neuroni piramidali su interneuroni PV(Chang et al., 2010). Una delle notevoli proprietà di NPTX2 è che si accumula selettivamente alle sinapsi eccitatorie su interneuroni PV(Chang et al., 2010). NPTX2 è una lectina dipendente da Ca2+ e sembra legare la rete glicoproteica che circonda in modo prominente gli interneuroni fotovoltaici(Chang et al., 2010; Tsui et al., 1996). NPTX2 si lega anche ai recettori AMPA postsinaptici(Lee et al., 2017; O’Brien et al., 1999; Xu et al., 2003) e agisce per aumentare l’accumulo locale dei recettori AMPA e rafforzare le sinapsi. Questa azione di NPTX2 a sinapsi eccitatorie su interneuroni PV è evidente in vivo dove la delezione genetica di NPTX2 si traduce in una riduzione selettiva della guida neuronale piramidale di interneuroni PV nello sviluppo della corteccia del topo(Gu et al., 2013). Nptx2-/-da solo non provoca cambiamenti marcati della funzione degli interneuroni PV come saggiato da oscillazioni gamma in vivo o in fette acute, ma Nptx2-/-combinato con Nptxr-/-ha portato ad una profonda perturbazione delle oscillazioni gamma e deficit cognitivi in combinazione con una riduzione della proteina GluA4 negli interneuroni PV(Pelkey et al., 2015, 2016). La riduzione della proteina GluA4 non è stata associata ad una ridotta espressione di Gria4 mRNA, proteina TARP, immunoreattività della parvalbumina, o alterazione della rete glicoproteica perineuronale. Un modello ipotetico è stato suggerito in cui NPTX2 presinaptico è necessario per legare GluA4 postsinaptico e prevenire il turnover dei recettori in condizioni di attività alterata conseguente a Nptxr-/-(Pelkey et al., 2015, 2016).
Per valutare la nozione che NPTX2 down-regolazione nel cervello umano è indicativo di una perturbazione del meccanismo omeostatico neuronale piramidale NPTX2-PV interneuron abbiamo avuto bisogno di identificare un biomarcatore della funzione PV-interneurone che dipende dall’espressione NPTX2 e che potrebbe essere quantitativamente saggiato in campioni di tessuto umano. Abbiamo confermato in un modello murino che l’espressione amiloide (come Nptxr-/-) agisce in sinergia con Nptx2-/-per abbassare l’espressione GluA4 e si traduce in cambiamenti previsti di eccitabilità e ritmicità. Queste osservazioni hanno convalidato GluA4 come biomarcatore della funzione interneuron PV NPTX2-dipendente nel contesto dell’amiloidosi. Nel cervello umano abbiamo trovato GluA4 espressione è stata ridotta e correlata con l’espressione NPTX2 negli stessi campioni che supportano l’idea che l’espressione GluA4 è dipendente da NPTX2 espressione nel cervello AD. Inaspettatamente, GluA4 e NPTX2 correlano all’interno dei campioni in entrambi i casi di AD e nei controlli di età. Ciò è degno di nota in quanto nei giovani adulti l’espressione NPTX2 e GluA4 non sembra correlare all’interno dei campioni, e NPTX2 appare più alta nel cervello giovane che nei controlli anziani. Questa dipendenza dall’età richiede ulteriori analisi, ma suggerisce che l’espressione GluA4 in interneuroni PV diventa dipendente dall’espressione neuronale piramidale di NPTX2 durante il normale invecchiamento, e l’espressione GluA4-PV interneuroni funzione diventano criticamente ridotto in AD come espressione NPTX2 è ridotto. Sono inoltre necessari ulteriori studi per definire l’estensione anatomica e la possibile progressione della riduzione di NPTX2 oltre le regioni corticali.
Sia l’amiloide che NPTX2 determinano una riduzione della funzione interneuronale PV e un conseguente aumento dell’eccitabilità dei neuroni piramidali che fanno parte dei circuiti reciproci con interneuroni PV. Tuttavia, la conseguenza dell’amiloide e del down-regolamentazione NPTX2 sui circuiti interneuron-PV piramidali dei neuroni piramidali appare molto diversa. L’amiloide riduce l’eccitabilità degli interneuroni PV riducendo l’espressione del canale del sodio sensibile alla tensione Nav1.1(Verret et al., 2012). Al contrario, la down-regolazione NPTX2 riduce l’eccitabilità dei neuroni piramidali piramidali dell’interneurone PV. Come IEG, l’espressione naturale NPTX2 è dinamica e limitata ai neuroni che si impegnano nell’elaborazione delle informazioni, come le cellule dell’ippocampo [vedi per esempio l’uso delle IEG per rilevare le cellule dell’ippocampo(Guzowski et al., 1999; Vazdarjanova et al., 2002). Come risultato della normale esperienza comportamentale l’espressione NPTX2 stabilisce circuiti ‘informativi’ tra i neuroni piramidali e i PV-interneuroni che sosterranno preferibilmente l’attività futura di specifici gruppi di neuroni, ad esempio, durante il cablaggio dello sviluppo della corteccia visiva (Gu et al., 2013). Poiché la riduzione di NPTX2 in AD avviene dopo l’accumulo di amiloide e il declino cognitivo parallelo, si ipotizza che i circuiti possano adattarsi agli effetti dell’amiloide se i neuroni piramidali sono in grado di mantenere l’espressione specifica del circuito di NPTX2. Questo modello suggerisce che il down-regolazione NPTX2 è un ‘secondo successo’ per le disfunzioni dei circuiti PV-interneuronali dei neuroni piramidali e il fallimento cognitivo in AD. Reciprocamente, l’espressione NPTX2 può essere considerato un fattore di resilienza.
Il nostro modello prevede che l’azione combinata dell’amiloidosi e della down-regolazione NPTX2 produrrà un’interruzione del reclutamento dinamico dei circuiti interneurone-PV neurone-PV piramidali. Coerentemente con queste previsioni, l’attività cerebrale risulta aumentata in MCI, AD precoce e controlli anziani nelle regioni definite “rete di default” (Buckneret al., 2005; Greicius et al. , 2004; Sperling et al., 2009) e la connettività dinamica all’interno e tra le diverse reti di stato a riposo misurata dai segnali fMRI dipendenti dal livello di ossigeno nel sangue (BOLD) è ridotta in AD (Thomaset al., 2014). Dal momento che la capacità di ritmicità gamma è pensato alla base della connettività dinamica(Buzsáki e Wang, 2012; Engel et al., 2001), ridotto fMRI BOLD segnali BOLD può essere il correlato di imaging dei disfunzionali piramidali neurone-PV interneuron circuiti piramidali. I deficit di oscillazioni gamma sono associati con il deterioramento cognitivo nelle malattie cognitive umane, tra cui AD(Basar, 2013). E ‘inoltre degno di nota che sia NPTX2 down-regolazione e la connettività funzionale fMRI correlano in modo simile con i punteggi clinici Dementia Rating(Thomas et al., 2014). Di conseguenza, si ipotizza che il fallimento delle proprietà del circuito dinamico è più conseguente per le disfunzioni cognitive in AD.
Indipendentemente dal ruolo di NPTX2 nella formazione di circuiti ‘informativi’, l’aumento dell’attività conseguente all’amiloide e la riduzione di NPTX2 potrebbero accelerare la progressione della malattia, imponendo una maggiore richiesta di meccanismi omeostatici alternativi che indeboliscono le sinapsi eccitatorie dei neuroni piramidali, tra cui Arc (Shepherd etal., 2006) e Homer1a(Hu et al.,2010). In particolare, il meccanismo omeostatico mediato da Arc genera Aß migliorando l’elaborazione della secretasi di APP (Wu etal., 2011). Un meccanismo di avanzamento dell’indebolimento sinaptico è suggerito dall’osservazione che l’Arco è indotto dall’attivazione di Aß dei recettori metabotropici del glutammato (Um etal., 2013; Wu et al., 2011). L’arco è segnalato per guidare l’eliminazione delle sinapsi nel cervelletto in via di sviluppo(Mikuni et al., 2013). Se l’azione di Arc è aumentata in seguito all’amiloide e al fallimento dell’omeostasi dei neuroni piramidali-NPTX2-GluA4, potrebbe contribuire all’aumento della generazione di Aß e all’indebolimento e alla perdita di sinapsi eccitatorie sui neuroni piramidali. In questo modello, NPTX2 può essere considerato un ‘fattore di resilienza’ che mantiene un equilibrio di omeostasi eccitatoria autonoma delle cellule e basata su circuiti.
Studi di DS cervello suggeriscono che NPTX2 down-regolazione può contribuire a deficit cognitivi nei giovani individui e la progressione della malattia. La disponibilità di CSF e di follow-up longitudinale sarà necessario per valutare questa possibilità.
Gli studi diretti a comprendere la causa della down-regolazione NPTX2 in AD e DS concentrano l’attenzione sui meccanismi post-trascrizionali che hanno un impatto sulla stabilità dell’mRNA. AD e DS condividono l’upregulation dei miR che mirano alla stessa sequenza 3’UTR di mRNA Nptx2. Ipotizziamo che NPTX2 è normalmente regolato da miRs che possono mediare il ritardo prominente nella up-regolazione della proteina NPTX2 [per esempio dopo il sequestro(O’Brien et al., 1999), e che questo processo è disregolato in AD e DS. E ‘possibile che i percorsi biochimici accentuati nell’invecchiamento o DS guidare meccanismi patologici miR. miR-96 è stato implicato nella normale differenziazione del sistema uditivo(Kuhn et al., 2011) e la crescita cellulare e l’oncogenesi(Guttilla e White, 2009; Xu et al., 2013). l’espressione di miR-182 è indotta dalla ß-catenina e nelle cellule tumorali contribuisce all’invasività attraverso il down-regulating RECK, un inibitore delle metalloproteasi extracellulari (Chianget al., 2013; Hirata et al., 2013). miR-1271 , generato da un introne di Arl10, è specifico per l’uomo e si rivolge a più geni sinaptici tra cui la proteina sinaptica GABA, la gefirina sinaptica (Jensene Covault, 2011). Si prevede che la proteina ARL10 svolga un ruolo nel traffico vescicolare simile alle ARF (ADP-ribosilazione dei fattori di ADP) che sono implicate nel traffico di proteine sinaptiche, tra cui BACE1(Sannerud et al., 2011) e il recettore APOE LRP1(Jiang et al., 2014). L’obiettivo principale rimane quello di stabilire meccanismi causali che controllino l’espressione NPTX2 nel cervello umano.
Materiali e metodi
Ceppi di mouse
Nptx2-/-topi in background congenito C57BL/6J sono stati ottenuti dal laboratorio di Mark Perrin. APPswe/PS1∆E9 topi transgenici (Borcheltet al., 1997) (qui abbreviato hAPP ) ceppo è stato ottenuto dal Dr. Philip Wong. topi hAPP con singola copia di transgene sono stati incrociati con Nptx2-/- per generare hAPP/Nptx2+/-che sono stati poi incrociati con Nptx2-/-per generare hAPP/Nptx2-/-. Allo stesso modo, WT (C57BL/6J) sono stati incrociati con i topi hAPP per generare hAPP/WT, che sono stati incrociati con WT per generare la coorte. Per entrambe le coorti di topi WT e Nptx2 deletion, abbiamo confermato che ~50% della progenie dell’incrocio finale porta il transgene hAPP, e questo ha assicurato che i topi portano una singola copia del transgene. Tutte le procedure che coinvolgono gli animali erano sotto le linee guida del JHMI Institutional Animal Care and Use Committee.
Esemplari umani
Tessuto cerebrale umano del morbo di Alzheimer (AD) e AD asintomatico (ASYMAD) è stato ottenuto dal Johns Hopkins Brain Resource Center, che comprende soggetti dello Studio Longitudinale di Baltimora di invecchiamento. I soggetti sono stati reclutati dal nucleo clinico del Johns Hopkins Alzheimer’s Disease Research Center (ADRC) dalla comunità o dalla coorte già iscritta allo Studio Longitudinale di Baltimora sull’Invecchiamento. Le procedure di valutazione sono state coordinate da riunioni del Joint Clinical Core che assicurano la standardizzazione delle procedure diagnostiche per le valutazioni annuali mediche, neurologiche, psichiatriche e neuropsicologiche di tutti i soggetti. Il Nucleo di Neuropatologia organizza ed esegue autopsie su partecipanti clinicamente ben caratterizzati che hanno acconsentito all’autopsia. I risultati delle autopsie neuropatologiche vengono poi discussi in conferenze clinico-patologiche a cui partecipano i membri del Nucleo di Neuropatologia e di Clinica. Il tessuto cerebrale della sindrome di Down umana (DS) e i cervelli di controllo che sono andati con quelli sono stati ottenuti da due fonti – una è la University of Maryland brain and tissue bank, e un altro è il Dr. Benjamin Tycko presso il Taub Institute for Research on Alzheimer’s disease and the Aging Brain e il Dr. Jerzy Wegiel presso l’Istituto per la ricerca di base a Staten Island. I campioni di cervello sono stati lisati nel buffer RIPA più il cocktail di inibitori delle proteasi con un fattore di diluizione 1:50 per l’analisi Western blot.
I campioni di liquido cerebrospinale umano (CSF) sono stati ottenuti secondo i protocolli approvati dall’IRB dai partecipanti al Centro di Ricerca sulle Malattie di Alzheimer dell’UCSD. Tutti i partecipanti hanno ricevuto il consenso informato prima di prendere parte allo studio. Campioni di liquor umano sono stati sciolti con tampone di carico SDS, e 12 µl di liquor sono stati caricati a SDS-PAGE e successivo Western blot. Livelli di proteina NPTX2 in CSF sono stati ulteriormente quantificati dal saggio ELISA sviluppato nello studio attuale. Tutti i campioni di CSF sono stati congelati al momento della raccolta e saggiato dopo il primo scongelamento. Abbiamo notato che i livelli di proteina NPTX sono diminuiti con cicli multipli di scongelamento. Per convalidare il valore di NPTX2 come potenziale biomarcatore di CSF di AD, due coorti indipendenti di campioni di CSF sono state reclutate e analizzate per confermare il risultato. Le informazioni della clinica è stato accecato durante l’esperimento.
Reagenti
Rabbit anti-NPTX1 e anti-NPTX2 sono stati descritti in precedenza(Cho et al., 2008; Xu et al., 2003). L’anticorpo monoclonale anti-NPTX2 del topo è stato fatto contro la proteina di fusione GST NPTX2 N-termino (a.a.1-220). Specificità anticorpale è stata confermata con il tessuto cerebrale di NPTX2-/-topi. L’anticorpo monoclonale anti-Arc del topo è stato descritto in precedenza(Wu et al., 2011). Tutti gli altri anticorpi sono di aziende commerciali. L’anticorpo di pecora anti-NPTXR proviene da sistemi di R&S (Numero di Cat.: AF4414; RRID: AB_2153869; Minneapolis, USA); l’anticorpo monoclonale di topo anti-APP N-termino 22C11 è di Millipore (Numero di Cat.: MAB348; RRID: AB_94882; Massachusetts, USA); il coniglio ant-Egr1(C-19) è di Santa Cruz (Cat. Numero: sc-189; RRID: AB_2231020; Dallas, USA); il topo anti-PSD95 è di Thermo Scientific (Cat. Number: MA1-046; RRID: AB_2092361; Halethorpe, USA); il topo anti-gefirina è di BD Transduction Laboratories (Cat. Numero: 610584; RRID: AB_397929, San Jose, USA); mouse anti-Homer1 è di Santa Cruz Biotechnology (Cat. Number: sc-17842; RRID: AB_627742 ); rabbit anti-GluA4 è di Millipore (Cat. Number: MABN1109); mouse anti-parvalbumina è di Sigma (Cat. Number: P3088; RRID: AB_477329; St. Louis, USA); l’anticorpo antiactina del topo è della Sigma (Cat. Number: A2228; RRID: AB_476697); l’ECLTM anti-topo IgG HRP della GE Healthcare (Cat. Numero: NA931V; Halethorpe, USA); ECLTM anti-coniglio IgG HRP anti-coniglio è di GE Healthcare (Numero di Cat.: NA934V); asino anti-sheep IgG HRP è di Santa Cruz (Numero di Cat.: sc-2473; RRID: AB_641190 ).
Il substrato Western blot SuperSignal West Pico Luminol Enhancer Solution (Cat. Number: 1859675) e SuperSignal West Pico Stable Peroxide Solution (Cat. Number: 1859674) sono della Thermo Scientific.
Western Blot
Le cellule coltivate o il tessuto cerebrale sono stati lisati con un buffer RIPA modificato contenente 1% Tritone, 0,5% Na-deossicolato, 0,1% SDS, 50 mM NaF, 10 mM Na4P2O7, 2 mM Na3VO4, e cocktail di inibitori della proteasi in PBS, pH 7,4. Gli estratti proteici sono stati separati dal 4-12% di SDS-PAGE, trasferiti su membrane in PVDF, bloccati con il 5% di latte non grasso, e poi sondati con anticorpi primari per una notte a 4°C. Dopo i lavaggi con TBST (TBS con 0,1% Tween-20), le membrane sono state incubate con anticorpi secondari coniugati con HRP per 1 ora a temperatura ambiente (RT). Le bande immunoreattive sono state visualizzate dal substrato chemiluminescente potenziato (ECL, Pierce) su pellicola a raggi X e quantificate utilizzando il software di immagini TINA(www.tina-vision.net). Actin e PSD95 sono stati utilizzati come controlli di carico. Le proteine che migrano in modo simile in gel SDS-PAGE sono state saggiate su diversi blot senza stripping.
NPTX2 ELISA
Preparazione della proteina standard NPTX2 con il suo marchio
Come modello è stata utilizzata la lunghezza completa Nptx2-myc in pRK5 vettoriale. Il frammento terminale N che codifica l’amminoacido da 1 a 201 è stato amplificato con primer 5′ GCAAGGATCCCAAGCCCAAGGGATAACCC 3′ e 5′ CATGTCGACTCATGCACTGTTGCCTCTCTCTC 3′, e poi clonato nel vettore pQE30 (Qiagen, Germantown, USA) presso i siti di BamH1 e SalI. La proteina è stata espressa in XL1-blu cellule ospiti indotte con 1 mM IPTG. Il frammento NPTX2 espresso è stato purificato con NI-NTA colonna di agarosio (Qiagen), e la concentrazione della proteina è stata quantificata con il kit BCA (Thermo Fisher Scientific).
Saggio ELISA
Fondamentalmente, l’operazione segue il processo regolare dell’ELISA. In breve, 0,5 µg di anticorpo di coniglio anti-NPTX2 in 50 mM di tampone Na2CO3 (pH 9,5) sono stati rivestiti sulla piastra ELISA (Nunc) a 4°C per una notte. Il giorno successivo, dopo il trattamento con soluzione bloccante (5% BSA in PBS) per 1 ora a RT, 100 ul della serie di proteine standard diluite NPTX2 o campioni di CSF diluiti sono stati aggiunti in pozzetti e incubati a RT per 1 ora con scuotimento costante. Dopo il lavaggio con TBS, 100 ul di anticorpo di topo biotinilato anti-NPTX2 biotinilato sono stati aggiunti e incubati a RT per 1 ora. Poi, 100 ul di streptavidina coniugata con HRP (Biolegend, San Diego, USA) sono stati aggiunti e incubati per 1 ora. Dopo il lavaggio con TBS, 100 ul di substrato DAB (Biolegend) è stato applicato e incubato per mezz’ora a RT al buio. Alla fine, 100 ul di 4 MH2SO4soluzione di arresto è stato aggiunto e l’assorbanza è stata misurata a 450 nm. I livelli assoluti di NPTX2 in CSF sono stati determinati dal calcolo basato su una curva standard.
Immunostaining di GluA4
La neocorteccia umana è stata fissata per immersione in formaldeide al 10% in PBS (pH 7,4), e poi incorporata in paraffina e sezionata a 5 µm di spessore su vetrini. Le sezioni sono state deparaffinizzate e idratate mediante incubazione di vetrini a 60 ° C per 30 minuti e poi trasferiti in Xilene. La paraffina è stata rimossa dopo 3 cambi di Xilene per 5 min. Poi, i vetrini sono stati trattati 3 min con cambiamenti sequenziali del 100%, 95% e 70% di etanolo e ddH2O per tre volte. L’antigenicità delle proteine è stata smascherata dal trattamento con l’88% di acido formico per 5 min. I vetrini sono stati lavati con ddH2O 3 volte per 5 min ciascuno. Poi, le sezioni sono state trattate con soluzione bloccante (10% di siero di cavallo, 0,4% Tritone in TBS) per 1 ora a RT e incubate con topo anticorpo anti-PV (1:1000, Sigma) e coniglio anticorpo anti-GluA4 (1:300, Millipore) a 4 ° C per tutta la notte. Dopo tre lavaggi con TBS, le sezioni di tessuto sono state incubate con anticorpo secondario coniugato con Alexa Fluo a RT per 1 ora. I vetrini coprioggetto sono stati montati su vetrini di vetro con il reagente ProLong Gold antiscolorimento.
Estrazione di RNA e PCR quantitativa
L’RNA totale e il piccolo RNA sono stati estratti con il kit di isolamento mirVana miRNA (Ambion, Thermo Fisher Scientific) secondo il protocollo del produttore. RNA isolato è stato trattato con DNasi per rimuovere il DNA (Turbo DNA-free kit, Ambion). Un µg di RNA totale isolato è stato poi immediatamente trascritto in cDNA utilizzando il SuperScript First-Strand Synthesis System per RT-PCR (Invitrogen, Thermo Fisher Scientific). PCR quantitativa è stata eseguita con una macchina StepOne Plus (Applied Biosystem, Thermo Fisher Scientific) utilizzando SYBR verde ROX qPCR mastermix verde in una piastra ottica a 96 pozzetti. Il ciclo di PCR consiste di 95°C per 10 minuti, seguito da 40 cicli di 95°C per 30 s, 64°C per 30 s e 72°C per 30 s. È stata condotta una curva di fusione per determinare la specificità dell’amplificazione di PCR. Gapdh è stato servito come controllo interno per nominare i dati. Per analizzare le trascrizioni dirette pre-mRNA, i primer sono stati progettati per legarsi con l’introne dei geni.
| Saggio | Avanti primer | Primer invertito |
|---|---|---|
| Nptx2 pre-mRNA | 5′ CTGCCCTCCCCGCAAGTATAG 3′ 3′ | 5′ ACCAGAGTGTGTCCCTACTCCCCCCCCC 3 |
| Nptx2 mRNA(Sato et al., 2003) | 5′ CATCGGAGCTGCTCATCAAC 3′ 3′ | 5′ CTGCTCTTTTTTTTCCAAGGATC 3′ 3′ |
| Arl10 pre-mRNA | 5′ GTGGGGATGTCTCGGGGAGAAAC 3′ | 5′ GAAGACCACCGAAGGCAACCAGAGAGAG 3′. |
| Arl10 mRNA | 5′ AGTTTTGTGTGGAGCGAGGTGGAT 3′ | 5′ CTGGCTGCCAAGGAAGGAAAAC 3′ |
| Gefirina mRNA | 5′ CCTCCGTGTCCAGAATACCATCATCG 3′. | 5′ CCACGTACTGTTTTTTTTTTTGG 3′ CCACGTACTGTTTTTGG 3 |
| Omero1 mRNA | 5′ CAAGAACAGAGAGGGATTCTTTTTGA 3′ | 5′ TGCGAAAAGTTTTTTTTTTTTTOO 3′. |
| Gapdh | 5′ AGAAGGGGGGGGGGTTTTTOO 3′ 3′ | 5′ AGGGGCCATCCATCCCCACTTTTTOO 3′. |
Per l’analisi dell’abbondanza di miRNA, 30 ng di RNA samll isolato sono stati trascritti al contrario utilizzando il kit di trascrizione inversa Taqman micoRNA (Applied Biosystems), e poi sottoposti a saggi Taqman microRNA secondo il protocollo del produttore (Applied Biosystems) nella macchina StepOne Plus. Il ciclo di PCR consiste di 95°C per 10 minuti, seguito da 40 cicli di 95°C per 15 s, 60°C per 60 s. RNU48 è servito come controllo interno per nominare i dati.
Preparazione del lentivirus
I precursori di miR-96, miR-1271 e miR-182 sono stati amplificati mediante PCR dal DNA genomico e inseriti nei siti PacI e NheI del vettore lentivirale pSME2. Le costruzioni sono state verificate mediante sequenziamento. I plasmidi di produzione lentivirali contengono quattro costrutti: il plasmide della spina dorsale lentivirale pSME2 e tre plasmidi di imballaggio pCMV-VSVG, pLP1 e pLP2. Tutti i costrutti sono stati trasformati in cellule competenti stbl3 (Life Technologies) e poi preparati utilizzando un protocollo standard di colonne Qiagen Maxiprep.
Lentivirus è stato prodotto e confezionato in cellule HEK293T. HEK293T linea di cellule HEK293T è stato acquistato da ATCC (Numero di Cat.: CRL-3216; RRID: CVCL_0063). Nessuna contaminazione da micoplasma è stata rilevata da MycoAlert Mycoplasma Detection Kit (Numero di Cat.: LT07-218, Lonza, Allendale, USA). Le cellule HEK293T sono state coltivate in palloni da 175 cm2 che sono stati pre-rivestiti con lo 0,01% di soluzione di L-lisina poly (PLL) e mantenuti con DMEM contenente il 10% di FBS. Per migliorare l’efficienza della trasfezione, 25 μM clorochina è stato aggiunto al mezzo di cellule HEK293T coltivate quando la cultura era il 50% di confluenza, e la trasfezione è stata eseguita un’ora dopo. Le cellule sono state trasfettate utilizzando FuGene6 (Roche, New York, USA) con il rapporto di 1 μg di DNA plasmidico: 3 μl FuGene6. Otto ore dopo la trasfezione, 10 μM di butirrato di sodio sono stati aggiunti al mezzo per migliorare l’efficienza della trasfezione. Il mezzo di coltura è stato cambiato a 24 ore dopo la trasfezione e raccolto a 48 ore dopo il cambio del mezzo (l’efficienza della trasfezione è stata monitorata dalla fluorescenza GFP). Le particelle di virus sono state pellettate per centrifugazione a 25.000 giri/min. per 2 ore a 4°C (rotore Beckman SW 28). Il virus è stato prelevato e conservato a -80°C per un uso futuro.
Cultura neuronale
Le colture neuronali primarie del giorno embrionale 17,5 (E17,5) sono state preparate come descritto in precedenza(Chang et al., 2010). Le cellule sono state placcate su pozzetti rivestiti con PLL allo 0,02% ad una densità di 50 × 104 per pozzetto di piastra a 12 pozzetti, e infettati con miRNA-espressione lentivirus immediatamente dopo la placcatura. Sette giorni dopo, le cellule sono state raccolte per l’estrazione di RNA o Western Blot test.
Test di metilazione del DNA – pirosequenziamento
Il DNA del cervello post mortem dei pazienti affetti da AD e del controllo sano è stato estratto utilizzando il mini kit di DNA QIAamp (Qiagen), quindi trattato con bisolfito per convertire i residui di citosina in uracile, ma lasciando inalterata la citosina metilata (kit di EpiTect bisulfite, Qiagen). Il DNA trattato con bisolfito è stato amplificato mediante PCR utilizzando il test di metilazione del DNA Qiagen PM00126406, quindi sottoposto a pirosequenziamento per determinare la metilazione del DNA presso la Johns Hopkins University Genetic Resources Core Facility.
Saggio del reporter della Luciferasi
Nptx2 3’UTR è stato amplificato da PCR e inserito a valle della lucciola luciferasi in un vettore reporter pmirGLO (Promega, Madison, USA), che contiene un’altra luciferasi, renilla luciferasi, come riferimento interno. La mutazione del sito di binding miR su Nptx2 3’UTR è stata generata dal kit di mutagenesi in sito QuickChange che utilizza primer contenenti nucleotidi mutati (Agilent Technologies, Santa Clara, USA). Le costruzioni sono state verificate mediante sequenziamento.
Le cellule HEK293 sono state co-trasfettate con pmirGLO/ WT o Mut Nptx2 3’UTR e miR imita o controllo negativo siRNA (Qiagen) da Lipofectamina 2000 (Life Technologies). Un giorno dopo, le cellule sono state lisate e le attività di lucciola luciferasi e renilla luciferasi sono state saggiate da Dual-luciferase reporter test system (Promega). Il rapporto tra lucciola luciferasi e attività di renilla luciferasi rappresentava gli effetti delle mimetiche miR su Nptx2 3’UTR.
Elettrofisiologia a fette
Esperimenti di elettrofisiologia dell’interfaccia
Le fette sono state preparate a partire da topi di tipo selvatico, NPTX2-/-, hAPP o hAPP/NPTX2-/- di età compresa tra i 3 e i 4 mesi. I topi sono stati anestetizzati con isoflurano, decapitati e il cervello è stato immediatamente immerso in aCSF (a temperatura ambiente) aerato con 95% di O2 e 5% diCO2. L’aCSF contenuto (in mM): NMDG (135), KCl (1), KH2PO4, (1,2), MgCl2 (1,5), CaCl2 (0,5), glucosio (10) e bicarbonato di colina (20). Le fette orizzontali (400 µm di spessore) contenenti l’ippocampo sono state tagliate utilizzando un microtomo vibrante Leica VT1000S (Leica Microsystems, Germania) e sono state immediatamente inserite in una camera di tipo interfaccia (Warner Instruments, CT) contenente gas carbogeno umidificato e perfuse con aCSF aerato (1-1,5 ml min-1) contenente(in mM): NaCl (126), KCl (3), MgCl2 (2), CaCl2 (2), NaH2PO4 (1,25), glucosio (10) e NaHCO3 (26). Le fette sono state incubate per almeno un’ora prima di iniziare la registrazione. Potenziali di campo locali sono stati registrati da CA3 strato piramidale utilizzando pipette di vetro tirato da vetro borosilicato standard (3-5 MΩ) e riempito con aCSF. I segnali sono stati filtrati a 2 kHz e acquisiti a 10 kHz con un amplificatore Axon Axopatch 1D (Dispositivi Molecolari, CA), digitalizzati con un Axon Digidata 1322A (Dispositivi Molecolari, CA) e catturati su un computer con pClamp 9 (Dispositivi Molecolari, CA). Tutti i dati sono stati importati in Igor Pro 6 (Wavemetrics, OR) utilizzando NeuroMatic (ThinkRandom, UK) e analizzati con procedure scritte su misura. Le oscillazioni dell’ondulazione dell’onda acuta sono state registrate in condizioni di assenza di farmaci e poi le oscillazioni gamma sono state indotte applicando 25 µM di carbacholo (Sigma-Aldrich, MO) come descritto (Fisahnet al., 1998).
Analisi dei dati
Onde taglienti e ondulazioni
I SWR sono stati rilevati automaticamente utilizzando i metodi descritti altrove(Csicsvari et al., 1999; Pelkey et al., 2015), ma adattati per le registrazioni in vitro. Le registrazioni extracellulari sono state filtrate digitalmente in banda passante tra 150 e 250 Hz per rivelare gli SWR, e la radice quadrata media (RMS) della registrazione filtrata è stata utilizzata per la rilevazione automatica. I periodi in cui l’RMS ha superato una soglia di 4 SD sopra lo sfondo sono stati contati come eventi SWR nel nostro algoritmo di rilevamento. Il picco più vicino all’attraversamento della soglia è stato considerato il centro dell’SWR e 100 ms su entrambi i lati del picco sono stati estratti e il periodo corrispondente della traccia non filtrata è stato trasformato utilizzando una funzione wavelet Morlet. I confini dei SWR sono stati definiti come 2 SD al di sopra della potenza di base (presa dai primi 50 ms a 250 Hz) della funzione wavelet. La frequenza di picco dell’SWR è stata presa dalla trasformazione wavelet, e l’ampiezza calcolata dall’ampiezza picco-trough della traccia filtrata passa-banda. L’RMS della traccia filtrata è stato calcolato utilizzando i confini SWR rilevati dalla trasformata Wavelet, e quegli eventi con un RMS medio inferiore a 1,5 SD sopra lo sfondo sono stati respinti. Per evitare la contaminazione dei dati SWR da parte dell’attività della singola unità, tutti gli eventi rilevati di durata inferiore a 10 ms sono stati automaticamente respinti dal nostro algoritmo di rilevamento.
Oscillazioni gamma
Gli spettri di potenza sono stati generati da 400 s di registrazioni non filtrate durante i periodi di oscillazioni gamma, e questi sono stati normalizzati di 1/f (dopo ad esempio(Demanuele et al., 2007) e lo z-score è stato calcolato come prima(Pelkey et al., 2015). Questi spettri normalizzati sono stati utilizzati per determinare la frequenza di picco e la potenza delle oscillazioni gamma. Le esplosioni ipersincrone / picchi di popolazione durante le oscillazioni gamma sono state rilevate automaticamente utilizzando il quadrato della radice media (RMS) della registrazione filtrata. Le tracce sono state filtrate digitalmente ad alta frequenza a 300 Hz per rivelare l’attività di una singola unità, e le esplosioni ipersincrone / picchi di popolazione durante le oscillazioni gamma sono state rilevate automaticamente usando il quadrato della radice media (RMS) della registrazione filtrata. Le singole unità sono state identificate come aventi un’ampiezza di almeno tre deviazioni standard al di sopra dell’RMS, e la soglia per il rilevamento delle esplosioni ipersincrone è stata fissata a 10 deviazioni standard al di sopra dell’RMS.
Tutti i dati sono stati testati per la normalità e poi abbiamo usato sia parametrici o non parametrici test di confronto multiplo a seconda dei casi.
Test comportamentali umani (adattato da UCSD ADRC)
Tutti i test comportamentali sono stati eseguiti dall’UCSD ADRC. Sintesi dei test per i quali i livelli di CSF NPTX2 CSF hanno mostrato una correlazione di p <0,05 (Tabella 1).
Scala di valutazione della demenza (Mattis, 1988)
Il DRS è un esame di stato mentale standardizzato, a 144 punti, con le scale di attenzione (37 punti), iniziazione e perseveranza (37 punti), concettualizzazione (39 punti), costruzione (6 punti) e memoria (25 punti). Il DRS è stato somministrato secondo le istruzioni standardizzate, con l’eccezione che ogni elemento è stato somministrato ad ogni partecipante.
Sottotest di sostituzione dei simboli delle cifre (WAIS-R; [Wechsler, 1981])
In questo compito, i soggetti vengono presentati con una chiave, che associa simboli poco familiari ai numeri da 1 a 9. Viene poi chiesto loro di utilizzare la chiave per disegnare i simboli appropriati sotto una serie dei loro numeri associati il più rapidamente possibile per 90 s.
Scienza semantica verbale (Borkowski et al., 1967)
Al soggetto viene chiesto di generare oralmente il maggior numero possibile di tipi diversi di animali, frutta e verdura entro un determinato limite di tempo. Per ogni categoria, al soggetto è concesso un minuto per generare gli oggetti. Il punteggio del soggetto è il numero totale di oggetti correttamente nominati per le tre categorie. Si annotano anche le perseverazioni e gli errori di intrusione. Sebbene i test di scioltezza siano sensibili alle disfunzioni del linguaggio e al deterioramento della conoscenza semantica, possono anche riflettere la capacità di un individuo di recuperare informazioni dalla memoria semantica. Se altre abilità linguistiche, come la denominazione e la comprensione del confronto, sono intatte, la scarsa fluidità può essere dovuta all’incapacità di avviare il recupero sistematico delle informazioni nella memoria semantica(Butters et al., 1987).
Test di ordinamento delle carte del Wisconsin modificato (WCST) (Nelson, 1976)
Il Wisconsin Card Sorting Test è ampiamente accettato come misura della capacità di astrazione, che è sensibile alla patologia del lobo frontale. Nel Nelson (1976), versione modificata del test, i soggetti devono ordinare 48 schede di risposta su cui sono stampati da uno a quattro simboli (triangolo, stella, croce o cerchio) in uno dei quattro colori (rosso, verde, giallo o blu), secondo il simbolo o il colore appropriato, come indicato da una scheda di stimolo. Il test continua fino al raggiungimento di sei tipi (principi) o fino all’ordinamento di tutte le 48 schede di risposta. Viene registrato il numero di tipi ottenuti, il numero totale di piazzamenti corretti delle carte, il numero di errori perseverativi e il numero di errori non perseverativi.
Sottotest di progettazione del blocco (WISC-R; [Wechsler, 1974])
Per questo compito costruttivo, il soggetto viene presentato con quattro o nove blocchi rossi e bianchi e gli viene chiesto di costruire repliche di 11 disegni. I blocchi sono rossi su due lati, bianchi su due lati, e metà bianchi, metà rossi su due lati. I sette disegni a quattro blocchi hanno limiti di 60 o 75 s; i tre disegni a nove blocchi, limiti di due minuti. Il punteggio del soggetto dipende sia dalla precisione che dalla velocità. Per i primi due disegni a blocchi, il soggetto copia le costruzioni a blocchi dell’esaminatore; per i restanti nove disegni, copia le immagini bidimensionali dei disegni. Il Block Design Test è sensibile al precoce declino cognitivo che si verifica sia nella demenza corticale che subcorticale.
Test di riproduzione visiva (Russell Adaptation WMS; [Wechsler, 1945])
Questo test fornisce una misura della memoria per le forme geometriche. Su ciascuna delle tre prove, il soggetto deve riprodurre una figura geometrica complessa dalla memoria immediatamente dopo un periodo di studio di 10 s. In prove successive vengono presentati tre stimoli sempre più complessi che contengono da 4 a 10 componenti. Come misura di ritenzione a lungo termine, dopo 30 minuti di prove non correlate, ai soggetti viene chiesto di riprodurre nuovamente le figure dalla memoria. È stato anche somministrato un test di riconoscimento ritardato, che consiste di 18 elementi target e 18 elementi distraenti. Gli item target sono costituiti dai quattro disegni originali completi e da 14 repliche parziali dei quattro disegni originali. Infine, al soggetto viene chiesto di copiare semplicemente le cifre dello stimolo per valutare eventuali disfunzioni visuo-percettive che possono contaminare le prestazioni della memoria visiva. Le riproduzioni del soggetto vengono valutate in base al numero di componenti presenti nei disegni originali degli stimoli.
Test di apprendimento verbale della California (Delis et al., 1987)
La CVLT è un’attività di list-learning che valuta molteplici parametri cognitivi associati all’apprendimento e alla memoria, fornendo così una valutazione del processo di apprendimento e una misura di quante informazioni vengono acquisite e conservate. Su ognuna delle 5 prove, 16 parole vengono presentate oralmente al ritmo di una parola al secondo e si ottiene un immediato richiamo libero delle parole. Le 16 parole sono composte da quattro parole di ciascuna delle quattro categorie semantiche. Subito dopo la quinta prova di presentazione/richiamo con la lista originale, viene presentata una singola prova di presentazione/richiamo utilizzando una nuova lista (lista B) di 16 parole. Al soggetto viene poi chiesto di richiamare nuovamente le 16 parole originali, e poi di richiamare le stesse parole quando gli vengono forniti gli spunti semantici. Dopo un ritardo di 20 minuti, che viene riempito con test neuropsicologici non correlati, viene di nuovo richiesto il richiamo libero e il richiamo in cuffia della lista originale di 16 parole. Infine, viene somministrato un test di riconoscimento sì/no, composto dalle 16 parole originali e da 28 parole distraenti sparpagliate a caso.
I test per i quali nessuno dei biomarcatori del CSF ha raggiunto p<0,05 includevano Mini Mental Status Exam (MMSE), Blessed Information-Memory-Concentration Test, Boston Naming Test, Clock Drawing Command, Clock Drawing Copy. Tau mostra la correlazione (p=0,012) solo per lo studio CERAD (Consortium to Establish a Registry for Alzheimer’s Disease) solo tre recall.
Esame di stato mini-mentale (Folstein et al., 1975)
Il MMSE è una scala strutturata che valuta brevemente l’orientamento al luogo, l’orientamento al tempo, la registrazione, l’attenzione e la concentrazione, il richiamo, il linguaggio e la costruzione visiva. Viene valutata in termini di numero di voci correttamente compilate con punteggi più bassi, indicativi di prestazioni più scadenti e di un maggiore deterioramento cognitivo. Il punteggio totale varia da 0 a 30 (performance perfetta).
Test di scioltezza fonemica (Borkowski et al., 1967)
Nel test di fluidità delle lettere, al soggetto viene chiesto di generare oralmente il maggior numero possibile di parole che iniziano con le lettere ‘F,’ ‘A,’ e ‘S’, escludendo nomi propri e forme diverse della stessa parola. Per ogni lettera, al soggetto è concesso un minuto per generare le parole. La prestazione è misurata dal numero totale di parole corrette prodotte alle tre lettere. Si annotano le perseverazioni (cioè le ripetizioni di una parola corretta) e le intrusioni (cioè le parole che non iniziano con la lettera designata).
Beata Informazione-Memoria-Concentrazione (Blessed et al., 1968)
Il test consiste di 26 elementi che valutano aspetti dell’orientamento (informazioni personali, tempo e luogo), della memoria (ricordare informazioni nuove e remote) e della concentrazione (contare all’indietro, dire i mesi dell’anno all’indietro). Il test IMC viene valutato in termini di errori (da 0 (performance perfetta) a 33), con punteggi più alti che riflettono una performance più scarsa e una maggiore compromissione cognitiva.
Boston naming test (Kaplan et al., 1983)
La versione abbreviata UCSD di questo test richiede al soggetto di nominare 30 oggetti raffigurati nei disegni tracciati. I disegni sono classificati in difficoltà, con i disegni più semplici presentati per primi. Se un soggetto incontra difficoltà nel nominare un oggetto, viene fornito uno stimolo o uno spunto fonemico. Il numero di risposte spontanee e corrette, errori percettivi, circonlocuzioni, parafasie e perseverazioni sono utilizzati per valutare le prestazioni linguistiche del soggetto. Oltre a fornire misure quantitative di capacità di denominazione con e senza cueing semantico, il BNT fornisce anche preziose informazioni relative ai processi sottostanti gli errori di denominazione di un dato paziente.
Comando di disegno dell’orologio e test di copia (Goodglass e Kaplan, 1972)
Nella prima parte di questo compito costruttivo visuo-percettivo, il soggetto è tenuto a disegnare un orologio con i numeri e ad impostare le lancette alle undici e dieci. Nella seconda parte del test, il soggetto tenta di copiare l’immagine di un orologio con le lancette impostate alle undici e dieci. Rouleau e colleghi(Rouleau et al., 1992) hanno sviluppato un sistema di punteggio di 10 punti per valutare le prestazioni complessive di un individuo sulle condizioni di disegno a comando e di copia. Un massimo di 2 punti è dato per l’integrità del quadrante dell’orologio; un massimo di 4 punti per la presenza e la sequenza dei numeri; un massimo di 4 punti per la presenza e il posizionamento delle lancette.
Compito di apprendimento del CERAD Word-List (Welsh et al., 1992)
Se si ritiene che la stragrande maggioranza dei soggetti sia in grado di leggere, verrà somministrato il test di apprendimento CERAD Word-List, poiché questo test è stato ampiamente ed efficacemente utilizzato per la valutazione della demenza. Questo compito consiste nell’immediato richiamo gratuito di una lista di 10 parole valutate in tre diversi test di apprendimento. Al soggetto viene chiesto di leggere ad alta voce 10 parole stampate al ritmo di una ogni due secondi. Subito dopo la presentazione della lista, al soggetto viene chiesto di richiamare il maggior numero possibile di parole. Due ulteriori prove di apprendimento vengono immediatamente somministrate seguendo la stessa procedura. Dopo un ritardo da cinque a otto minuti pieni di test non correlati, al soggetto viene nuovamente chiesto di richiamare il maggior numero possibile di parole della lista di 10 voci (cioè il richiamo ritardato). Un punteggio di risparmio viene calcolato dividendo il numero di parole richiamate correttamente nella condizione di ritardo per il numero di parole richiamate nel terzo test di apprendimento. Viene anche gestito un compito di riconoscimento ritardato delle liste di parole. In questo compito di riconoscimento sì/no, il soggetto deve identificare le 10 voci originali di una lista di queste parole mischiate con 10 parole distraenti. Come per il Fuld Object Memory Test, il CERAD Word-List Learning Task fornisce una serie di misure di memoria efficaci per il rilevamento della demenza precoce e per la differenziazione tra le diverse forme di demenza.
Imaging del cervello umano
L’imaging è stato eseguito utilizzando sequenze di risonanza magnetica 3D ponderate in T1 basate sull’Iniziativa di Neuroimaging del morbo di Alzheimer (ADNI)(Jack et al., 2008). Per la segmentazione, NeuroQuantTM è stato utilizzato un pacchetto software di RM volumetrica basato su un atlante probabilistico (CorTechs Labs, Inc, La Jolla, CA) per ricavare volumi regionali dell’ippocampo e del corno temporale utilizzando i metodi precedentemente descritti(Brewer et al., 2009). Il punteggio di occupazione dell’ippocampo(Heister et al., 2011) è una misura del volume dell’ippocampo diviso per la somma dei volumi dell’ippocampo e del corno temporale ed è destinato a tener conto dell’espansione regionale ex-vacuo dello spazio fluido adiacente all’ippocampo tipicamente visto quando l’ippocampo si atrofizza.
Ricevitore Analisi della curva caratteristica operativa del ricevitore
Per valutare il valore diagnostico dei biomarcatori del CSF, è stata eseguita l’analisi della curva caratteristica operativa del ricevitore (ROC)(Metz, 1978). La curva ROC è stata creata tracciando il vero tasso positivo (sensibilità) rispetto al tasso di falsi positivi (100-specificità) per diversi punti di cut-off. Ogni punto della curva ROC rappresentava una coppia sensibilità/specificità corrispondente ad una particolare soglia. L’area sotto la curva ROC (AUC) indicava quanto bene si possono distinguere due gruppi diagnostici. La precisione è stata definita come la proporzione dei risultati reali nell’intera popolazione [(vero positivo + vero negativo)/(vero positivo + falso positivo + falso negativo + vero negativo + falso negativo)]. Per ogni biomarcatore del liquor, il punto di cut-off che massimizza l’indice di Youden (sensibilità + specificità -1) (Youden, 1950) è stato selezionato per calcolare l’accuratezza di un biomarcatore del liquor come test diagnostico.
Analisi statistica
Abbiamo utilizzato GraphPad PRISM versione 5 (RRID: SCR_002798) per eseguire analisi statistiche. Il test t a due code è stato impiegato per analizzare le differenze tra due gruppi. L’analisi di correlazione sono stati eseguiti da Pearson coefficiente di correlazione. Le dimensioni dei campioni di campioni umani sono state stimate mediante analisi di potenza utilizzando G*Power (RRID: SCR_013726).
References
- Angulo MC, Lambolez B, Audinat E, Hestrin S, Rossier J. Subunit composition, kinetic, and permeation properties of AMPA receptors in single neocortical nonpyramidal cells. Journal of Neuroscience. 1997; 17:6685-6696. PubMed
- Başar E, Basar E. A review of gamma oscillations in healthy subjects and in cognitive impairment. International Journal of Psychophysiology. 2013; 90:99-117. DOI | PubMed
- Blessed G, Tomlinson BE, Roth M. The association between quantitative measures of dementia and of senile change in the cerebral grey matter of elderly subjects. The British Journal of Psychiatry. 1968; 114:797-811. DOI | PubMed
- Borchelt DR, Ratovitski T, van Lare J, Lee MK, Gonzales V, Jenkins NA, Copeland NG, Price DL, Sisodia SS. Accelerated amyloid deposition in the brains of transgenic mice coexpressing mutant presenilin 1 and amyloid precursor proteins. Neuron. 1997; 19:939-945. DOI | PubMed
- Borkowski JG, Benton AL, Spreen O. Word fluency and brain damage. Neuropsychologia. 1967; 5:135-140. DOI
- Brewer JB, Magda S, Airriess C, Smith ME. Fully-automated quantification of regional brain volumes for improved detection of focal atrophy in Alzheimer disease. American Journal of Neuroradiology. 2009; 30:578-580. DOI | PubMed
- Buckner RL, Snyder AZ, Shannon BJ, LaRossa G, Sachs R, Fotenos AF, Sheline YI, Klunk WE, Mathis CA, Morris JC, Mintun MA. Molecular, structural, and functional characterization of Alzheimer’s disease: evidence for a relationship between default activity, amyloid, and memory. Journal of Neuroscience. 2005; 25:7709-7717. DOI | PubMed
- Buckner RL, Andrews-Hanna JR, Schacter DL. The brain’s default network: anatomy, function, and relevance to disease. Annals of the New York Academy of Sciences. 2008; 1124:1-38. DOI | PubMed
- Buckner RL, Sepulcre J, Talukdar T, Krienen FM, Liu H, Hedden T, Andrews-Hanna JR, Sperling RA, Johnson KA. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease. Journal of Neuroscience. 2009; 29:1860-1873. DOI | PubMed
- Butters N, Granholm E, Salmon DP, Grant I, Wolfe J. Episodic and semantic memory: a comparison of amnesic and demented patients. Journal of Clinical and Experimental Neuropsychology. 1987; 9:479-497. DOI | PubMed
- Buzsáki G, Wang XJ. Mechanisms of gamma oscillations. Annual Review of Neuroscience. 2012; 35:203-225. DOI | PubMed
- Chang MC, Park JM, Pelkey KA, Grabenstatter HL, Xu D, Linden DJ, Sutula TP, McBain CJ, Worley PF. Narp regulates homeostatic scaling of excitatory synapses on parvalbumin-expressing interneurons. Nature Neuroscience. 2010; 13:1090-1097. DOI | PubMed
- Chiang CH, Hou MF, Hung WC. Up-regulation of miR-182 by β-catenin in breast cancer increases tumorigenicity and invasiveness by targeting the matrix metalloproteinase inhibitor RECK. Biochimica Et Biophysica Acta . 2013; 1830:3067-3076. DOI | PubMed
- Cho RW, Park JM, Wolff SB, Xu D, Hopf C, Kim JA, Reddy RC, Petralia RS, Perin MS, Linden DJ, Worley PF. mGluR1/5-dependent long-term depression requires the regulated ectodomain cleavage of neuronal pentraxin NPR by TACE. Neuron. 2008; 57:858-871. DOI | PubMed
- Codispoti KE, Beason-Held LL, Kraut MA, O’Brien RJ, Rudow G, Pletnikova O, Crain B, Troncoso JC, Resnick SM. Longitudinal brain activity changes in asymptomatic Alzheimer disease. Brain and Behavior. 2012; 2:221-230. DOI | PubMed
- Comery TA, Martone RL, Aschmies S, Atchison KP, Diamantidis G, Gong X, Zhou H, Kreft AF, Pangalos MN, Sonnenberg-Reines J, Jacobsen JS, Marquis KL. Acute gamma-secretase inhibition improves contextual fear conditioning in the Tg2576 mouse model of Alzheimer’s disease. Journal of Neuroscience. 2005; 25:8898-8902. DOI | PubMed
- Csicsvari J, Hirase H, Czurkó A, Mamiya A, Buzsáki G. Oscillatory coupling of hippocampal pyramidal cells and interneurons in the behaving rat. Journal of Neuroscience. 1999; 19:274-287. PubMed
- De Strooper B, Karran E. The cellular phase of Alzheimer’s Disease. Cell. 2016; 164:603-615. DOI | PubMed
- Delis DC, Kramer JH, Kaplan E, Ober BA. The California Verbal Learning Test. Psychological Corporation: New York; 1987.
- Demanuele C, James CJ, Sonuga-Barke EJ. Distinguishing low frequency oscillations within the 1/f spectral behaviour of electromagnetic brain signals. Behavioral and Brain Functions. 2007; 3:62. DOI | PubMed
- Driscoll I, Resnick SM, Troncoso JC, An Y, O’Brien R, Zonderman AB. Impact of Alzheimer’s pathology on cognitive trajectories in nondemented elderly. Annals of Neurology. 2006; 60:688-695. DOI | PubMed
- Driscoll I, Troncoso J. Asymptomatic Alzheimer’s disease: a prodrome or a state of resilience?. Current Alzheimer Research. 2011; 8:330-335. DOI | PubMed
- Ellender TJ, Nissen W, Colgin LL, Mann EO, Paulsen O. Priming of hippocampal population bursts by individual perisomatic-targeting interneurons. Journal of Neuroscience. 2010; 30:5979-5991. DOI | PubMed
- Engel AK, Fries P, Singer W. Dynamic predictions: oscillations and synchrony in top-down processing. Nature Reviews Neuroscience. 2001; 2:704-716. DOI | PubMed
- Fisahn A, Pike FG, Buhl EH, Paulsen O. Cholinergic induction of network oscillations at 40 Hz in the hippocampus in vitro. Nature. 1998; 394:186-189. DOI | PubMed
- Fjell AM, Walhovd KB, Fennema-Notestine C, McEvoy LK, Hagler DJ, Holland D, Brewer JB, Dale AM, Alzheimer’s Disease Neuroimaging Initiative. CSF biomarkers in prediction of cerebral and clinical change in mild cognitive impairment and Alzheimer’s disease. Journal of Neuroscience. 2010; 30:2088-2101. DOI | PubMed
- Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 1975; 12:189-198. DOI | PubMed
- Fuchs EC, Zivkovic AR, Cunningham MO, Middleton S, Lebeau FE, Bannerman DM, Rozov A, Whittington MA, Traub RD, Rawlins JN, Monyer H. Recruitment of parvalbumin-positive interneurons determines hippocampal function and associated behavior. Neuron. 2007; 53:591-604. DOI | PubMed
- Geiger JR, Melcher T, Koh DS, Sakmann B, Seeburg PH, Jonas P, Monyer H. Relative abundance of subunit mRNAs determines gating and Ca2+ permeability of AMPA receptors in principal neurons and interneurons in rat CNS. Neuron. 1995; 15:193-204. DOI | PubMed
- Goodglass H, Kaplan E. The Assessment of Aphasia and Related Disorders. Lea & Fibiger: Philadelphia; 1972.
- Greicius MD, Srivastava G, Reiss AL, Menon V. Default-mode network activity distinguishes Alzheimer’s disease from healthy aging: evidence from functional MRI. PNAS. 2004; 101:4637-4642. DOI | PubMed
- Gu Y, Huang S, Chang MC, Worley P, Kirkwood A, Quinlan EM. Obligatory role for the immediate early gene NARP in critical period plasticity. Neuron. 2013; 79:335-346. DOI | PubMed
- Guttilla IK, White BA. Coordinate regulation of FOXO1 by miR-27a, miR-96, and miR-182 in breast cancer cells. Journal of Biological Chemistry. 2009; 284:23204-23216. DOI | PubMed
- Guzowski JF, McNaughton BL, Barnes CA, Worley PF. Environment-specific expression of the immediate-early gene arc in hippocampal neuronal ensembles. Nature Neuroscience. 1999; 2:1120-1124. DOI | PubMed
- Heister D, Brewer JB, Magda S, Blennow K, McEvoy LK, Alzheimer’s Disease Neuroimaging Initiative. Predicting MCI outcome with clinically available MRI and CSF biomarkers. Neurology. 2011; 77:1619-1628. DOI | PubMed
- Hirata H, Ueno K, Shahryari V, Deng G, Tanaka Y, Tabatabai ZL, Hinoda Y, Dahiya R. MicroRNA-182-5p promotes cell invasion and proliferation by down regulating FOXF2, RECK and MTSS1 genes in human prostate cancer. PLoS One. 2013; 8DOI | PubMed
- Hu JH, Park JM, Park S, Xiao B, Dehoff MH, Kim S, Hayashi T, Schwarz MK, Huganir RL, Seeburg PH, Linden DJ, Worley PF. Homeostatic scaling requires group I mGluR activation mediated by Homer1a. Neuron. 2010; 68:1128-1142. DOI | PubMed
- Huang YW, Ruiz CR, Eyler EC, Lin K, Meffert MK. Dual regulation of miRNA biogenesis generates target specificity in neurotrophin-induced protein synthesis. Cell. 2012; 148:933-946. DOI | PubMed
- Jack CR, Petersen RC, Xu YC, O’Brien PC, Smith GE, Ivnik RJ, Boeve BF, Waring SC, Tangalos EG, Kokmen E. Prediction of AD with MRI-based hippocampal volume in mild cognitive impairment. Neurology. 1999; 52:1397-1403. DOI | PubMed
- Jack CR, Bernstein MA, Fox NC, Thompson P, Alexander G, Harvey D, Borowski B, Britson PJ, L Whitwell J, Ward C, Dale AM, Felmlee JP, Gunter JL, Hill DL, Killiany R, Schuff N, Fox-Bosetti S, Lin C, Studholme C, DeCarli CS, Krueger G, Ward HA, Metzger GJ, Scott KT, Mallozzi R, Blezek D, Levy J, Debbins JP, Fleisher AS, Albert M, Green R, Bartzokis G, Glover G, Mugler J, Weiner MW. The Alzheimer’s Disease Neuroimaging Initiative (ADNI): MRI methods. Journal of Magnetic Resonance Imaging. 2008; 27:685-691. DOI | PubMed
- Jack CR, Knopman DS, Jagust WJ, Shaw LM, Aisen PS, Weiner MW, Petersen RC, Trojanowski JQ. Hypothetical model of dynamic biomarkers of the alzheimer’s pathological cascade. The Lancet Neurology. 2010; 9:119-128. DOI | PubMed
- Jack CR, Holtzman DM. Biomarker modeling of Alzheimer’s disease. Neuron. 2013; 80:1347-1358. DOI | PubMed
- Jensen KP, Covault J. Human miR-1271 is a miR-96 paralog with distinct non-conserved brain expression pattern. Nucleic Acids Research. 2011; 39:701-711. DOI | PubMed
- Jiang S, Li Y, Zhang X, Bu G, Xu H, Zhang YW. Trafficking regulation of proteins in Alzheimer’s disease. Molecular Neurodegeneration. 2014; 9DOI | PubMed
- Kamenetz F, Tomita T, Hsieh H, Seabrook G, Borchelt D, Iwatsubo T, Sisodia S, Malinow R. APP processing and synaptic function. Neuron. 2003; 37:925-937. DOI | PubMed
- Kaplan E, Goodglass H, Weintraub S. The Boston Naming Test. Lea & Fibiger: Philadelphia; 1983.
- Kimura R, Devi L, Ohno M. Partial reduction of BACE1 improves synaptic plasticity, recent and remote memories in Alzheimer’s disease transgenic mice. Journal of Neurochemistry. 2010; 113:248-261. DOI | PubMed
- Kuhn S, Johnson SL, Furness DN, Chen J, Ingham N, Hilton JM, Steffes G, Lewis MA, Zampini V, Hackney CM, Masetto S, Holley MC, Steel KP, Marcotti W. miR-96 regulates the progression of differentiation in mammalian cochlear inner and outer hair cells. PNAS. 2011; 108:2355-2360. DOI | PubMed
- Lee SJ, Wei M, Zhang C, Maxeiner S, Pak C, Calado Botelho S, Trotter J, Sterky FH, Südhof TC. Presynaptic neuronal pentraxin receptor organizes excitatory and inhibitory synapses. The Journal of Neuroscience. 2017; 37:1062-1080. DOI | PubMed
- Mattis S. Psychological Assessment Resources; 1988.
- Metz CE. Basic principles of ROC analysis. Seminars in Nuclear Medicine. 1978; 8:283-298. DOI | PubMed
- Mikuni T, Uesaka N, Okuno H, Hirai H, Deisseroth K, Bito H, Kano M. Arc/Arg3.1 is a postsynaptic mediator of activity-dependent synapse elimination in the developing cerebellum. Neuron. 2013; 78:1024-1035. DOI | PubMed
- Nelson HE. A modified card sorting test sensitive to frontal lobe defects. Cortex. 1976; 12:313-324. DOI | PubMed
- Nelson PT, Abner EL, Scheff SW, Schmitt FA, Kryscio RJ, Jicha GA, Smith CD, Patel E, Markesbery WR. Alzheimer’s-type neuropathology in the precuneus is not increased relative to other areas of neocortex across a range of cognitive impairment. Neuroscience Letters. 2009; 450:336-339. DOI | PubMed
- Noel-Storr AH, McCleery JM, Richard E, Ritchie CW, Flicker L, Cullum SJ, Davis D, Quinn TJ, Hyde C, Rutjes AW, Smailagic N, Marcus S, Black S, Blennow K, Brayne C, Fiorivanti M, Johnson JK, Köpke S, Schneider LS, Simmons A, Mattsson N, Zetterberg H, Bossuyt PM, Wilcock G, McShane R. Reporting standards for studies of diagnostic test accuracy in dementia: the STARDdem initiative. Neurology. 2014; 83:364-373. DOI | PubMed
- O’Brien RJ, Xu D, Petralia RS, Steward O, Huganir RL, Worley P. Synaptic clustering of AMPA receptors by the extracellular immediate-early gene product narp. Neuron. 1999; 23:309-323. DOI | PubMed
- O’Brien R, Xu D, Mi R, Tang X, Hopf C, Worley P. Synaptically targeted narp plays an essential role in the aggregation of AMPA receptors at excitatory synapses in cultured spinal neurons. Journal of Neuroscience. 2002; 22:4487-4498. PubMed
- Palop JJ, Chin J, Roberson ED, Wang J, Thwin MT, Bien-Ly N, Yoo J, Ho KO, Yu GQ, Kreitzer A, Finkbeiner S, Noebels JL, Mucke L. Aberrant excitatory neuronal activity and compensatory remodeling of inhibitory hippocampal circuits in mouse models of Alzheimer’s disease. Neuron. 2007; 55:697-711. DOI | PubMed
- Pelkey KA, Barksdale E, Craig MT, Yuan X, Sukumaran M, Vargish GA, Mitchell RM, Wyeth MS, Petralia RS, Chittajallu R, Karlsson RM, Cameron HA, Murata Y, Colonnese MT, Worley PF, McBain CJ. Pentraxins coordinate excitatory synapse maturation and circuit integration of parvalbumin interneurons. Neuron. 2015; 85:1257-1272. DOI | PubMed
- Pelkey KA, Barksdale E, Craig MT, Yuan X, Sukumaran M, Vargish GA, Mitchell RM, Wyeth MS, Petralia RS, Chittajallu R, Karlsson RM, Cameron HA, Murata Y, Colonnese MT, Worley PF, McBain CJ. Pentraxins coordinate excitatory synapse maturation and circuit integration of parvalbumin interneurons. Neuron. 2016; 90DOI | PubMed
- Rouleau I, Salmon DP, Butters N, Kennedy C, McGuire K. Quantitative and qualitative analyses of clock drawings in Alzheimer’s and Huntington’s disease. Brain and Cognition. 1992; 18:70-87. DOI | PubMed
- Sannerud R, Declerck I, Peric A, Raemaekers T, Menendez G, Zhou L, Veerle B, Coen K, Munck S, De Strooper B, Schiavo G, Annaert W. ADP ribosylation factor 6 (ARF6) controls amyloid precursor protein (APP) processing by mediating the endosomal sorting of BACE1. PNAS. 2011; 108:E559-E568. DOI | PubMed
- Sato N, Fukushima N, Maitra A, Matsubayashi H, Yeo CJ, Cameron JL, Hruban RH, Goggins M. Discovery of novel targets for aberrant methylation in pancreatic carcinoma using high-throughput microarrays. Cancer Research. 2003; 63:3735-3742. PubMed
- Shankar GM, Li S, Mehta TH, Garcia-Munoz A, Shepardson NE, Smith I, Brett FM, Farrell MA, Rowan MJ, Lemere CA, Regan CM, Walsh DM, Sabatini BL, Selkoe DJ. Amyloid-beta protein dimers isolated directly from Alzheimer’s brains impair synaptic plasticity and memory. Nature Medicine. 2008; 14:837-842. DOI | PubMed
- Shepherd JD, Rumbaugh G, Wu J, Chowdhury S, Plath N, Kuhl D, Huganir RL, Worley PF. Arc/Arg3.1 mediates homeostatic synaptic scaling of AMPA receptors. Neuron. 2006; 52:475-484. DOI | PubMed
- Sia GM, Béïque JC, Rumbaugh G, Cho R, Worley PF, Huganir RL. Interaction of the N-terminal domain of the AMPA receptor GluR4 subunit with the neuronal pentraxin NP1 mediates GluR4 synaptic recruitment. Neuron. 2007; 55:87-102. DOI | PubMed
- Sperling RA, Laviolette PS, O’Keefe K, O’Brien J, Rentz DM, Pihlajamaki M, Marshall G, Hyman BT, Selkoe DJ, Hedden T, Buckner RL, Becker JA, Johnson KA. Amyloid deposition is associated with impaired default network function in older persons without dementia. Neuron. 2009; 63:178-188. DOI | PubMed
- Swanson A, Willette AA, Alzheimer’s Disease Neuroimaging Initiative. Neuronal pentraxin 2 predicts medial temporal atrophy and memory decline across the Alzheimer’s disease spectrum. Brain, Behavior, and Immunity. 2016; 58:201-208. DOI | PubMed
- Thomas JB, Brier MR, Bateman RJ, Snyder AZ, Benzinger TL, Xiong C, Raichle M, Holtzman DM, Sperling RA, Mayeux R, Ghetti B, Ringman JM, Salloway S, McDade E, Rossor MN, Ourselin S, Schofield PR, Masters CL, Martins RN, Weiner MW, Thompson PM, Fox NC, Koeppe RA, Jack CR, Mathis CA, Oliver A, Blazey TM, Moulder K, Buckles V, Hornbeck R, Chhatwal J, Schultz AP, Goate AM, Fagan AM, Cairns NJ, Marcus DS, Morris JC, Ances BM. Functional connectivity in autosomal dominant and late-onset Alzheimer disease. JAMA Neurology. 2014; 71:1111-1122. DOI | PubMed
- Townsend M, Qu Y, Gray A, Wu Z, Seto T, Hutton M, Shearman MS, Middleton RE. Oral treatment with a gamma-secretase inhibitor improves long-term potentiation in a mouse model of alzheimer’s disease. Journal of Pharmacology and Experimental Therapeutics. 2010; 333:110-119. DOI | PubMed
- Tsui CC, Copeland NG, Gilbert DJ, Jenkins NA, Barnes C, Worley PF. Narp, a novel member of the pentraxin family, promotes neurite outgrowth and is dynamically regulated by neuronal activity. Journal of Neuroscience. 1996; 16:2463-2478. PubMed
- Turrigiano G. Homeostatic synaptic plasticity: local and global mechanisms for stabilizing neuronal function. Cold Spring Harbor Perspectives in Biology. 2012; 4DOI | PubMed
- Um JW, Kaufman AC, Kostylev M, Heiss JK, Stagi M, Takahashi H, Kerrisk ME, Vortmeyer A, Wisniewski T, Koleske AJ, Gunther EC, Nygaard HB, Strittmatter SM. Metabotropic glutamate receptor 5 is a coreceptor for alzheimer aβ oligomer bound to cellular prion protein. Neuron. 2013; 79:887-902. DOI | PubMed
- Vazdarjanova A, McNaughton BL, Barnes CA, Worley PF, Guzowski JF. Experience-dependent coincident expression of the effector immediate-early genes arc and homer 1a in hippocampal and neocortical neuronal networks. Journal of Neuroscience. 2002; 22:10067-10071. PubMed
- Verret L, Mann EO, Hang GB, Barth AM, Cobos I, Ho K, Devidze N, Masliah E, Kreitzer AC, Mody I, Mucke L, Palop JJ. Inhibitory interneuron deficit links altered network activity and cognitive dysfunction in alzheimer model. Cell. 2012; 149:708-721. DOI | PubMed
- Vincent JL, Snyder AZ, Fox MD, Shannon BJ, Andrews JR, Raichle ME, Buckner RL. Coherent spontaneous activity identifies a hippocampal-parietal memory network. Journal of Neurophysiology. 2006; 96:3517-3531. DOI | PubMed
- Wechsler D. A standardized memory scale for clinical use. The Journal of Psychology. 1945; 19:87-95. DOI
- Wechsler D. Psychological Corporation: New York; 1974.
- Wechsler D. Psychological Corporation: New York; 1981.
- Weiner MW, Veitch DP, Aisen PS, Beckett LA, Cairns NJ, Cedarbaum J, Green RC, Harvey D, Jack CR, Jagust W, Luthman J, Morris JC, Petersen RC, Saykin AJ, Shaw L, Shen L, Schwarz A, Toga AW, Trojanowski JQ, Alzheimer’s Disease Neuroimaging Initiative. 2014 update of the Alzheimer’s Disease Neuroimaging Initiative: A review of papers published since its inception. Alzheimer’s & Dementia. 2015; 11:e1-e120. DOI | PubMed
- Welsh KA, Butters N, Hughes JP, Mohs RC, Heyman A. Detection and staging of dementia in Alzheimer’s disease. Use of the neuropsychological measures developed for the consortium to establish a registry for Alzheimer’s Disease. Archives of Neurology. 1992; 49:448-452. DOI | PubMed
- Wu J, Petralia RS, Kurushima H, Patel H, Jung MY, Volk L, Chowdhury S, Shepherd JD, Dehoff M, Li Y, Kuhl D, Huganir RL, Price DL, Scannevin R, Troncoso JC, Wong PC, Worley PF. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent β-amyloid generation. Cell. 2011; 147:615-628. DOI | PubMed
- Xu D, Hopf C, Reddy R, Cho RW, Guo L, Lanahan A, Petralia RS, Wenthold RJ, O’Brien RJ, Worley P. Narp and NP1 form heterocomplexes that function in developmental and activity-dependent synaptic plasticity. Neuron. 2003; 39:513-528. DOI | PubMed
- Xu D, He X, Chang Y, Xu C, Jiang X, Sun S, Lin J. Inhibition of miR-96 expression reduces cell proliferation and clonogenicity of HepG2 hepatoma cells. Oncology Reports. 2013; 29:653-661. DOI | PubMed
- Youden WJ. Index for rating diagnostic tests. Cancer. 1950; 3:32-35. DOI | PubMed
- Zhang L, Gao J, Li Z, Gong Y. Neuronal pentraxin II (NPTX2) is frequently down-regulated by promoter hypermethylation in pancreatic cancers. Digestive Diseases and Sciences. 2012; 57:2608-2614. DOI | PubMed
- Zigman WB, Lott IT. Alzheimer’s disease in Down syndrome: neurobiology and risk. Mental Retardation and Developmental Disabilities Research Reviews. 2007; 13:237-246. DOI | PubMed
Fonte
Xiao M, Xu D, Craig MT, Pelkey KA, Chien C, et al. () NPTX2 and cognitive dysfunction in Alzheimer’s Disease. eLife 6e23798. https://doi.org/10.7554/eLife.23798





