Introduzione
La disuguaglianza sociale nello stato di salute, nell’accesso e nella qualità dell’assistenza sanitaria è un fenomeno globale[1]. Ad esempio, nel Regno Unito, le persone che vivono nei quartieri più svantaggiati (misurati utilizzando l’indice di deprivazione multipla al livello di super-area di uscita dello strato inferiore) hanno un’aspettativa di vita fino a 7 anni più breve, e sperimentano l’insorgenza di malattie e disabilità fino a 17 anni prima, rispetto alle persone che vivono nei quartieri meno svantaggiati[2]. Le spiegazioni per i determinanti sociali della salute sottolineano l’effetto cumulativo degli eventi lungo tutto il corso della vita sugli esiti di salute più tardi nella vita[3]. I fattori strutturali (politica e cultura), individuali (materiali, comportamentali e psicosociali) e del sistema sanitario contribuiscono alla disuguaglianza sanitaria[3].
Nei paesi ad alto reddito, gli indicatori di qualità proposti a livello di popolazione per le cure di fine vita includono la ricezione di cure palliative specialistiche, i ricoveri ospedalieri negli ultimi mesi di vita, la frequenza del pronto soccorso negli ultimi mesi di vita e il fatto che le persone siano sostenute per essere assistite nel loro luogo di residenza abituale piuttosto che in ospedale[4]. In Canada, negli Stati Uniti e nel Regno Unito, la posizione socioeconomica più bassa (SEP; misurata attraverso la deprivazione del quartiere) è associata a un aumento del rischio di morte in ospedale piuttosto che nella comunità[5-7] e a un maggior numero di ricoveri d’emergenza negli ultimi mesi di vita [8,9]. Nel Regno Unito, i miglioramenti nei casi in cui le persone muoiono – con meno persone che muoiono in ospedale e più persone che muoiono a casa o in ospedale – sono stati significativamente maggiori per coloro che sono meno indigenti [10,11]. In termini di decessi negli hospice, il divario tra i meno e i più svantaggiati è cresciuto del 25% tra il 1993-1997 e il 2008-2012 [11].
Alla fine della vita, anche all’interno di sistemi di copertura universale, le persone con risorse limitate hanno generalmente esigenze cliniche più complesse[12] e sono meno in grado di sostenere le proprie cure a casa[13]. Le persone più svantaggiate dal punto di vista socioeconomico possono anche avere scarso accesso e conoscenza dei servizi e/o comunicare meno le loro preferenze di cura[13-15]. Una conseguenza del rapido invecchiamento della popolazione è l’aumento del numero di decessi; a livello globale, i decessi aumenteranno da 57 milioni nel 2015 a 70 milioni nei prossimi 15 anni[16]. La disuguaglianza sociale in materia di salute, anche alla fine della vita, sarà probabilmente aggravata dall’invecchiamento della popolazione.
Mentre le misure della SEP sono comunemente incluse come covariate negli studi sulle cure di fine vita, vi è una notevole variazione in ciò che viene misurato e come. Le informazioni sulla disuguaglianza sociale alla fine della vita non sono state sistematicamente riassunte, anche per quanto riguarda l’ampiezza dell’effetto della SEP sui risultati. Questo limita la nostra comprensione di come la SEP si rapporta all’assistenza di fine vita, così come l’integrazione della SEP nelle valutazioni della qualità e nei piani di erogazione dei servizi.
Lo scopo di questa revisione è di identificare, sintetizzare e quantificare sistematicamente le prove esistenti sull’associazione tra SEP e l’uso dell’assistenza sanitaria nell’ultimo anno di vita, inclusi il luogo di morte, l’uso di cure acute, l’uso di cure palliative specialistiche e di cure di fine vita non specialistiche, l’uso di una pianificazione anticipata delle cure e la qualità delle cure, e di riportare come la SEP è stata misurata all’interno di questa letteratura.
Metodi
Il protocollo è stato registrato (CRD42017055686) presso PROSPERO, il registro internazionale prospettico delle revisioni sistematiche[17], e lo studio è stato condotto e riportato secondo la dichiarazione Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)(S1 PRISMA Checklist)[18] e le linee guida MOOSE[19] per la meta-analisi e le revisioni sistematiche degli studi osservazionali. Per questa revisione non è stata richiesta l’approvazione etica.
Strategia di ricerca
Le seguenti banche dati sono state ricercate dall’inizio al 1° febbraio 2019: MEDLINE, MEDLINE in process, EMBASE, PsycINFO, CINAHL e ASSIA. I termini di ricerca, compresi i titoli degli argomenti e le parole a testo libero, sono stati sviluppati in MEDLINE e poi adattati per altre banche dati(S1 Text). I documenti chiave identificati dalle recensioni di Henson (2015)[20- 24] e Gomes (2006) [7,25- 29], così come le conoscenze precedenti [30- 34], sono statiutilizzati per affinare i termini di ricerca. La consultazione con il team di revisione (FM, MM, KS e IH) ha fornito il parere di esperti per identificare i documenti mancanti e le recensioni pertinenti[35- 47], le cui liste di riferimento sono state cercate manualmente. Non sono state applicate restrizioni linguistiche, i documenti non in lingua inglese sono stati valutati per l’inclusione e i dati sono stati estratti da un madrelingua. La letteratura grigia e gli abstract di tesi e conferenze sono stati inclusi, e le richieste di dati aggiuntivi sono state inviate agli autori via e-mail.
Criteri di inclusione dello studio
Abbiamo incluso studi empirici di osservazione che riportano un’associazione tra la SEP e l’assistenza sanitaria ricevuta dagli adulti (≥18 anni) nell’ultimo anno di vita. Gli studi sono stati limitati a coloro che provengono da Paesi ad alto reddito per limitare le differenze contestuali nella disponibilità dei servizi e rafforzare le ipotesi fatte sui risultati di utilizzo preferenziale dei servizi[48]. Gli studi sono stati inclusi se rispondevano ai seguenti criteri.
- I partecipanti erano adulti con malattie maligne e non maligne in stadio avanzato o incurabile in comunità o in strutture ospedaliere che ricevono o non ricevono cure palliative specialistiche, e almeno l’80% del campione era nell’ultimo anno di vita (in base alla data del decesso o alla prognosi clinica).
- È stato riportato un indicatore della SEP, come il reddito, l’istruzione, l’occupazione, lo stato di assicurazione medica privata, il possesso di un alloggio, la qualità dell’alloggio o la deprivazione della zona. Razza ed etnia sono costrutti concettualmente separati da quelli della SEP e non rientrano nell’ambito di questa revisione[49,50].
- È stata riportata almeno una delle seguenti serie complete di risultati: luogo di decesso, ricovero per cure acute, uso di cure palliative specialistiche, uso di cure di fine vita non specialistiche, uso di una pianificazione anticipata delle cure, o qualità delle cure. I risultati sono stati selezionati in base alla conoscenza preliminare della disponibilità all’interno della letteratura. Come indicatori della qualità delle cure sono state incluse le misure di outcome dichiarate dal paziente o centrate sul paziente[51,52].
- Il disegno dello studio era empirico e osservativo, sia prospettico che retrospettivo; i disegni sperimentali, qualitativi o di caso studio non erano adatti agli obiettivi della revisione e sono stati esclusi. Sono stati esclusi anche gli studi a livello di area, in cui l’unità di analisi non era costituita da individui.
Selezione degli studi
La selezione e la de-duplicazione degli studi è stata gestita in EndNote X8 (Clarivate Analytics, Philadelphia, PA) (JD). I titoli e gli abstract recuperati dal database elettronico e le ricerche nella lista di riferimento sono stati prima vagliati e poi i testi completi degli studi potenzialmente idonei sono stati reperiti e rivisti indipendentemente da 2 autori (JD più MM, JL o RW). Il disaccordo è stato risolto attraverso la discussione con un terzo autore (KS). Più studi basati sullo stesso campione di individui sono stati trattati come duplicati; l’inclusione è stata data priorità in base alle dimensioni del campione e alla qualità dello studio.
Valutazione della qualità e classificazione delle prove
La qualità dello studio è stata valutata utilizzando la Newcastle-Ottawa Quality Assessment Scale (NOS)[53], una misura a 9 elementi sviluppata per studi osservazionali con particolare attenzione alla rappresentatività del campione, alla qualità dei dati e all’adeguatezza dell’analisi. In linea con gli obiettivi di questa revisione, la rappresentatività della coorte esposta (NOS item 1 “selezione”) è stata giudicata di alta qualità se il campione rifletteva gli strati socioeconomici del paese di origine. Su questa base, i campioni basati sulla popolazione nazionale o rappresentativi a livello nazionale non limitati dalla demografia, dalla diagnosi o dalla geografia sono stati considerati di bassa polarizzazione di campionamento e di altissima qualità. Anche gli studi che si sono adeguati per i confounder, limitando così il bias, sono stati di qualità superiore, con l’età e il sesso che sono i fattori considerati più importanti da controllare (NOS item 5 “comparabilità”). La valutazione degli articoli è stata effettuata in modo indipendente da due autori (JD e MM), con il disaccordo risolto attraverso la discussione. La forza complessiva dell’evidenza e la direzione dell’associazione tra le esposizioni e i risultati del SEP sono state classificate utilizzando un adattamento di un algoritmo precedentemente stabilito(Fig 1)[54], tenendo conto di 3 elementi chiave importanti per la classificazione degli studi – qualità, quantità e coerenza [55].
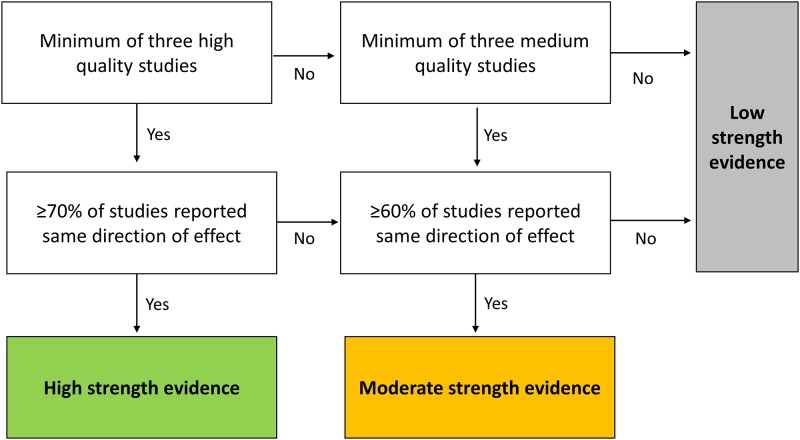
Fig. 1.Algoritmo per la valutazione della forza complessiva delle prove per ogni combinazione di esposizione e risultato del SEP, basato su qualità, quantità e coerenza delle prove[54].Gli studi di alta qualità erano quelli che avevano controllato per età e sesso in un’analisi multivariabile e avevano un punteggio NOS di ≥7. La qualità media è stata assegnata a studi che avevano controllato per età e/o sesso in un’analisi multivariabile e avevano un punteggio NOS di ≥5, o che non avevano effettuato analisi multivariabili ma avevano un punteggio NOS di ≥6. Studi di bassa qualità non avevano un’analisi multivariabile e un punteggio NOS di ≤5, o un punteggio NOS di ≤4. L’evidenza ad alta resistenza richiedeva un accordo ≥70% sulla direzione dell’associazione dei risultati dell’esposizione; l’evidenza di resistenza moderata richiedeva un accordo ≥60%. NOS, scala di valutazione della qualità Newcastle-Ottawa; SEP, posizione socioeconomica.

Fig 1.Algoritmo per la valutazione della forza complessiva dell’evidenza per ogni combinazione di esposizione e risultato del SEP, basato su qualità, quantità e coerenza dell’evidenza[54].Gli studi di alta qualità erano quelli che avevano controllato per età e sesso in un’analisi multivariabile e avevano un punteggio NOS di ≥7. La qualità media è stata assegnata a studi che avevano controllato per età e/o sesso in un’analisi multivariabile e avevano un punteggio NOS di ≥5, o che non avevano effettuato analisi multivariabili ma avevano un punteggio NOS di ≥6. Studi di bassa qualità non avevano un’analisi multivariabile e un punteggio NOS di ≤5, o un punteggio NOS di ≤4. L’evidenza ad alta resistenza richiedeva un accordo ≥70% sulla direzione dell’associazione dei risultati dell’esposizione; l’evidenza di resistenza moderata richiedeva un accordo ≥60%. NOS, scala di valutazione della qualità Newcastle-Ottawa; SEP, posizione socioeconomica.
Estrazione dei dati
Per estrarre le informazioni rilevanti dagli studi inclusi è stato utilizzato un modulo di estrazione dati pilotato. Le voci dei dati includevano le caratteristiche dello studio, le caratteristiche del campione, il tipo di misura SEP utilizzata e le stime corrette. I dati sono stati estratti da un autore (JD), e poi due autori (JL e RW) hanno controllato indipendentemente un campione del 20% per verificarne l’accuratezza; gli errori sono stati verificati attraverso la discussione e sono stati corretti.
La maggior parte degli studi ha riportato quote corrette (OR). Per gli studi che riportano i rapporti di rischio (RR), quando possibile, è stato ricavato un OR in funzione dell’RR, della proporzione di casi e della proporzione di esposti[56]. La maggior parte degli studi ha trattato le esposizioni SEP come categoriche. Alcuni studi hanno trattato le esposizioni SEP come numeriche o ordinali, riportando la dimensione di un singolo effetto per una variazione unitaria dell’esposizione. Quelle basate su una scala numerica, ad esempio il reddito in dollari USA, non potevano essere convertite in OR. Quelle basate su categorie sottostanti sono state convertite aumentando la dimensione dell’effetto al numero di categorie che separano il più alto e il più basso. Ad esempio, per uno studio che riportava una variazione di unità di OR di 0,92 che passava da una SEP alta a una SEP bassa con 5 categorie, l’OR per il gruppo SEP più basso è stato approssimato alzando lo 0,92 alla potenza di 4 (0,92 × 0,92 × 0,92 × 0,92 × 0,92 = 0,72).
Sintesi e analisi statistica
Gli studi sono stati inizialmente raggruppati in base ai risultati e alle categorie di esposizione. Per evitare il doppio conteggio dei campioni, ogni studio non ha contribuito più di una volta in ogni categoria. All’interno dello studio i duplicati, ad esempio, se sono state utilizzate due misure basate sull’area, la priorità è stata data in base all’eterogeneità con le altre misure. La maggior parte dei risultati sono stati definiti in termini di ricezione o meno di un servizio. Per il luogo di decesso, il decesso a casa, in hospice o in cure a lungo termine (LTC) è stato considerato favorevole rispetto al decesso in ospedale, in linea con l’evidenza delle preferenze per il luogo di decesso nei Paesi ad alto reddito[57]. Le misure SEP sono state descritte in termini di numero medio utilizzato negli studi, di come le misure sono state costruite come variabili binarie, categoriche o continue, e se erano misure oggettive o soggettive[50].
La meta-analisi si limitava a studi di alta e media qualità (per la definizione si veda la Fig. 1 ) che avevano utilizzato l’analisi multivariabile per ridurre la distorsione da confondere, ed erano più probabilmente rappresentativi degli strati sociali della popolazione da cui erano stati ricavati i campioni dello studio. Seguendo un approccio utilizzato altrove[58,59], è stato presentato l’OR corretto per il gruppo SEP più basso rispetto a quello più alto. Gli OR sono stati standardizzati in modo che un OR > 1 indicasse un’associazione a favore del PES alto. La forza e la direzione complessiva delle prove è stata riassunta utilizzando un diagramma influenzato da un disegno esistente[60,61]. Le regole per derivare la forza dell’evidenza sono descritte nell’algoritmo in Fig 1. La direzione è stata determinata classificando le associazioni come ‘pro-high-SEP’ o ‘pro-basso-SEP’. L’interpretazione degli effetti nulli si basa maggiormente sulla dimensione del campione, che non è incorporata nel diagramma; pertanto, a seguito di una peer review che ha evidenziato questa limitazione, gli effetti nulli non sono stati raffigurati.
Per i sottogruppi di esposizione e di risultato, quando erano disponibili sufficienti studi comparabili che presentavano gli OR per le categorie di esposizione SEP, gli OR corretti sono stati raggruppati utilizzando modelli di effetti casuali. Gli studi sulle cure acute sono stati messi in comune solo se riguardavano le cure ricevute negli ultimi 3 mesi di vita per riflettere le definizioni di cure aggressive stabilite[62]. Per una migliore comparabilità, gli studi sull’uso di cure di fine vita non specialistiche sono stati messi in comune solo quando il risultato è stato il ricevimento di cure infermieristiche o di assistenza a domicilio per i lavoratori di supporto. Sono stati attesi alti livelli di eterogeneità, data la natura osservazionale degli studi e la varietà nella misurazione del SEP e nella definizione degli esiti; l’eterogeneità è stata riportata utilizzando l’I-squared di Higgins (I2).[63] Gli studi che riportavano stime separate per sottogruppi dello stesso campione, per anno [64], genere [65], diagnosi [66], o regioni all’interno di un paese [67,68], sono stati messi in comune prima della meta-analisi con effetti fissi o casuali a seconda del livello di eterogeneità (I2). A seguito di una peer review che ha evidenziato un’incoerenza con l’approccio adottato per altri sottogruppi, sono stati messi in comune anche studi che riportavano le stime separatamente per le persone che vivono nella comunità e nei luoghi di ricovero[31,69- 72]. Abbiamo anticipato le variazioni tra i vari Paesi a causa delle differenze culturali nelle pratiche di fine vita, in particolare nei Paesi asiatici[73]. Per ogni meta-analisi messa in comune, è stata effettuata un’analisi di sensibilità utilizzando sottogruppi per paese per esplorare le differenze. Un’ulteriore analisi di sensibilità ha esaminato il cambiamento nelle stime messe in comune dopo che ciascuno degli studi è stato rimosso dalla meta-analisi.
Per esaminare una risposta di dose per gli studi che presentavano dati su almeno 3 categorie di esposizione, abbiamo usato una meta-regressione ponderata per gli effetti casuali del log-OR per ricavare una stima della risposta di dose riassunta usando il comando glst in Stata (Stata SE versione 13; StataCorp, College Station, TX)[74- 76]. Questo approccio utilizza un modello a due fasi generalizzato a minimi quadrati che prima stima il trend all’interno dello studio e poi li raggruppa per dare una stima del trend complessivo[76]. Utilizzando il metodo descritto da Hamling e colleghi[77], gli studi sono stati prima standardizzati in modo che il gruppo di riferimento fosse sempre il meno svantaggiato. La dose è stata assegnata utilizzando il rango medio relativo cumulativo per ogni gruppo SEP riportato. Ad esempio, per la deprivazione di area, se il quintile 5 (il gruppo meno deprivato) rappresentava il 33% del campione e il quintile 4 rappresentava un ulteriore 25% del campione, il rango relativo medio per il quintile 5 sarebbe stato 17 e per il quintile 4 sarebbe stato 29[58]. La dose è stata poi centrata per ogni studio in modo che la dose per il gruppo di riferimento fosse 0. Le dosi per tutti i gruppi (diversi dal gruppo di riferimento) e i corrispondenti log-odds sono stati tracciati e ispezionati visivamente per la linearità. Per gli studi che riportavano stime multiple per sottogruppi dello stesso campione, è stato incluso solo il sottogruppo più grande a causa dell’incapacità di controllare la dipendenza.
Risultati
In totale sono stati esaminati 682 articoli a testo integrale, di cui 209 sono stati inclusi nella revisione(Fig. 2).

Fig 2.Diagramma di flusso PRISMA dei documenti che riportano i numeri dei testi inclusi ed esclusi.PRISMA, Preferred Reporting Items for Systematic Reviews e Meta-Analyses; SEP, posizione socioeconomica.

Fig 2.Fig. 2. Diagramma di flusso PRISMA dei numeri di report di testi inclusi ed esclusi.PRISMA, Preferred Reporting Items per le revisioni sistematiche e le meta-analisi; SEP, posizione socioeconomica.
Sintesi degli studi inclusi
Dei 209 studi inclusi, 158 (75,6%) hanno utilizzato 1 tipo di misura SEP; il numero medio di misure per studio è stato di 1,3, e il numero massimo è stato di 6[78]. In 209 studi sono state riportate complessivamente 273 misure SEP; queste sono state classificate come privazione di superficie (29,7%), istruzione (28,9%), reddito (16,8%), assicurazione (12,8%), occupazione (4,4%), alloggio (3,3%), classe sociale (3,7%) e alfabetizzazione (0,4%). Dei 209 studi, 205 (98,1%) hanno utilizzato misure oggettive della SEP, come il livello di istruzione o di reddito dichiarato, le informazioni ottenute dai registri amministrativi, o la deprivazione della zona. Quattro studi[79- 82] hanno utilizzato misure soggettive, tutte riguardanti la sicurezza finanziaria autovalutata; 172 (82,3%) studi hanno fornito una descrizione completa o parziale della misura o delle misure della PEP, compreso il riferimento alla fonte della misura, la formulazione della domanda utilizzata o l’identificazione del set di dati in cui era contenuta la misura della PEP. In 27 (12,9%) studi, la SEP è stata la principale variabile di esposizione di interesse; 12 di questi hanno fornito una giustificazione teorica per la scelta della misura SEP.
Il punteggio medio di qualità NOS in tutti gli studi è stato di 4,8 (range: 0-10) (vedere la figura S1 per l’ istogramma dei punteggi); 97 (46,4%) di 209 studi sono stati valutati di bassa qualità, inclusi tutti e 11 gli studi sulla qualità delle cure. Un elenco completo degli studi di bassa qualità è fornito in S2 Text. I restanti 112 studi di alta e media qualità sono stati inclusi in ulteriori sintesi e meta-analisi(Tabella 1 e S3 Text). Combinati, questi studi riportano 142 risultati di interesse: più comunemente, luogo di decesso (50,7%), poi il 25,4% sull’uso di palliativi specialistici, il 13,4% sull’uso di servizi di assistenza per acuti, il 7,7% sull’uso di cure di fine vita non specialistiche, e il 2,8% sull’uso di pianificazione anticipata delle cure. La maggior parte dei dati proviene dagli Stati Uniti (34,5%), dal Canada (19,0%) o dall’Europa (escluso il Regno Unito) (21,1%); il 9,9% dal Regno Unito, l’8,5% dall’Australia, il 4,2% dalla Corea del Sud, il 2,1% da Taiwan e lo 0,7% da Singapore. Sono stati valutati otto documenti a testo completo non in lingua inglese: 2 in giapponese, 1 in tedesco, 1 in coreano e 3 in spagnolo – 3 di questi sono stati inclusi nella revisione [83-85]. L’estrazione dei dati è stata accurata per il 98,1% delle voci.
| Numero di studi che riportano ogni risultato | ||||||
|---|---|---|---|---|---|---|
| Luogo di morte (n = 72)☯ | Cura acuta(n = 19) | Cure palliative specialistiche(n = 36) | Cure di fine vita non specialistiche(n = 11) | Pianificazione anticipata della cura(n = 4) | Tutti(n = 142 risultati, riportati in 112 studi) | |
|
Tipo di misura SEP,* n (%) |
||||||
| Reddito | 7 (8.6) | 2 (10.5) | 5 (10.9) | 1 (8.3) | 2 (25.0) | 17 (10.2) |
| Educazione | 27 (33.3) | 1 (5.3) | 5 (10.9) | 2 (16.7) | 4 (50.0) | 39 (23.5) |
| Stato di assicurazione privata | 6 (7.4) | 2 (10.5) | 10 (21.7) | 4 (33.3) | 1 (12.5) | 23 (13.9) |
| Alloggiamento | 4 (4.9) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 4 (2.4) |
| Privazione di spazio | 33 (40.7) | 14 (73.7) | 26 (56.5) | 5 (41.7) | 1 (12.5) | 79 (47.6) |
| Occupazione | 4 (4.9) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 4 (2.4) |
| Paese/regione, n (%) | ||||||
| REGNO UNITO | 11 (15.3) | 3 (15.8) | 0 (0) | 0 (0) | 0 (0) | 14 (9.9) |
| Europa | 22 (30.6) | 1 (5.3) | 3 (8.3) | 4 (36.4) | 0 (0) | 30 (21.1) |
| US | 15 (20.8) | 5 (26.3) | 23 (63.9) | 3 (27.3) | 3 (75.0) | 49 (34.5) |
| Canada | 10 (13.9) | 7 (36.8) | 6 (16.7) | 4 (36.4) | 0 (0) | 27 (19.0) |
| Australia | 6 (8.3) | 2 (10.5) | 4 (11.1) | 0 (0) | 0 (0) | 12 (8.5) |
| Asia | 8 (11.1) | 1 (5.3) | 0 (0) | 0 (0) | 1 (25.0) | 10 (7.0) |
| Risultati sul cancro | ||||||
| Solo per i pazienti, n (%) | 34 (47.2) | 9 (47.4) | 22 (61.1) | 6 (54.5) | 0 (0) | 63 (44.4) |
| Periodo di studio | ||||||
| (intervallo di anni) | 1979–2015 | 1992–2015 | 1990–2014 | 1991–2013 | 1986–2013 | 1979–2015 |
| Studiare il design, n (%) | ||||||
| Prospettiva | 2 (2.8) | 0 (0) | 1 (2.8) | 1 (9.1) | 0 (0) | 4 (2.8) |
| Retrospettiva | 70 (97.2) | 19 (100) | 35 (97.2) | 10 (90.9) | 4 (100) | 138 (97.2) |
Forza e direzione dell’evidenza
LaFig. 3 mostra una sintesi delle prove di 112 studi di alta e media qualità. Abbiamo trovato una forte evidenza di un’associazione a favore dell’alta PEP tra la deprivazione dell’area e il luogo di morte, vale a dire che le persone con la PEP più bassa rispetto a quelle con la PEP più alta hanno più probabilità di morire in ospedale che a casa. C’è stata anche una moderata evidenza di un’associazione pro–high-SEP tra la deprivazione dell’area e l’uso sia di cure acute che di cure di fine vita non specialistiche. Abbiamo trovato prove moderate di un’associazione pro–high-SEP tra l’educazione e la pianificazione delle cure avanzate, così come tra la qualità dell’alloggio e il luogo di morte. Nel complesso, non ci sono prove di associazioni pro-low-SEP.
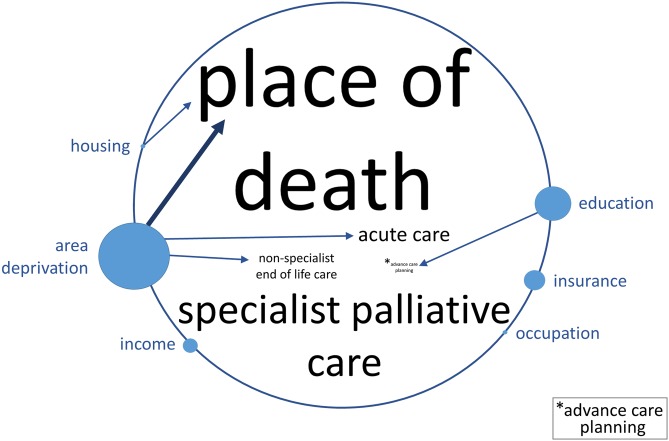
Fig. 3.Fig. 3. Diagramma che rappresenta la forza dell’evidenza e la direzione dell’associazione tra le misure di SEP e l’uso dell’assistenza sanitaria nell’ultimo anno di vita.La dimensione dei caratteri dei risultati al centro del cerchio e la dimensione del cerchio che accompagna le esposizioni SEP intorno alla circonferenza sono proporzionali al numero di studi di alta e media qualità in cui sono stati riportati i fattori (si veda il testo S4 per i numeri sottostanti e il testo S3 per i dettagli di studi, risultati ed esposizioni). La forza dell’evidenza è stata determinata utilizzando l’algoritmo della Fig. 1. Una freccia più audace rappresenta un’evidenza forte e una freccia più leggera un’evidenza moderata. Una freccia dall’esposizione all’esito indica un’associazione a favore del SEP alto, tale che il SEP più basso (rispetto al più alto) è stato associato ad un esito negativo. Non c’erano prove di associazioni pro-low-SEP. Le associazioni con bassa evidenza o con meno di 4 studi non sono rappresentate. SEP, posizione socioeconomica.

Fig. 3.Fig. 3. Diagramma che rappresenta la forza dell’evidenza e la direzione dell’associazione tra le misure di SEP e l’uso dell’assistenza sanitaria nell’ultimo anno di vita.La dimensione dei caratteri dei risultati al centro del cerchio e la dimensione del cerchio che accompagna le esposizioni SEP intorno alla circonferenza sono proporzionali al numero di studi di alta e media qualità in cui i fattori sono stati riportati (vedi S4 Testo per i numeri sottostanti e S3 Testo per i dettagli di studi, risultati ed esposizioni). La forza dell’evidenza è stata determinata utilizzando l’algoritmo della Fig. 1. Una freccia più audace rappresenta un’evidenza forte e una freccia più leggera un’evidenza moderata. Una freccia dall’esposizione all’esito indica un’associazione a favore del SEP alto, tale che il SEP più basso (rispetto al più alto) è stato associato ad un esito negativo. Non c’erano prove di associazioni pro-low-SEP. Le associazioni con bassa evidenza o con meno di 4 studi non sono rappresentate. SEP, posizione socioeconomica.
Associazione tra la deprivazione dell’area o l’istruzione e l’assistenza ricevuta verso la fine della vita.
Le figure 4 e 5 mostrano le OR e il 95% di IC per il gruppo SEP più basso (più svantaggiato) rispetto al gruppo SEP più alto (meno svantaggiato) per ogni studio, così come le OR messe in comune utilizzando modelli ad effetti casuali. Le stime messe in comune hanno rilevato che, rispetto alle persone che vivono nelle aree meno svantaggiate, le persone che vivono nelle aree più svantaggiate avevano una sala operatoria di 1,30 per l’ospedale contro la morte domiciliare (95% IC 1,23-1,38, p < 0,001), di 1,13 per non ricevere cure palliative specialistiche (95% IC 1.07-1,19, p < 0,001), di 1,16 per ricevere cure acute in ospedale negli ultimi 3 mesi di vita (95% IC 1,08-1,25, p < 0,001), e di 1,09 per non ricevere cure non specialistiche di fine vita (95% CI 0,83-1,43, p = 0,544). Le stime raccolte hanno rilevato che, rispetto alle persone più istruite, le persone meno istruite avevano una sala operatoria di 1,26 per non ricevere cure palliative specialistiche (95% CI 1,07-1,49, p = 0,005). Nel complesso, non abbiamo trovato alcuna differenza tra le persone più istruite e quelle meno istruite per le probabilità di morte in ospedale rispetto a quelle a casa, con una sala operatoria di 1,08 (95% CI 0,91-1,27, p < 0,377). Tuttavia, l’analisi per sottogruppo per paese ha trovato la stima in comune per gli studi sudcoreani in direzione opposta rispetto ad altri paesi(S2 Fig); dopo aver omesso gli studi sudcoreani, la stima in comune per le persone meno istruite rispetto a quelle più istruite è stata significativa, con una OR di 1,16 (95% CI 1,12-1,21, p < 0,001). L’eterogeneità era elevata; I2era tra l’80,1% e il 99,9% per tutte le analisi del sottogruppo – a parte il sottogruppo per l’associazione tra istruzione e uso delle cure palliative specialistiche (I2 = 32,1%, p = 0,219). Ciascuna delle OR raggruppate è cambiata solo marginalmente dopo aver omesso gli studi successivi. L’analisi della dose-risposta ha rilevato che, per un 1 quintile (1 unità moltiplicata per 10, su una scala da 0 a 50), l’aumento della deprivazione di area è aumentato di 1,07 (95% CI 1,05-1,08, p < 0, 001 ), e le probabilità di non ricevere cure palliative specialistiche sono aumentate di 1,03 (95% CI 1,02-1,05, p < 0,001) (Figg. 6 e 7, rispettivamente).
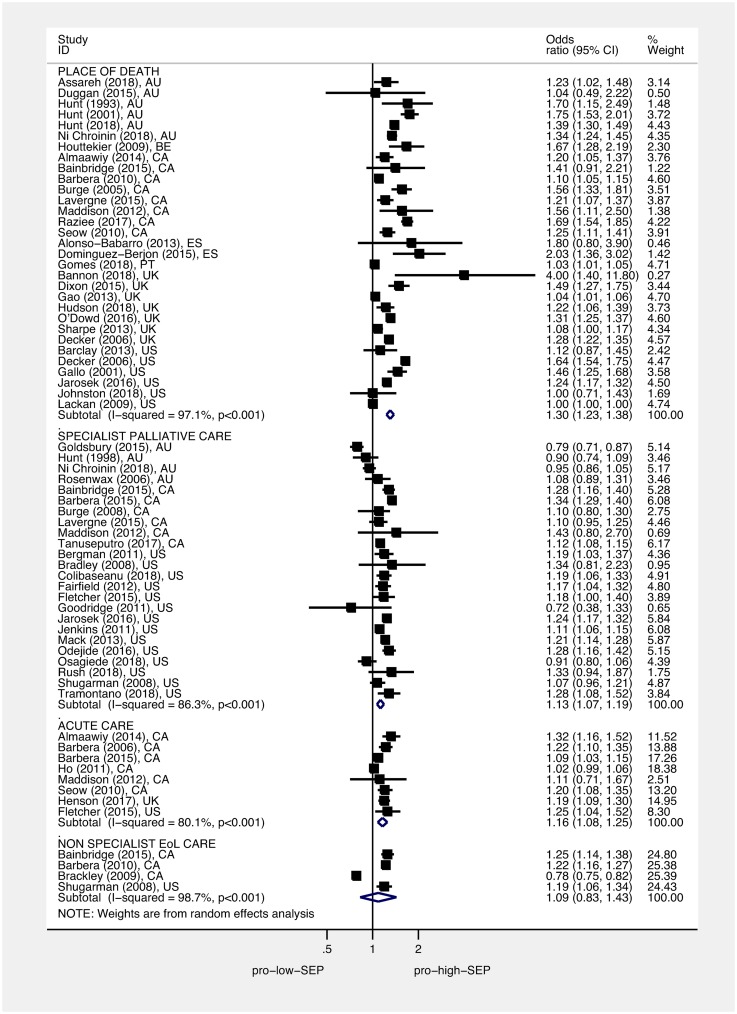
Fig 4.Associazione tra deprivazione di area e: Luogo del decesso, uso di cure acute e uso di cure palliative specialistiche.I quadrati mostrano le OR per l’area più deprivata rispetto all’area meno deprivata; i diamanti mostrano effetti raggruppati usando modelli ad effetti casuali. Luogo di decesso (decesso in ospedale contro decesso a domicilio/ospedale/LTC), uso di cure acute (uso di cure acute negli ultimi 3 mesi di vita contro nessun uso), e uso di cure palliative specialistiche (non accesso alle cure palliative specialistiche nell’ultimo anno di vita contro accesso). Le sale operatorie sono state standardizzate in modo tale che >1 indica che coloro che vivono nelle aree più svantaggiate hanno maggiori probabilità di un esito peggiore rispetto a coloro che vivono nelle aree meno svantaggiate. EoL, fine vita; LTC, assistenza a lungo termine; OR, quote di probabilità; SEP, posizione socioeconomica.
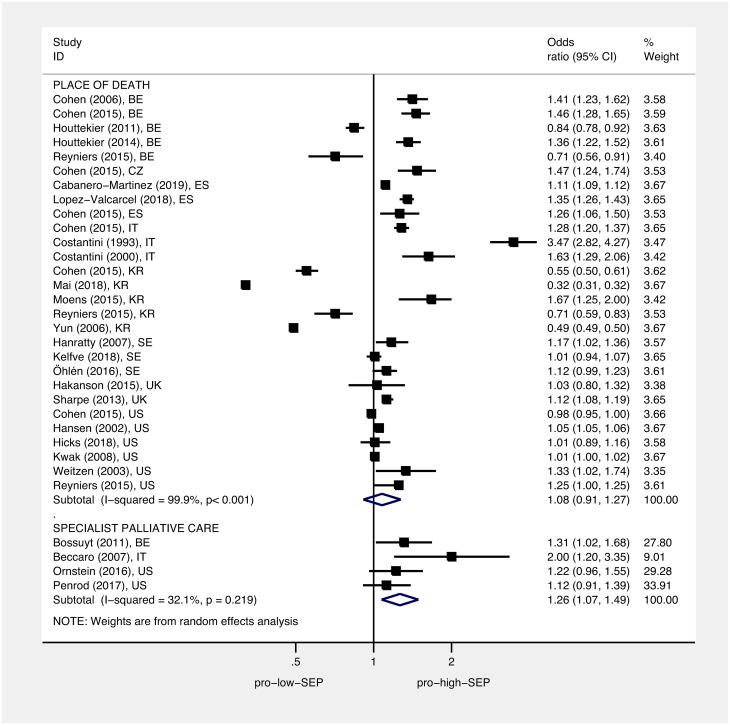
Fig. 5.Fig. 5. Associazione tra istruzione e: Luogo di morte e uso di cure palliative specialistiche.I quadrati mostrano le sale operatorie per il gruppo meno istruito rispetto al gruppo più istruito; i diamanti mostrano gli effetti combinati usando modelli di effetti casuali. Luogo di decesso (decesso in ospedale contro decesso a casa/ospedale/LTC) e uso di cure palliative specialistiche (non accesso alle cure palliative specialistiche nell’ultimo anno di vita contro accesso). Le sale operatorie sono state standardizzate in modo tale che >1 indica che i meno istruiti hanno maggiori probabilità di un esito peggiore rispetto a quelli meglio istruiti. LTC, assistenza a lungo termine; OR, quota di probabilità; SEP, posizione socioeconomica.
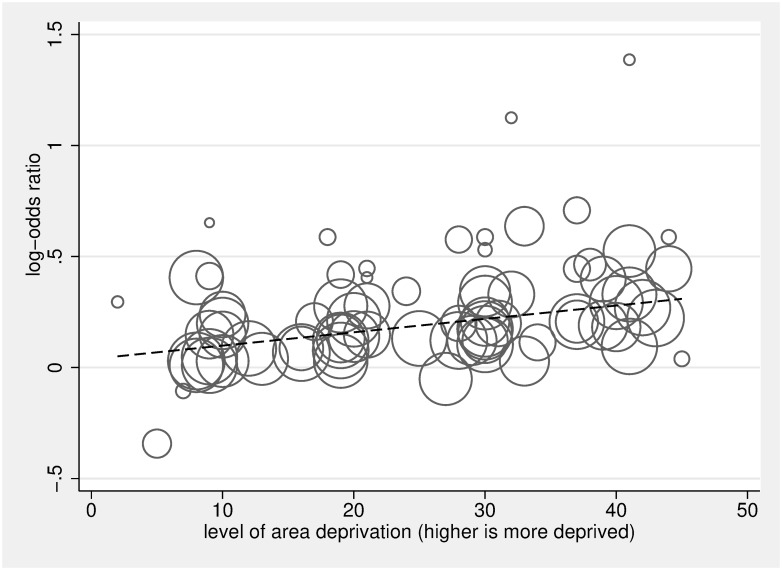
Fig 6.Fig. 6. Analisi della dose di deprivazione di area su log-odds di ospedale contro la morte a casa, rispetto al gruppo meno deprivato.Il diagramma di dispersione in Fig 6 mostra l’associazione lineare tra la dose di deprivazione dell’area (0 è meno deprivata, 50 è più deprivata) e le probabilità di morte in ospedale contro la morte a casa /ospedale / LTC, rispetto al gruppo meno deprivato. I cerchi rappresentano le stime dose-specifiche dei 20 studi inclusi[5,21,24,26,26,34,64,70,86-98]; ogni studio contribuisce con 2, 3, o 4 cerchi che riflettono il numero di categorie di deprivazione di area incluse nello studio (la categoria di riferimento, il gruppo meno deprivato, non è tracciato), e la dimensione del cerchio corrisponde all’inverso della sua varianza totale. La linea di regressione calcolata utilizzando il comando glst a 2 stadi in Stata con effetti casuali che tengono conto della dipendenza all’interno dello studio riflette una relazione positiva significativa tra la dose di deprivazione dell’area e la probabilità di morte in ospedale (per un aumento di 10× unità di dose β = 1,07, 95% CI 1,05-1,08, p < 0,001). LTC, assistenza a lungo termine.
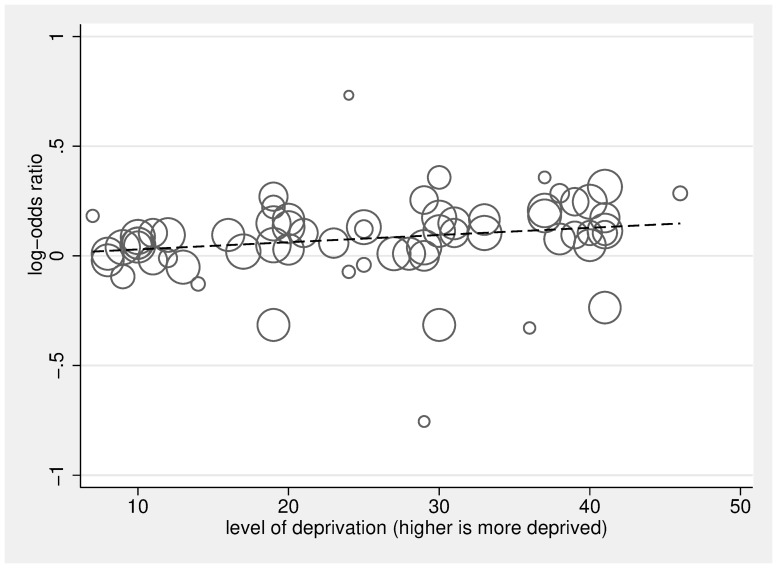
Fig. 7.Fig. 7. Analisi della dose di deprivazione di area su log-odds di non ricevere cure palliative specialistiche nell’ultimo anno di vita rispetto al gruppo meno deprivato.Il diagramma di dispersione in Fig 7 mostra l’associazione lineare tra la dose di deprivazione dell’area (0 è meno deprivata, 50 è più deprivata) e le probabilità di non ricevere cure palliative specialistiche, rispetto al gruppo meno deprivato. I cerchi rappresentano le stime dose-specifiche dei 16 studi inclusi[21,32,34,66,67,68,86,86,98- 109]; ogni studio contribuisce con 2, 3, o 4 cerchi che riflettono il numero di categorie di deprivazione di area incluse nello studio (la categoria di riferimento, il gruppo meno deprivato, non è tracciato), e la dimensione del cerchio corrisponde all’inverso della sua varianza totale. La linea di regressione calcolata utilizzando il comando glst a 2 stadi in Stata con effetti casuali che tengono conto della dipendenza all’interno dello studio riflette una relazione positiva significativa tra la dose di deprivazione di area e la probabilità di ricevere cure palliative specialistiche (per un aumento di 10× unità della dose β = 1,03, 95% CI 1,02-1,05, p < 0,001).

Fig. 4.Associazione tra la deprivazione di area e: Luogo di morte, uso di cure acute e uso di cure palliative specialistiche.I quadrati mostrano le OR per l’area più deprivata rispetto all’area meno deprivata; i diamanti mostrano effetti combinati usando modelli ad effetti casuali. Luogo di decesso (decesso in ospedale contro decesso a domicilio/ospedale/LTC), uso di cure acute (uso di cure acute negli ultimi 3 mesi di vita contro nessun uso), e uso di cure palliative specialistiche (non accesso alle cure palliative specialistiche nell’ultimo anno di vita contro accesso). Le sale operatorie sono state standardizzate in modo tale che >1 indica che coloro che vivono nelle aree più svantaggiate hanno maggiori probabilità di un esito peggiore rispetto a coloro che vivono nelle aree meno svantaggiate. EoL, fine vita; LTC, assistenza a lungo termine; OR, quote di probabilità; SEP, posizione socioeconomica.

Fig. 5.Fig. 5. Associazione tra istruzione e: Luogo di morte e uso di cure palliative specialistiche.I quadrati mostrano le sale operatorie per il gruppo meno istruito rispetto al gruppo più istruito; i diamanti mostrano gli effetti combinati usando modelli di effetti casuali. Luogo di decesso (decesso in ospedale contro decesso a casa/ospedale/LTC) e uso di cure palliative specialistiche (non accesso alle cure palliative specialistiche nell’ultimo anno di vita contro accesso). Le sale operatorie sono state standardizzate in modo tale che >1 indica che i meno istruiti hanno maggiori probabilità di un esito peggiore rispetto a quelli meglio istruiti. LTC, assistenza a lungo termine; OR, quota di probabilità; SEP, posizione socioeconomica.

Fig 6.Fig. 6. Analisi della dose di deprivazione di area su log-odds di ospedale contro la morte a casa, rispetto al gruppo meno deprivato.Il diagramma di dispersione in Fig 6 mostra l’associazione lineare tra la dose di deprivazione dell’area (0 è meno deprivata, 50 è più deprivata) e le probabilità di morte in ospedale contro la morte a casa /ospedale / LTC, rispetto al gruppo meno deprivato. I cerchi rappresentano le stime dose-specifiche dei 20 studi inclusi[5,21,24,26,26,34,64,70,86-98]; ogni studio contribuisce con 2, 3, o 4 cerchi che riflettono il numero di categorie di deprivazione di area incluse nello studio (la categoria di riferimento, il gruppo meno deprivato, non è tracciato), e la dimensione del cerchio corrisponde all’inverso della sua varianza totale. La linea di regressione calcolata utilizzando il comando glst a 2 stadi in Stata con effetti casuali che tengono conto della dipendenza all’interno dello studio riflette una relazione positiva significativa tra la dose di deprivazione dell’area e la probabilità di morte in ospedale (per un aumento di 10× unità di dose β = 1,07, 95% CI 1,05-1,08, p < 0,001). LTC, assistenza a lungo termine.

Fig. 7.Fig. 7. Analisi della dose di deprivazione di area su log-odds di non ricevere cure palliative specialistiche nell’ultimo anno di vita rispetto al gruppo meno deprivato.Il diagramma di dispersione in Fig 7 mostra l’associazione lineare tra la dose di deprivazione dell’area (0 è meno deprivata, 50 è più deprivata) e le probabilità di non ricevere cure palliative specialistiche, rispetto al gruppo meno deprivato. I cerchi rappresentano le stime dose-specifiche dei 16 studi inclusi[21,32,34,66,67,68,86,86,98- 109]; ogni studio contribuisce con 2, 3, o 4 cerchi che riflettono il numero di categorie di deprivazione di area incluse nello studio (la categoria di riferimento, il gruppo meno deprivato, non è tracciato), e la dimensione del cerchio corrisponde all’inverso della sua varianza totale. La linea di regressione calcolata utilizzando il comando glst a 2 stadi in Stata con effetti casuali che tengono conto della dipendenza all’interno dello studio riflette una relazione positiva significativa tra la dose di deprivazione di area e la probabilità di ricevere cure palliative specialistiche (per un aumento di 10× unità della dose β = 1,03, 95% CI 1,02-1,05, p < 0,001).
Discussione
Questa revisione trova prove coerenti del fatto che, nei paesi ad alto reddito, il basso PES è associato a esiti sanitari avversi verso la fine della vita, tra cui l’aumento delle probabilità di ospedalizzazione rispetto alla morte domiciliare, l’aumento delle probabilità di utilizzare i servizi di assistenza acuta negli ultimi 3 mesi di vita e la riduzione delle probabilità di ricevere cure palliative specialistiche nell’ultimo anno di vita. Un’associazione dose-risposta è evidente tra la privazione dell’area e il luogo del decesso e la ricezione di cure palliative specialistiche, il che conferma che la disuguaglianza persiste in tutto lo strato sociale. L’evidenza della disuguaglianza sociale nell’uso di cure di fine vita non specialistiche e nella pianificazione anticipata delle cure si basa su un numero minore di studi ed è meno conclusiva, ma allo stesso modo suggerisce associazioni a favore dell’alto livello di PEP. Sebbene la consapevolezza dell’associazione tra SEP e luogo di morte sia di lunga data[7,29], questa revisione è la prima a sintetizzare le prove internazionali sulla disuguaglianza sociale in diverse componenti dell’uso dei servizi di fine vita.
La maggior parte degli studi ha utilizzato una misura della SEP come descrittore campione o come controllo per confondere; le misure basate sull’area – e, in misura minore, le misure di educazione – dominano. Il luogo di morte è stato il risultato più comune studiato, che riflette l’attenzione sul luogo di morte nella ricerca sul fine vita in generale e l’ampia disponibilità di dati del registro dei decessi[110]. Sono state osservate variazioni nell’ampiezza dell’associazione tra le diverse misure di SEP; ad esempio, la deprivazione di area ha avuto un’associazione più forte (OR 1.30) rispetto all’istruzione (OR 1.08) con il luogo di morte e, al contrario, l’istruzione ha avuto un’associazione più forte (OR 1.26) rispetto alla deprivazione di area (OR 1.13) con l’uso di cure palliative specialistiche. Gli alti livelli di eterogeneità tra gli studi impediscono un confronto solido tra le OR messe in comune. Tuttavia, le differenze osservate sollevano interrogativi sull’importanza relativa dei diversi aspetti della SEP per i risultati specifici. Ad esempio, è plausibile che il livello di istruzione funga da proxy per la consapevolezza dei servizi di cure palliative specialistiche e che la consapevolezza sia un fattore di accesso più forte rispetto ad altri aspetti della SEP, come la deprivazione di aree[14]. I risultati di questa revisione supportano un’ulteriore indagine di queste differenze.
La revisione ha incluso una serie completa di risultati di fine vita. Sono stati trovati undici studi che misurano la qualità dell’assistenza utilizzando misure di outcome dichiarate dal paziente o centrate sul paziente, ma tutti di bassa qualità e quindi esclusi dalle meta-analisi. Per gli studi che riportano l’uso del servizio prima della morte, sono state fatte ipotesi su quali risultati siano preferibili sulla base della letteratura esistente[4,57,62], ad esempio, che i decessi in ospedale siano meno favorevoli rispetto a quelli a casa o che il ricovero d’emergenza negli ultimi mesi di vita rappresenti un esito negativo. L’analisi dei sottogruppi ha trovato poche variazioni da paese a paese, con le OR messe in comune che indicano significative associazioni a favore del PEP nella maggior parte dei paesi. Le RUP messe in comune dagli studi sudcoreani sull’associazione tra istruzione e luogo di morte e dagli studi australiani sull’associazione tra deprivazione dell’area e accesso a cure palliative specialistiche sono eccezioni degne di nota, entrambe suggeriscono una disuguaglianza a favore del basso PEP, anche se con intervalli di confidenza non significativi. I diversi modelli di assistenza, le norme socioculturali sulla morte e sul morire e i diversi livelli di bisogno sono potenziali spiegazioni per le differenze tra i vari paesi. Un confronto più solido tra i paesi è limitato in questa rassegna dal numero limitato di studi disponibili in ogni paese.
La SEP è un costrutto multidimensionale, poiché tali misure composite che combinano più settori sono probabilmente il mezzo più efficace per catturare la varianza statistica intorno alla SEP[49.50.111]. In questa letteratura sono comunemente utilizzati gli indici di area costituiti da molteplici indicatori della SEP, che si prestano bene a monitorare le disuguaglianze e a contabilizzare le confusioni della SEP. Tuttavia, le misure composte – basate su aree o in altri modi – sono meno informative sui meccanismi attraverso i quali il SEP può influenzare i risultati. Le misure basate sull’area, pur essendo facilmente collegabili agli indirizzi dei pazienti, sono anche limitate dalla fallacia ecologica – l’ipotesi che le persone che risiedono nella stessa area condividano tutte lo stesso profilo di deprivazione. Le misure a livello individuale della SEP comunemente usate negli studi di questa revisione – istruzione, reddito, status di assicurazione medica privata o possesso di un alloggio – hanno tutte vantaggi e sfide che riguardano la facilità di raccolta, la sufficiente sensibilità e l’adeguatezza della popolazione [112]. Essenziali per una migliore comprensione eziologica della disuguaglianza sociale alla fine della vita sono gli studi progettati specificamente per scopi che impiegano misure ben ponderate di SEP e sono guidati da ipotesi sulle relazioni tra i fattori[111].
Le spiegazioni causali per il modello sociale in altre aree della salute sono state utilmente determinate[113]. La SEP nel corso della vita influenza la salute attraverso una serie di meccanismi biologici, fisiologici e ambientali[114.115, 116]. Per l’assistenza ricevuta nell’ultimo anno di vita, i determinanti sociali prossimali come la capacità di pagare le cure, le condizioni abitative adatte a sostenere l’assistenza a casa, la comprensione e la consapevolezza della malattia e la disponibilità di servizi sono probabilmente importanti[13]. L’effetto cumulativo di un basso livello di PEP e di peggiori condizioni di salute – e le interrelazioni tra PEP e altri fattori notoriamente importanti per l’assistenza di fine vita, come il sostegno sociale, l’età, la razza e la sessualità – sono anch’essi fondamentali per comprendere e rimangono ancora largamente inesplorati nella ricerca. Studi futuri che utilizzano metodi qualitativi che generano ipotesi e che prendono in considerazione molteplici fattori sociali in combinazione attraverso modelli multilivello e strutturali – piuttosto che limitarsi a controllare per ciascuno di essi in qualità di cofondatore – potrebbero essere utilmente impiegati per indagare queste relazioni.
La valutazione degli interventi di fine vita raramente considera i risultati differenziali per i gruppi in base al SEP, e sono stati sviluppati pochi interventi per ridurre in modo specifico la disuguaglianza sociale nelle cure ricevute verso la fine della vita; a nostra conoscenza, non esiste una revisione dell’efficacia degli interventi attuali. Gli interventi che hanno dimostrato di ridurre le disuguaglianze sociali al di fuori dell’assistenza di fine vita offrono esempi promettenti, in particolare quelli rivolti alle persone anziane che condividono obiettivi simili sulla gestione dell’assistenza in contesti comunitari e sul miglioramento della qualità della vita[117.118]. Abbiamo dimostrato che la disuguaglianza sociale può persistere nell’assistenza ricevuta dalle persone verso la fine della vita; ora dobbiamo considerare quali interventi sono efficaci e cominciare a destinare le risorse alla riduzione della disuguaglianza sociale.
Ci sono alcuni limiti a questa revisione. La prima riguarda la natura osservazionale dei dati inclusi. C’è stata un’elevata eterogeneità(I2) tra gli studi che riflette la variazione nella misurazione delle esposizioni, dei risultati e dei confonditori, così come nel disegno dello studio e nella popolazione. Tuttavia, un punto di forza principale è l’inclusione di molteplici variabili di esposizione e di risultato e di un gran numero di studi osservazionali. Ciò ha reso necessario un ampio confronto tra gli studi, che in ultima analisi limita la precisione delle stime messe in comune, anche dopo l’applicazione di modelli a effetti casuali. Una seconda limitazione è la mancata contabilizzazione dei fattori legati alla malattia e alla patologia. Molti studi includevano una misura della diagnosi, della comorbilità o della gravità della malattia; questi variavano e non sono stati considerati né nella valutazione della qualità né nell’analisi. Poiché le persone con un basso livello di SEP sperimentano una maggiore malattia e un profilo di malattia – e il profilo della malattia influenza anche i modelli di utilizzo dell’assistenza sanitaria – l’inclusione di fattori correlati alla malattia come fattori fondanti nell’associazione tra SEP e i risultati studiati è probabilmente in grado di sopprimere il gradiente sociale. Detto questo, la malattia e la malattia possono anche trovarsi sul percorso causale dalla SEP agli esiti, rendendo discutibile l’inclusione dei fattori di confusione legati alla malattia negli studi che cercano di esplorare l’effetto della SEP. Nonostante ciò, l’analisi non considera l’importante influenza della malattia e di altri potenziali fattori di confusione, come la disponibilità di servizi e cure. La terza limitazione riguarda le variabili di esito. Sono state fatte delle supposizioni su quali risultati di utilizzo del servizio sono preferibili, e queste non prendono in considerazione le preferenze individuali o culturali, il bisogno o la disponibilità di cure, o come queste cambino nel tempo a livello individuale o sociale. In quarto luogo, questa revisione è stata limitata a studi provenienti da paesi ad alto reddito. Le ipotesi fatte intorno ai risultati preferibili potrebbero non applicarsi ai Paesi a basso e medio reddito in cui le esigenze sanitarie e la disponibilità di servizi di assistenza alla fine della vita sono notevolmente diverse da quelle dei Paesi ad alto reddito[119]. Non sono pertanto inclusi i dati importanti dei Paesi a basso e medio reddito. La maggior parte dei dati proviene dagli Stati Uniti, dal Canada e dall’Europa. È da notare che solo il 7,0% degli studi inclusi provenivano dall’Asia – dei 682 articoli full-text valutati per l’idoneità, 49 (7,2%) da Taiwan, 16 (2,3%) dal Giappone, 14 (2,1%) dalla Corea del Sud e 3 (<1%) da Singapore. Pertanto, le conclusioni relative ai paesi asiatici sono meno forti. Un quinto limite è la parzialità nell’identificazione degli studi. I criteri di ricerca sono stati necessariamente limitati agli studi che hanno menzionato la SEP in astratto; su questa base, 2 studi ammissibili[23,24] della rivista Henson[8] utilizzati per sviluppare la strategia di ricerca sono stati tralasciati dalla ricerca nel database, ed è probabile che, su questa base, siano stati tralasciati anche altri studi. È stato fatto un notevole sforzo per identificare gli studi mancanti, ricercando manualmente le liste di riferimento delle revisioni rilevanti e consultando gli esperti del settore. Un’ulteriore fonte di distorsioni si è verificata quando gli studi ammissibili non avevano informazioni sufficienti per essere inclusi; gli studi, ad esempio,[120.121] che non riportavano una dimensione dell’effetto quando l’associazione non era significativa non sono stati inclusi nell’analisi. Infine, data la natura osservazionale degli studi inclusi, abbiamo scelto di analizzare gli effetti rettificati per limitare i bias da confondere, e abbiamo estratto gli OR rettificati perché questi erano più comunemente usati in letteratura. Tuttavia, i risultati riportati sono comuni (>10%), e quindi gli OR sono sovrastimazioni dei rischi relativi; è necessario un ulteriore lavoro per quantificare il rischio della popolazione.
Conclusione
Abbiamo trovato prove coerenti da paesi ad alto reddito che il basso SEP è un fattore di rischio per diverse componenti dell’utilizzo dei servizi alla fine della vita, tra cui morire in ospedale piuttosto che a casa, ricevere cure acute in ospedale negli ultimi 3 mesi di vita e non ricevere cure palliative specialistiche nell’ultimo anno di vita. Abbiamo anche trovato prove di un gradiente sociale pervasivo in luogo della morte e dell’uso di cure palliative specialistiche. Questi risultati dovrebbero stimolare sforzi diffusi per ridurre le disuguaglianze socioeconomiche verso la fine della vita. Raccomandiamo che tutte le ricerche sull’assistenza ricevuta verso la fine della vita dovrebbero cercare di rendere conto della SEP, gli interventi di assistenza di fine vita dovrebbero essere analizzati per i loro diversi effetti negli strati sociali, e la pianificazione e la fornitura di servizi di assistenza di fine vita dovrebbero prendere in considerazione la SEP nelle popolazioni locali.
Informazioni di supporto
References
- Marmot M. The health gap: The challenge of an unequal world. The Lancet. 2015; 386(10011):2442-4.
- Marmot M. 2010. Fair Society, Healthy Lives: The Marmot Review: strategic review of health inequalities in England post-2010.
- WHO. A conceptual framework for action on the social determinants of health: social determinants of health discussion paper 2. World Health Organisation, Commission on the Social Determinants of Health. 2010.
- De Schreye R, Houttekier D, Deliens L, Cohen J. Developing indicators of appropriate and inappropriate end-of-life care in people with Alzheimer’s disease, cancer or chronic obstructive pulmonary disease for population-level administrative databases: A RAND/UCLA appropriateness study. Palliative Medicine. 2017; 31(10):932-45. DOI | PubMed
- Raziee H, Saskin R, Barbera L. Determinants of Home Death in Patients With Cancer: A Population-Based Study in Ontario, Canada. J Palliat Care. 2017; 32(1):11-8. DOI | PubMed
- Decker SL, Higginson IJ. A tale of two cities: factors affecting place of cancer death in London and New York. Eur J Public Health. 2007; 17(3):285-90. DOI | PubMed
- Higginson IJ, Jarman B, Astin P, Dolan S. Do social factors affect where patients die: an analysis of 10 years of cancer deaths in England. J Public Health Med. 1999; 21(1):22-8. PubMed
- Henson LA, Gao W, Higginson IJ, Smith M, Davies JM, Ellis-Smith C. Emergency Department Attendance by Patients With Cancer in Their Last Month of Life: A Systematic Review and Meta-Analysis. J Clin Oncol. 2015; 33(4):370-6. DOI | PubMed
- Sleeman KE, Perera G, Stewart R, Higginson IJ. Predictors of emergency department attendance by people with dementia in their last year of life: Retrospective cohort study using linked clinical and administrative data. Alzheimer’s & dementia: the journal of the Alzheimer’s Association. 2018; 14(1):20-7.
- Gao W, Ho YK, Verne J, Glickman M, Higginson IJ. Changing patterns in place of cancer death in England: a population-based study. PLoS Med. 2013; 10(3):e1001410. DOI | PubMed
- Sleeman KE, Davies JM, Verne J, Gao W, Higginson IJ. The changing demographics of inpatient hospice death: Population-based cross-sectional study in England, 1993–2012. Palliative Medicine. 2016; 30(1):45-53. DOI | PubMed
- Barnett K, Mercer SW, Norbury M, Watt G, Wyke S, Guthrie B. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study. Lancet. 2012; 380(9836):37-43. DOI | PubMed
- Lewis JM, DiGiacomo M, Currow DC, Davidson PM. Dying in the margins: understanding palliative care and socioeconomic deprivation in the developed world. J Pain Symptom Manage. 2011; 42(1):105-18. DOI | PubMed
- Koffman J, Burke G, Dias A, Raval B, Byrne J, Gonzales J. Demographic factors and awareness of palliative care and related services. Palliative Medicine. 2007; 21(2):145-53. DOI | PubMed
- Volandes AE, Paasche-Orlow M, Gillick MR, Cook EF, Shaykevich S, Abbo ED. Health literacy not race predicts end-of-life care preferences. J Palliat Med. 2008; 11(5):754-62. DOI | PubMed
- Bone AE, Gomes B, Etkind SN, Verne J, Murtagh FE, Evans CJ. What is the impact of population ageing on the future provision of end-of-life care? Population-based projections of place of death. Palliative Medicine. 2018; 32(2):329-36. DOI | PubMed
- . [cited 2018 Jan 3].Publisher Full Text
- Stewart LA, Clarke M, Rovers M, Riley RD, Simmonds M, Stewart G. Preferred Reporting Items for Systematic Review and Meta-Analyses of individual participant data: the PRISMA-IPD Statement. JAMA. 2015; 313(16):1657-65. DOI | PubMed
- Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of Observational Studies in Epidemiology (MOOSE) group. JAMA. 2000; 283(15):2008-12. PubMed
- Barbera L, Paszat L, Chartier C. Indicators of poor quality end-of-life cancer care in Ontario. J Palliat Care. 2006; 22(1):12-7. PubMed
- Maddison AR, Asada Y, Burge F, Johnston GW, Urquhart R. Inequalities in end-of-life care for colorectal cancer patients in Nova Scotia, Canada. J Palliat Care. 2012; 28(2):90-6. PubMed
- Seow H, Barbera L, Howell D, Dy SM. Using more end-of-life homecare services is associated with using fewer acute care services: a population-based cohort study. Med Care. 2010; 48(2):118-24. DOI | PubMed
- Ho TH, Barbera L, Saskin R, Lu H, Neville BA, Earle CC. Trends in the aggressiveness of end-of-life cancer care in the universal health care system of Ontario, Canada. Journal of Clinical Oncology: official journal of the American Society of Clinical Oncology. 2011; 29(12):1587-91. PubMed
- Almaawiy U, Pond GR, Sussman J, Brazil K, Seow H. Are family physician visits and continuity of care associated with acute care use at end-of-life? A population-based cohort study of homecare cancer patients. Palliative Medicine. 2014; 28(2):176-83. DOI | PubMed
- Costantini M, Balzi D, Garronec E, Orlandini C, Parodi S, Vercelli M. Geographical variations of place of death among Italian communities suggest an inappropriate hospital use in the terminal phase of cancer disease. Public Health. 2000; 114(1):15-20. DOI | PubMed
- Gallo WT, Baker MJ, Bradley EH. Factors associated with home versus institutional death among cancer patients in Connecticut. J Am Geriatr Soc. 2001; 49(6):771-7. PubMed
- Costantini M, Camoirano E, Madeddu L, Bruzzi P, Verganelli E, Henriquet F. Palliative home care and place of death among cancer patients: a population-based study. Palliative Medicine. 1993; 7(4):323-31. DOI | PubMed
- McCusker J. Where cancer patients die: an epidemiologic study. Public Health Rep. 1983; 98(2):170-6. PubMed
- Hunt R, Bonett A, Roder D. Trends in the terminal care of cancer patients: South Australia, 1981–1990. Aust N Z J Med. 1993; 23(3):245-51. PubMed
- Chan R, Yates P, McCarthy AL. Fatigue Self-Management Behaviors in Patients With Advanced Cancer: A Prospective Longitudinal Survey. Oncol Nurs Forum. 2016; 43(6):762-71. DOI | PubMed
- Ohlen J, Cohen J, Hakanson C. Determinants in the place of death for people with different cancer types: a national population-based study. Acta Oncol. 2016;1-7.
- Goldsbury DE, O’Connell DL, Girgis A, Wilkinson A, Phillips JL, Davidson PM. Acute hospital-based services used by adults during the last year of life in New South Wales, Australia: a population-based retrospective cohort study. BMC Health Serv Res. 2015; 15:537. DOI | PubMed
- Houttekier D, Cohen J, Pepersack T, Deliens L. Dying in hospital: a study of incidence and factors related to hospital death using death certificate data. Eur J Public Health. 2013; 24(5):751-756. DOI | PubMed
- Lavergne MR, Lethbridge L, Johnston G, Henderson D, D’Intino AF, McIntyre P. Examining palliative care program use and place of death in rural and urban contexts: a Canadian population-based study using linked data. Rural and remote health. 2015; 15(2):3134. PubMed
- Badrakalimuthu V, Barclay S. Do people with dementia die at their preferred location of death? A systematic literature review and narrative synthesis. Age Ageing. 2014; 43(1):13-9. DOI | PubMed
- Cohen LL. Racial/ethnic disparities in hospice care: A systematic review. J Palliat Med. 2008; 11(5):763-8. DOI | PubMed
- Costa V, Earle CC, Esplen MJ, Fowler R, Goldman R, Grossman D. The determinants of home and nursing home death: a systematic review and meta-analysis. BMC Palliat Care. 2016; 15:8. DOI | PubMed
- Evans N, Menaca A, Andrew EVW, Koffman J, Harding R, Higginson IJ. Systematic Review of the Primary Research on Minority Ethnic Groups and End-of-Life Care From the United Kingdom. Journal of Pain and Symptom Management. 2012; 43(2):261-286. DOI | PubMed
- Gaertner J, Siemens W, Antes G, Meerpohl JJ, Xander C, Schwarzer G. Specialist palliative care services for adults with advanced, incurable illness in hospital, hospice, or community settings-protocol for a systematic review. Systematic Reviews. 2015; 4(1)
- Gruneir A, Mor V, Weitzen S, Truchil R, Teno J, Roy J. Where people die: A multilevel approach to understanding influences on site of death in America. Med Care Res Rev. 2007; 64(4):351-78. DOI | PubMed
- Hanratty B, Holland P, Jacoby A, Whitehead M. Financial stress and strain associated with terminal cancer—A review of the evidence. Palliat Med. 2007; 21(7):595-607. DOI | PubMed
- Higginson IJ, Costantini M. Dying with cancer, living well with advanced cancer. Eur J Cancer. 2008; 44(10):1414-24. DOI | PubMed
- Lovell A, Yates P. Advance Care Planning in palliative care: a systematic literature review of the contextual factors influencing its uptake 2008–2012. Palliat Med. 2014; 28(8):1026-35. DOI | PubMed
- Murray MA, Fiset V, Young S, Kryworuchko J. Where the dying live: a systematic review of determinants of place of end-of-life cancer care. Oncol Nurs Forum. 2009; 36(1):69-77. DOI | PubMed
- Popovic M, Lao N, Bedard G, Zeng L, Zhang L, Cella D. Quality of life in patients with advanced cancer using the functional assessment of cancer therapy-general assessment tool: A literature review. World J Oncol. 2013; 4(1):8-17. DOI | PubMed
- Rodriguez AM, Gagnon B. Place of death in cancer patients: What do we know and what do we understand? A systematic and critical review of the literature. Medicina Paliativa. 2009; 16(2):111-9.
- Schildmann J, Baumann A, Cakar M, Salloch S, Vollmann J. Decisions about limiting treatment in cancer patients: A systematic review and clinical ethical analysis of reported variables. J Palliat Med. 2015; 18(10):884-92. DOI | PubMed
- . [cited 2018 Jan 3].Publisher Full Text
- Krieger N, Williams DR, Moss NE. Measuring social class in US public health research: concepts, methodologies, and guidelines. Annu Rev Public Health. 1997; 18:341-78. DOI | PubMed
- Oakes JM, Andrade KE, Oakes JM, Kaufman JS. Methods in Social Epidemiology. Jossey-Bass: San Francisco; 2017.
- Donabedian A. The quality of care. How can it be assessed?. JAMA. 1988; 260(12):1743-8. PubMed
- Etkind SN, Daveson BA, Kwok W, Witt J, Bausewein C, Higginson IJ. Capture, Transfer, and Feedback of Patient-Centered Outcomes Data in Palliative Care Populations: Does It Make a Difference? A Systematic Review. J Pain Symptom Manage. 2015; 49(3):611-24. DOI | PubMed
- . [cited 2018 Jan 3].Publisher Full Text
- Gomes B, Higginson IJ. Factors influencing death at home in terminally ill patients with cancer: systematic review. BMJ (Clinical research ed). 2006; 332(7540):515-21.
- West S, King V, Carey TS, Lohr KN, McKoy N, Sutton SF. Systems to rate the strength of scientific evidence. Evidence report/technology assessment (Summary). 2002; 47:1-11.
- . [cited 2018 Jan 3].Publisher Full Text
- Gomes B, Higginson IJ, Calanzani N, Cohen J, Deliens L, Daveson BA. Preferences for place of death if faced with advanced cancer: a population survey in England, Flanders, Germany, Italy, the Netherlands, Portugal and Spain. Ann Oncol. 2012; 23(8):2006-15. DOI | PubMed
- Lorant V, Deliege D, Eaton W, Robert A, Philippot P, Ansseau M. Socioeconomic inequalities in depression: a meta-analysis. Am J Epidemiol. 2003; 157(2):98-112. PubMed
- Weightman AL, Morgan HE, Shepherd MA, Kitcher H, Roberts C, Dunstan FD. Social inequality and infant health in the UK: systematic review and meta-analyses. BMJ Open. 2012; 2(3)
- Campos-Matos I, Russo G, Perelman J. Connecting the dots on health inequalities—a systematic review on the social determinants of health in Portugal. International journal for equity in health. 2016; 15:26. DOI | PubMed
- Ashley EA, Butte AJ, Wheeler MT, Chen R, Klein TE, Dewey FE. Clinical assessment incorporating a personal genome. Lancet. 2010; 375(9725):1525-35. DOI | PubMed
- Earle CC. Identifying potential indicators of the quality of end-of-life cancer care from administrative data. J Clin Oncol Off J Am Soc Clin Oncol. 2003; 21
- Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ (Clinical research ed). 2003; 327(7414):557-60.
- Gao Wei, H YK, Julia Verne, Emma Gordon, Higginson Irene J. Geographical and temporal Understanding In place of Death in England (1984–2010): analysis of trends and associated factors to improve end-of-life Care (GUIDE_Care)–primary research. Health Services and Delivery Research. 2014; 2(42)
- Hedinger D, Braun J, Zellweger U, Kaplan V, Bopp M, Swiss National Cohort Study G. Moving to and dying in a nursing home depends not only on health—an analysis of socio-demographic determinants of place of death in Switzerland. PLoS ONE. 2014; 9(11):e113236. DOI | PubMed
- Rosenwax LK, McNamara BA. Who receives specialist palliative care in Western Australia—And who misses out. Palliat Med. 2006; 20(4):439-45. DOI | PubMed
- Mack JW, Chen K, Boscoe FP, Gesten FC, Roohan PJ, Weeks JC. Underuse of hospice care by Medicaid-insured patients with stage IV lung cancer in New York and California. J Clin Oncol. 2013; 31(20):2569-79. DOI | PubMed
- Barbera L, Seow H, Sutradhar R, Chu A, Burge F, Fassbender K. Quality of end-of-life cancer care in Canada: a retrospective four-province study using administrative health care data. Current Oncology. 2015; 22(5):341-55. DOI | PubMed
- Kelfve S, Wastesson J, Fors S, Johnell K, Morin L. Is the level of education associated with transitions between care settings in older adults near the end of life? A nationwide, retrospective cohort study. Palliat Med. 2018; 32(2):366-75. DOI | PubMed
- Houttekier D, Cohen J, Bilsen J, Deboosere P, Verduyckt P, Deliens L. Determinants of the Place of Death in the Brussels Metropolitan Region. J Pain Symptom Manage. 2009; 37(6):996-1005. DOI | PubMed
- Houttekier D, Cohen J, Pepersack T, Deliens L. Dying in hospital: a study of incidence and factors related to hospital death using death certificate data. Eur J Public Health. 2014; 24(5):751-6. DOI | PubMed
- Hakanson C, Ohlen J, Morin L, Cohen J. A population-level study of place of death and associated factors in Sweden. Scandinavian journal of public health. 2015; 43(7):744-51. DOI | PubMed
- Keam B, Oh DY, Lee SH, Kim DW, Kim MR, Im SA. Aggressiveness of cancer-care near the end-of-life in Korea. Jpn J Clin Oncol. 2008; 38(5):381-6. DOI | PubMed
- Greenland S, Longnecker MP. Methods for trend estimation from summarized dose-response data, with applications to meta-analysis. Am J Epidemiol. 1992; 135(11):1301-9. PubMed
- Berlin JA, Longnecker MP, Greenland S. Meta-analysis of epidemiologic dose-response data. Epidemiology. 1993; 4(3):218-28. PubMed
- Orsini N, B R, Greenland S. Generalized least squares for trend estimation of summarized dose–response data. The Stata Journal. 2006; 6(1):40-57.
- Hamling J, Lee P, Weitkunat R, Ambuhl M. Facilitating meta-analyses by deriving relative effect and precision estimates for alternative comparisons from a set of estimates presented by exposure level or disease category. Stat Med. 2008; 27(7):954-70. DOI | PubMed
- Sharpe KH, Cezard G, Bansal N, Bhopal RS, Brewster DH. Policy for home or hospice as the preferred place of death from cancer: Scottish Health and Ethnicity Linkage Study population cohort shows challenges across all ethnic groups in Scotland. BMJ supportive & palliative care. 2015; 5(4):443-51. PubMed
- Fukui S, Fujita J, Tsujimura M, Sumikawa Y, Hayashi Y. Predictors of home death of home palliative cancer care patients: a cross-sectional nationwide survey. Int J Nurs Stud. 2011; 48(11):1393-400. DOI | PubMed
- Henson LA, Gomes B, Koffman J, Daveson BA, Higginson IJ, Gao W. Factors associated with aggressive end of life cancer care. Support Care Cancer. 2016; 24(3):1079-89. DOI | PubMed
- Cantwell P, Turco S, Brenneis C, Hanson J, Neumann CM, Bruera E. Predictors of home death in palliative care cancer patients. J Palliat Care. 2000; 16(1):23-8. PubMed
- Hanratty B, Jacoby A, Whitehead M. Socioeconomic differences in service use, payment and receipt of illness-related benefits in the last year of life: Findings from the British Household Panel Survey. Palliat Med. 2008; 22(3):248-55. DOI | PubMed
- Escobar Pinzon LC, Claus M, Zepf KI, Letzel S, Weber M. [Dying in Rhineland-Palatinate (Germany): preferred and actual place of death]. Gesundheitswesen. 2013; 75(12):853-8. DOI | PubMed
- Choo SY, Lee SY, Kim CW, Kim SY, Yoon TH, Shin HR. Educational differences in health care utilization in the last year of life among South Korean cancer patients. Journal of preventive medicine and public health = Yebang Uihakhoe chi. 2007; 40(1):36-44. PubMed
- Bescos Oros M, Parra Moncasi P, Coria Balanzat M, Andres Esteban EA, Bordonoba Bosque DB. Determinants of the place of death for terminal cancer patients recruited in a home care support team program in Huesca province. Medicina Paliativa. 2009; 16(2):89-94.
- Jarosek SL, Shippee TP, Virnig BA. Place of Death of Individuals with Terminal Cancer: New Insights from Medicare Hospice Place-of-Service Codes. J Am Geriatr Soc. 2016; 64(9):1815-22. DOI | PubMed
- Duggan KJ, Wiltshire J, Strutt R, Boxer M, Berthelsen A, Descallar J. Patterns of palliative and psychosocial care in stage IV NSCLC in south western Sydney. J Thorac Oncol. 2015; 2:S365.
- Burge F, Lawson B, Johnston G. Where a cancer patient dies: the effect of rural residency. J Rural Health. 2005; 21(3):233-8. PubMed
- Barbera L, Sussman J, Viola R, Husain A, Howell D, Librach SL. Factors Associated with End-of-Life Health Service Use in Patients Dying of Cancer. Healthcare Policy = Politiques de sante. 2010; 5(3):e125-43. PubMed
- Barclay JS, Kuchibhatla M, Tulsky JA, Johnson KS. Association of hospice patients’ income and care level with place of death. JAMA Internal Medicine. 2013; 173(6):450-6. DOI | PubMed
- Alonso-Babarro A, Astray-Mochales J, Dominguez-Berjon F, Genova-Maleras R, Bruera E, Diaz-Mayordomo A. The association between in-patient death, utilization of hospital resources and availability of palliative home care for cancer patients. Palliat Med. 2013; 27(1):68-75. DOI | PubMed
- Dominguez-Berjon MF, Esteban-Vasallo MD, Zoni AC, Genova-Maleras R, Astray-Mochales J. Place of death and associated factors among patients with amyotrophic lateral sclerosis in Madrid (Spain). Amyotrophic Lateral sclerosis & Frontotemporal Degeneration. 2015; 17(1–2):62-8. PubMed
- O’Dowd EL, McKeever TM, Baldwin DR, Hubbard RB. Place of Death in Patients with Lung Cancer: A Retrospective Cohort Study from 2004–2013. PLoS ONE. 2016; 11(8):e0161399. DOI | PubMed
- Assareh H, Stubbs JM, Trinh LTT, Muruganantham P, Achat HM. Variation in out-of-hospital death among palliative care inpatients across public hospitals in New South Wales. Australia. Intern Med J. 2018; 24:24.
- Bannon F, Cairnduff V, Fitzpatrick D, Blaney J, Gomes B, Gavin A. Insights into the factors associated with achieving the preference of home death in terminal cancer: A national population-based study. Palliative & Supportive Care. 2018; 16(6):749-55. PubMed
- Dixon JK, Matosevic T D. Equity in Provision of Palliative Care in the UK. Marie Curie: London; 2015.
- Hunt RW, D’Onise K, Nguyen AT, Venugopal K. Where Patients With Cancer Die: A Population-Based Study, 1990 to 2012. J Palliat Care. 2018.
- Ni Chroinin D, Goldsbury DE, Beveridge A, Davidson PM, Girgis A, Ingham N. Health-services utilisation amongst older persons during the last year of life: a population-based study. BMC Geriatr. 2018; 18(1):317. DOI | PubMed
- Fairfield KM, Murray KM, Wierman HR, Han PK, Hallen S, Miesfeldt S. Disparities in hospice care among older women dying with ovarian cancer. Gynecol Oncol. 2012; 125(1):14-8. PubMed
- Goodridge D, Buckley A, Marko J, Steeves M, Turner H, Whitehead S. Home care clients in the last year of life: Is material deprivation associated with service characteristics?. J Aging Health. 2011; 23(6):954-73. DOI | PubMed
- Bergman J, Saigal CS, Miller DC, Hanley J, Gore JL, Lorenz K. Hospice Use and High-Intensity Care in Men Dying of Prostate Cancer. Arch Intern Med. 2011; 171(3):204-10. DOI | PubMed
- Bradley CJ, Clement JP, Lin C. Absence of cancer diagnosis and treatment in elderly Medicaid-insured nursing home residents. J Natl Cancer Inst. 2008; 100(1):21-31. DOI | PubMed
- Jenkins TM, Chapman KL, Ritchie CS, Arnett DK, McGwin G, Cofield SS. Hospice use in Alabama, 2002–2005. J Pain Symptom Manage. 2011; 41(2):374-82. DOI | PubMed
- Odejide OO, Cronin AM, Earle CC, LaCasce AS, Abel GA. Hospice Use Among Patients With Lymphoma: Impact of Disease Aggressiveness and Curability. J Natl Cancer Inst. 2016; 108(1)
- Shugarman LR, Bird CE, Schuster CR, Lynn J. Age and gender differences in Medicare expenditures and service utilization at the end of life for lung cancer decedents. Womens Health Issues. 2008; 18(3):199-209. DOI | PubMed
- Tanuseputro P, Budhwani S, Bai YQ, Wodchis WP. Palliative care delivery across health sectors: A population-level observational study. Palliat Med. 2017; 31(3):247-57. DOI | PubMed
- Burge FI, Lawson BJ, Johnston GM, Grunfeld E. A Population-based Study of Age Inequalities in Access to Palliative Care Among Cancer Patients. Med Care. 2008; 46(12):1203-11. DOI | PubMed
- Rush B, Berger L, Anthony Celi L. Access to Palliative Care for Patients Undergoing Mechanical Ventilation With Idiopathic Pulmonary Fibrosis in the United States. American Journal of Hospice & Palliative Medicine. 2018; 35(3):492-6. PubMed
- Tramontano AC, Nipp R, Kong CY, Yerramilli D, Gainor JF, Hur C. Hospice use and end-of-life care among older patients with esophageal cancer. Health Science Reports. 2018; 1(9):e76. DOI | PubMed
- Davies JM, Gao W, Sleeman KE, Lindsey K, Murtagh FE, Teno JM. Using routine data to improve palliative and end of life care. BMJ Support Palliat Care. 2016; 6(3):257-62. DOI | PubMed
- Galobardes B, Lynch J, Smith GD. Measuring socioeconomic position in health research. Br Med Bull. 2007; 81-82(1):21-37. PubMed
- Grundy E, Holt G. The socioeconomic status of older adults: how should we measure it in studies of health inequalities?. J Epidemiol Community Health. 2001; 55(12):895-904. DOI | PubMed
- Ben-Shlomo Y, Kuh D. A life course approach to chronic disease epidemiology: conceptual models, empirical challenges and interdisciplinary perspectives. Int J Epidemiol. 2002; 31(2):285-93. PubMed
- Hart CL, Davey Smith G. Relation between number of siblings and adult mortality and stroke risk: 25 year follow up of men in the Collaborative study. J Epidemiol Community Health. 2003; 57(5):385-91. DOI | PubMed
- Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter. 2014; 19(Suppl 1):1-5.
- Hemingway H, Marmot M. Psychosocial factors in the aetiology and prognosis of coronary heart disease: systematic review of prospective cohort studies. BMJ (Clinical Research Ed). 1999; 318(7196):1460-7.
- Bambra C, Gibson M, Sowden A, Wright K, Whitehead M, Petticrew M. Tackling the wider social determinants of health and health inequalities: evidence from systematic reviews. J Epidemiol Community Health. 2010; 64(4):284-91. DOI | PubMed
- Mayhew LR, Smith D B. The case of Whiteley Village. The International Longevity Centre UK: London; 2017.
- Alliance WPC. (2014). Global Atlas of Palliative Care at the End of Life. World Health Organisation.
- Moens K, Houttekier D, Van den Block L, Harding R, Morin L, Marchetti S. Place of death of people living with Parkinson’s disease: a population-level study in 11 countries. BMC Palliat Care. 2015; 14:28. DOI | PubMed
- Houttekier D, Reyniers T, Deliens L, Van Den Noortgate N, Cohen J. Dying in hospital with dementia and pneumonia: A nationwide study using death certificate data. Gerontology. 2014; 60(1):31-7. DOI | PubMed
Fonte
Davies JM, Sleeman KE, Leniz J, Wilson R, Higginson IJ, et al. (2019) Socioeconomic position and use of healthcare in the last year of life: A systematic review and meta-analysis. PLoS Medicine 16(4): e1002782. https://doi.org/10.1371/journal.pmed.1002782





