Abstract
Introduzione
I virus dell’influenza in genere circolano ogni anno negli Stati Uniti, dalla fine dell’autunno all’inizio della primavera. Anche se la maggior parte delle persone con l’influenza si riprenderà senza postumi, l’influenza può causare gravi malattie e morte, in particolare tra gli adulti più anziani, i bambini molto piccoli, le donne incinte e quelli con alcune condizioni mediche croniche (1–6).
La vaccinazione antinfluenzale annuale di routine per tutte le persone di età ≥6 mesi che non hanno controindicazioni è stata raccomandata dal 2010 dal CDC e dal Comitato consultivo sulle pratiche di vaccinazione (ACIP) del CDC (7). Questo rapporto aggiorna le raccomandazioni ACIP 2016-17 riguardanti l’uso di vaccini antinfluenzali stagionali (8) e fornisce raccomandazioni e linee guida per i fornitori di vaccini per quanto riguarda l’uso di vaccini antinfluenzali per la stagione 2017-18. Sono disponibili diverse formulazioni di vaccino antinfluenzale(Tabella 1). Le controindicazioni e le precauzioni per l’uso dei vaccini antinfluenzali sono riassunte(Tabella 2). Le abbreviazioni sono utilizzate in questo rapporto per indicare i vari tipi di vaccini(Box).
| Nome commerciale | Produttore | Presentazione | Indicazione dell’età | Mercurio (dal timerosale, µ g/0,5 mL) | Lattice | Percorso |
|---|---|---|---|---|---|---|
| Vaccini antinfluenzali inattivati, quadrivalente (IIV4s), dose standard† | ||||||
| Afluria Quadrivalente | Seqirus | 0,5 mL siringa preriempita | ≥18 anni | NR | No | IM§ |
| Fiala multidose da 5,0 ml | ≥18 anni (per ago/siringa) da 18 a 64 anni (per iniettore a getto) | 24.5 | No | IM | ||
| Fluarix Quadrivalente | GlaxoSmithKline | 0,5 mL siringa preriempita | ≥3 anni | NR | No | IM |
| FluLaval Quadrivalente | ID Biomedical Corp. of Quebec (distribuito da GlaxoSmithKline) | 0,5 mL siringa preriempita | ≥6 mesi | NR | No | IM |
| Fiala multidose da 5,0 mL | ≥6 mesi | <25 | No | IM | ||
| Fluzone Quadrivalente | Sanofi Pasteur | 0,25 mL siringa preriempita | Da 6 a 35 mesi | NR | No | IM |
| 0,5 mL siringa preriempita | ≥3 anni | NR | No | IM | ||
| Fiala monodose da 0,5 mL | ≥3 anni | NR | No | IM | ||
| Fiala multidose da 5,0 mL | ≥6 mesi | 25 | No | IM | ||
| Vaccino antinfluenzale inattivato, quadrivalente (ccIIV4), dose standard,† cultura cellulare | ||||||
| Flucelvax Quadrivalente | Seqirus | 0,5 mL siringa preriempita | ≥4 anni | NR | No | IM |
| Fiala multidose da 5,0 mL | ≥4 anni | 25 | No | IM | ||
| Vaccino antinfluenzale inattivato, quadrivalente (IIV4), a dosi standard, intradermico¶ | ||||||
| Fluzone Intradermal Quadrivalente Intradermico | Sanofi Pasteur | 0,1 mL sistema di microiniezione monodose precaricato a microiniezione | Da 18 a 64 anni | NR | No | ID** |
| Vaccini antinfluenzali inattivati, trivalenti (IIV3), a dose standard† | ||||||
| Afluria | Seqirus | 0,5 mL siringa preriempita | ≥5 anni | NR | No | IM |
| Fiala multidose da 5,0 mL | ≥5 anni (per ago/siringa) da 18 a 64 anni (per iniettore a getto) | 24.5 | No | IM | ||
| Fluvirin | Seqirus | 0,5 mL siringa preriempita | ≥4 anni | ≤1 | S솆 | IM |
| Fiala multidose da 5,0 mL | ≥4 anni | 25 | No | IM | ||
| Vaccino antinfluenzale inattivato adiuvato, trivalente (aIIV3),† dose standard | ||||||
| Fluad | Seqirus | 0,5 mL siringa preriempita | ≥65 anni | NR | S솆 | IM |
| Vaccino antinfluenzale inattivato, trivalente (IIV3), ad alto dosaggio§§ | ||||||
| Fluzone ad alta dose | Sanofi Pasteur | 0,5 mL siringa preriempita | ≥65 anni | NR | No | IM |
| Vaccino influenzale ricombinante, quadrivalente (RIV4)¶¶ | ||||||
| Flublok Quadrivalente | Scienze delle proteine | 0,5 mL siringa preriempita | ≥18 anni | NR | No | IM |
| Vaccino per l’influenza ricombinante, trivalente (RIV3)¶¶ | ||||||
| Flublok | Scienze delle proteine | Fiala monodose da 0,5 mL | ≥18 anni | NR | No | IM |
| Vaccino antinfluenzale attivo, quadrivalente (LAIV4)*** (non raccomandato per l’uso durante la stagione 2017-18) | ||||||
| FluMist Quadrivalente | MedImmune | Nebulizzatore intranasale monodose da 0,2 mL pre-riempito | Da 2 a 49 anni | NR | No | NAS |
| Tipo di vaccino | Controindicazioni | Precauzioni |
|---|---|---|
| IIV | Cronologia di una grave reazione allergica a qualsiasi componente del vaccino† o dopo una precedente dose di qualsiasi vaccino antinfluenzale | Malattia acuta da moderata a grave con o senza febbre Storia della sindrome di Guillain-Barré entro 6 settimane dal ricevimento del vaccino antinfluenzale |
| RIV | Storia di grave reazione allergica a qualsiasi componente del vaccino | Malattia acuta da moderata a grave con o senza febbre Storia della sindrome di Guillain-Barré entro 6 settimane dal ricevimento del vaccino antinfluenzale |
| LAIV, per la stagione 2017-18, ACIP raccomanda di non utilizzare LAIV. Il contenuto è fornito a titolo informativo. | Cronologia di una reazione allergica grave a qualsiasi componente del vaccino† o dopo una precedente dose di qualsiasi vaccino antinfluenzale †Aspirina concomitante o terapia contenente salicilato nei bambini e negli adolescentiBambini di età compresa tra i 2 e i 4 anni che hanno ricevuto una diagnosi di asma o i cui genitori o chi si prende cura di loro riferiscono che un operatore sanitario ha detto loro, nei 12 mesi precedenti, che il loro bambino ha avuto un respiro affannoso o asma o la cui cartella clinica indica che si è verificato un episodio di respiro affannoso nei 12 mesi precedenti.Bambini e adulti che sono immunocompromessi a causa di qualsiasi causa (compresa l’immunosoppressione causata da farmaci o da infezione da HIV), che hanno perso i contatti e si prendono cura di persone gravemente immunosoppresse che hanno bisogno di un ambiente protetto, che hanno bisogno di un ambiente protetto, che hanno ricevuto un farmaco antivirale contro l’influenza nelle 48 ore precedenti. | Malattia acuta da moderata a grave con o senza febbreStoria della sindrome di Guillain-Barré entro 6 settimane dal ricevimento del vaccino antinfluenzale Asma in persone di età ≥5 anni Altre condizioni mediche sottostanti che potrebbero predisporre a complicazioni dopo un’infezione influenzale di tipo selvaggio (ad esempio, disturbi polmonari cronici, cardiovascolari [eccetto l’ipertensione isolata], renali, epatici, neurologici, ematologici o metabolici [incluso il diabete mellito]) |
Questo rapporto si concentra sulle raccomandazioni per l’uso di vaccini antinfluenzali per la prevenzione e il controllo dell’influenza durante la stagione 2017-18 negli Stati Uniti. Una sintesi di queste raccomandazioni e un documento di base contenente ulteriori informazioni sulle malattie associate all’influenza e sui vaccini antinfluenzali è disponibile all’indirizzo https://www.cdc.gov/vaccines/hcp/acip-recs/vacc-specific/flu.html.
Metodi
ACIP fornisce raccomandazioni annuali per l’uso di vaccini antinfluenzali per la prevenzione e il controllo dell’influenza. Il gruppo di lavoro sull’influenza dell’ACIP si riunisce in teleconferenza da una a due volte al mese durante tutto l’anno. Il gruppo di lavoro comprende diversi membri votanti di ACIP e rappresentanti delle organizzazioni di collegamento di ACIP.* Le discussioni includono argomenti come la sorveglianza dell’influenza, l’efficacia e la sicurezza del vaccino, la copertura del vaccino, la fattibilità del programma, l’efficacia dei costi e la fornitura del vaccino. Le presentazioni sono richieste agli esperti invitati e vengono discussi dati pubblicati e non pubblicati.
In generale, il documento di base viene aggiornato per riflettere le recenti aggiunte alla letteratura relative a quanto segue: 1) raccomandazioni che sono state fatte nelle stagioni precedenti, 2) cambiamenti nella composizione dell’antigene virale dei vaccini antinfluenzali stagionali, e 3) piccoli cambiamenti nelle linee guida per l’uso dei vaccini antinfluenzali (ad esempio, linee guida per la tempistica della vaccinazione e altre questioni programmatiche, linee guida per il dosaggio in popolazioni specifiche, linee guida per la selezione dei vaccini per popolazioni specifiche che sono già raccomandate per la vaccinazione, e cambiamenti che riflettono l’uso coerente con le indicazioni e le informazioni di prescrizione della Food and Drug Administration [FDA]). Il riassunto incluso nel documento di riferimento per tali argomenti non è una revisione sistematica, ma intende fornire un’ampia panoramica della letteratura attuale. In generale, la revisione sistematica e la valutazione delle prove utilizzando l’approccio Grading of Recommendations, Assessment, Development and Evaluation (GRADE) viene eseguita per nuove raccomandazioni o modifiche sostanziali delle raccomandazioni (ad esempio, l’estensione della raccomandazione per la vaccinazione antinfluenzale a nuove popolazioni non precedentemente raccomandate per la vaccinazione o potenziali raccomandazioni preferenziali per vaccini specifici).
Gli aggiornamenti e le modifiche alle raccomandazioni descritte in questo rapporto sono di cinque tipi: 1) la composizione del virus del vaccino per il 2017-18 U.S.A. vaccini antinfluenzali stagionali; 2) le recenti azioni normative, incluse le nuove licenze dei vaccini e le modifiche all’etichettatura per i vaccini precedentemente autorizzati; 3) le raccomandazioni aggiornate per l’uso dei vaccini antinfluenzali in gravidanza, inclusa la raccomandazione che le donne in gravidanza possano ricevere qualsiasi vaccino antinfluenzale autorizzato, raccomandato e adatto all’età; 4) una raccomandazione che il vaccino trivalente inattivato contro l’influenza (IIV3) Afluria (Seqirus, Parkville, Victoria, Australia) possa essere usato per persone di età ≥5 anni, in linea con l’etichettatura approvata dalla FDA; e 5) una raccomandazione (continuata dalla stagione 2016-17) che LAIV4 non venga usato durante la stagione 2017-18. Per questi aggiornamenti e modifiche non sono state effettuate revisioni sistematiche e GRADE. Le informazioni rilevanti per tali modifiche includono quanto segue:
- Le raccomandazioni per la composizione dei vaccini antinfluenzali dell’emisfero nord sono fatte dall’Organizzazione Mondiale della Sanità (OMS), che organizza una consultazione, generalmente nel mese di febbraio di ogni anno. I dati di sorveglianza vengono esaminati e vengono discussi i virus candidati al vaccino. Una sintesi della riunione dell’OMS per la selezione dei virus vaccini dell’emisfero settentrionale 2017-18 è disponibile sul sito http://www.who.int/influenza/vaccines/virus/recommendations/201703_recommendation.pdf. Successivamente, l’FDA, che ha l’autorità di regolamentazione sui vaccini negli Stati Uniti, convoca una riunione del suo Vaccines and Related Biological Products Advisory Committee (VRBPAC). Questo comitato prende in considerazione le raccomandazioni dell’OMS, esamina e discute dati simili e prende una decisione finale sulla composizione del virus del vaccino per i vaccini antinfluenzali autorizzati e commercializzati negli Stati Uniti. Una sintesi della riunione del VRBPAC della FDA del 9 marzo 2017, in cui è stata discussa la composizione dei vaccini antinfluenzali statunitensi 2017-18, è disponibile all’indirizzo https://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/BloodVaccinesandOtherBiologics/VaccinesandRelatedBiologicalProductsAdvisoryCommittee/UCM552054.pdf.
- Per quanto riguarda le raccomandazioni per i nuovi vaccini antinfluenzali autorizzati e le modifiche alle indicazioni autorizzate per i vaccini esistenti, l’ACIP si affida alla FDA per la revisione dei dati sulla sicurezza, l’immunogenicità e l’efficacia dei vaccini antinfluenzali autorizzati. Le informazioni normative relative ai due prodotti con licenza recente e una modifica dell’etichettatura discussa in questo rapporto sono disponibili su https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm518291.htm (per Afluria Quadrivalent; Seqirus, Parkville, Victoria, Australia), https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm524660.htm (per Flublok Quadrivalent; Protein Sciences, Meriden, Connecticut) e https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm366061.htm (per FluLaval Quadrivalent; ID Biomedical Corporation of Quebec, Quebec City, Quebec, Canada).
- Per la raccomandazione che le donne in gravidanza possano ricevere qualsiasi vaccino antinfluenzale autorizzato, raccomandato e adatto all’età, poiché non sono stati condotti studi che valutino l’uso di RIV3 o RIV4 in gravidanza, l’ACIP ha esaminato le informazioni disponibili presentate dal produttore e riassunte in documenti pubblici della FDA riguardanti le gravidanze che si sono verificate tra le donne che hanno partecipato a studi sul RIV e i dati del registro delle gravidanze. Sono stati presentati anche i rapporti del RIV al Vaccine Adverse Event Reporting System (VAERS). Le informazioni normative pertinenti a questa discussione sono disponibili all’indirizzo https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm524660.htm.
- Per la raccomandazione che Afluria (IIV3; Seqirus, Parkville, Victoria, Australia) possa essere utilizzato per le persone di età ≥5 anni, ACIP ha esaminato i dati degli studi effettuati dal produttore riguardanti la causa di un aumento del tasso di crisi febbrili che si è verificato in associazione con la formulazione 2010 dell’emisfero australe di questo prodotto, e le conseguenti modifiche nel processo di produzione del vaccino. Questo cambiamento rende la raccomandazione ACIP coerente con l’etichettatura approvata dalla FDA per questo prodotto. Il verbale della presentazione ACIP di questi dati è disponibile all’indirizzo https://www.cdc.gov/vaccines/acip/meetings/downloads/min-archive/min-2017-02.pdf. Le informazioni sulla regolamentazione sono disponibili all’indirizzo https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm094043.htm.
- La raccomandazione di non utilizzare LAIV4 a causa delle preoccupazioni relative alla sua efficacia contro i virus dell’influenza A(H1N1)pdm09 durante le stagioni 2013-14 e 2015-16 è stata inizialmente formulata per la stagione 2016-17 (9). Questa raccomandazione continua ad essere fatta per la stagione 2017-18. ACIP continuerà a rivedere i dati relativi a LAIV4 non appena saranno disponibili.
Principali modifiche e aggiornamenti delle raccomandazioni
La vaccinazione antinfluenzale annuale di routine di tutte le persone di età ≥6 mesi senza controindicazioni continua ad essere raccomandata. Non viene raccomandata alcuna raccomandazione preferenziale per un prodotto vaccinale antinfluenzale rispetto ad un altro per le persone per le quali è disponibile più di un prodotto autorizzato e raccomandato. Le informazioni e le linee guida aggiornate di questo rapporto comprendono quanto segue:
- I vaccini trivalenti antinfluenzali statunitensi 2017-18 conterranno un virus A/Michigan/45/2015 (H1N1)pdm09-like, un virus A/Hong Kong/4801/2014 (H3N2)-like virus e un virus B/Brisbane/60/2008-like (lignaggio Victoria). I vaccini quadrivalenti includeranno un ulteriore ceppo di virus vaccinale, un virus B/Phuket/3073/2013-like (lignaggio Yamagata). Questo rappresenta un cambiamento nella componente del virus dell’influenza A(H1N1)pdm09 rispetto alla stagione precedente.
- Sono descritte le recenti azioni normative, tra cui due nuove licenze e una modifica dell’etichettatura:
- Afluria Quadrivalent (IIV4; Seqirus, Parkville, Victoria, Australia) è stato autorizzato dalla FDA nell’agosto 2016 per persone di età ≥18 anni. Le informazioni sulla regolamentazione sono disponibili all’indirizzo https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm518291.htm.
- Flublok Quadrivalent (RIV4; Protein Sciences, Meriden, Connecticut) è stato autorizzato dalla FDA nell’ottobre 2016, per persone di età ≥18 anni. Le informazioni sulla regolamentazione sono disponibili all’indirizzo https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm524660.htm.
- L’indicazione dell’età per FluLaval Quadrivalent (IIV4; ID Biomedical Corporation of Quebec, Quebec City, Quebec, Canada) è stata estesa da ≥3 anni a ≥6 mesi nel novembre 2016. Le informazioni sulla regolamentazione sono disponibili all’indirizzo https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm366061.htm. I bambini dai 6 ai 35 mesi di età possono ricevere il Quadrivalente FluLaval alla stessa dose di 0,5 mL (contenente 15 µ g diemoagglutinina [HA] per virus vaccinale) utilizzata per i bambini più grandi e gli adulti. Questa licenza crea un’opzione aggiuntiva per la vaccinazione dei bambini dai 6 ai 35 mesi, in aggiunta ai 0,25 ml per dose precedentemente disponibili (contenenti 7,5 µ g diHA per virus vaccinale) di Fluzone Quadrivalent (IIV4; Sanofi Pasteur, Swiftwater, Pennsylvania).
- Le donne in gravidanza possono ricevere qualsiasi vaccino antinfluenzale autorizzato, raccomandato e adatto all’età.
- Afluria (IIV3; Seqirus, Parkville, Victoria, Australia) è ora raccomandato per le persone di età ≥5 anni, in linea con l’etichettatura approvata dalla FDA.
- Alla luce della sua bassa efficacia contro l’influenza A(H1N1)pdm09 negli Stati Uniti durante le stagioni 2013-14 e 2015-16, per la stagione 2017-18, ACIP continua la raccomandazione di non utilizzare LAIV4. Poiché LAIV4 è ancora un vaccino con licenza che potrebbe essere disponibile e che alcuni fornitori potrebbero decidere di utilizzare, a solo scopo informativo, in questo rapporto si fa riferimento alle precedenti raccomandazioni per il suo utilizzo.
Raccomandazioni per l’uso dei vaccini antinfluenzali, 2017-18 Stagione
Gruppi consigliati per la vaccinazione
La vaccinazione antinfluenzale annuale di routine è raccomandata per tutte le persone di età ≥6 mesi che non hanno controindicazioni. Le raccomandazioni riguardanti i tempi di vaccinazione, le considerazioni per popolazioni specifiche, l’uso di vaccini specifici, le controindicazioni e le precauzioni sono riassunte nelle sezioni che seguono.
Tempistica della vaccinazione
In modo ottimale, la vaccinazione dovrebbe avvenire prima dell’inizio dell’attività influenzale nella comunità. Gli operatori sanitari dovrebbero offrire la vaccinazione entro la fine di ottobre, se possibile. I bambini di età compresa tra i 6 mesi e gli 8 anni che richiedono 2 dosi (vedi Bambini di età compresa tra i 6 mesi e gli 8 anni) dovrebbero ricevere la prima dose non appena possibile dopo la disponibilità del vaccino, per consentire che la seconda dose (che deve essere somministrata ≥4 settimane dopo) venga ricevuta entro la fine di ottobre. Anche se alcuni dati disponibili indicano che la vaccinazione precoce (ad esempio, in luglio e agosto) potrebbe essere associata a un’immunità non ottimale prima della fine della stagione influenzale, in particolare tra gli adulti più anziani, non si conosce il contributo relativo della potenziale diminuzione dell’immunità rispetto ad altri fattori determinanti dell’impatto della vaccinazione (ad esempio, i tempi e la gravità della stagione influenzale, l’impatto delle opportunità mancate quando gli individui ritardano la vaccinazione e non tornano più tardi nella stagione, e i vincoli programmatici). Anche se ritardare la vaccinazione potrebbe comportare una maggiore immunità più tardi nella stagione, il rinvio potrebbe anche comportare la perdita di opportunità di vaccinazione, così come la difficoltà di vaccinare una popolazione entro un periodo di tempo più limitato. I programmi di vaccinazione comunitaria dovrebbero bilanciare la massimizzazione della probabilità di persistenza della protezione indotta dal vaccino durante la stagione con l’evitare la perdita di opportunità di vaccinazione o di vaccinazione dopo l’inizio della circolazione dell’influenza. La rivaccinazione più tardi nella stagione di persone che sono già state completamente vaccinate non è raccomandata.
La vaccinazione dovrebbe continuare ad essere offerta finché i virus influenzali sono in circolazione e il vaccino non ancora disponibile. Per evitare di perdere l’opportunità di vaccinarsi, i fornitori dovrebbero offrire la vaccinazione durante le visite sanitarie di routine e i ricoveri ospedalieri quando il vaccino è disponibile. Gli sforzi per la vaccinazione dovrebbero essere strutturati in modo da garantire la vaccinazione del maggior numero possibile di persone prima dell’inizio dell’attività influenzale nella comunità.
In una determinata stagione, non è possibile prevedere il momento ottimale per la vaccinazione proprio perché le stagioni influenzali variano in termini di tempistica e durata. Inoltre, più di un focolaio può verificarsi in una data comunità in un solo anno. Negli Stati Uniti, focolai localizzati che indicano l’inizio dell’attività influenzale stagionale possono verificarsi già nel mese di ottobre. Tuttavia, nel 74% delle stagioni influenzali dal 1982-83 al 2015-16, il picco di attività influenzale (che spesso è vicino al punto medio dell’attività influenzale per la stagione) non si è verificato fino a gennaio o più tardi, e nel 59% delle stagioni, il picco è stato in febbraio o più tardi (10).
Nelle ultime stagioni, le prime spedizioni di vaccino antinfluenzale sono arrivate ad alcuni fornitori di vaccini già a luglio. La disponibilità molto precoce del vaccino rispetto all’inizio e al picco tipico dell’attività influenzale solleva questioni relative al momento ideale per iniziare la vaccinazione. Diversi studi osservazionali sull’efficacia del vaccino antinfluenzale hanno riportato una diminuzione della protezione del vaccino in una sola stagione, in particolare contro l’influenza A(H3N2) (11–14). In alcuni di questi studi il declino del VE è stato particolarmente pronunciato tra gli adulti più anziani (12,13). Alcuni studi hanno documentato il declino degli anticorpi protettivi nel corso di una stagione (15–17), con livelli di anticorpi che diminuiscono con il passare del tempo dopo la vaccinazione. Tuttavia, il tasso e il grado di declino osservato è variato. Tra gli adulti in uno studio, i livelli di anticorpi HA e neuraminidasi sono diminuiti lentamente, con una doppia diminuzione del titolo stimata in >600 giorni (18). Una revisione degli studi che riportavano tassi di sieroprotezione post-vaccinazione tra gli adulti di età ≥60 anni ha rilevato che i livelli di sieroprotezione conformi agli standard del Comitato delle specialità medicinali sono stati mantenuti per ≥4 mesi per il componente H3N2 in tutti gli 8 studi e per i componenti H1N1 e B in cinque dei sette studi (19). Una recente analisi multistagione del U.S. Influenza Vaccine Effectiveness (U.S. Flu VE) Network ha rilevato che il VE è diminuito di circa il 7% al mese per H3N2 e influenza B, e del 6%-11% al mese per H1N1pdm09 (20). La VE è rimasta superiore a zero per almeno 5-6 mesi dopo la vaccinazione. Effetti simili di diminuzione non sono stati osservati in modo coerente tra gruppi di età e sottotipi virali in diverse popolazioni, e il declino osservato nella protezione potrebbe essere attribuibile a distorsioni, confusione non misurata, o all’emergere a fine stagione di varianti di deriva antigenica che sono meno compatibili con il ceppo del vaccino.
Gli sforzi per la vaccinazione dovrebbero continuare per tutta la stagione perché la durata della stagione influenzale varia e l’attività influenzale potrebbe non verificarsi in alcune comunità fino a febbraio o marzo. I fornitori dovrebbero offrire regolarmente il vaccino antinfluenzale e le campagne di vaccinazione organizzate dovrebbero continuare per tutta la stagione influenzale, anche dopo l’inizio dell’attività influenzale nella comunità. Anche se si raccomanda la vaccinazione entro la fine di ottobre, il vaccino somministrato a dicembre o più tardi, anche se l’attività influenzale è già iniziata, è probabile che sia utile nella maggior parte delle stagioni influenzali.
Linee guida per l’uso in popolazioni e situazioni specifiche
Popolazioni a più alto rischio di complicazioni mediche attribuibili a grave influenza
Tutte le persone di età ≥6 mesi senza controindicazioni devono essere vaccinate annualmente. Tuttavia, la vaccinazione per prevenire l’influenza è particolarmente importante per le persone che sono a maggior rischio di gravi complicazioni da influenza e per le visite ambulatoriali, di disfunzione erettile o ospedaliere correlate all’influenza. Quando l’offerta di vaccino è limitata, gli sforzi di vaccinazione dovrebbero concentrarsi sulla somministrazione della vaccinazione alle seguenti persone ad alto rischio di complicazioni mediche attribuibili all’influenza grave che non hanno controindicazioni (nessuna gerarchia è implicita nell’ordine di elencazione):
- tutti i bambini dai 6 ai 59 mesi;
- tutte le persone di età ≥50 anni;
- adulti e bambini che hanno disturbi polmonari cronici (inclusa l’asma) o cardiovascolari (eccetto l’ipertensione isolata), renali, epatici, neurologici, ematologici o metabolici (incluso il diabete mellito);
- persone che sono immunocompromesse per qualsiasi causa (compresa l’immunosoppressione causata da farmaci o dall’infezione da HIV);
- donne che sono o saranno incinte durante la stagione influenzale;
- bambini e adolescenti (dai 6 mesi ai 18 anni) che ricevono farmaci contenenti aspirina o salicilato e che potrebbero essere a rischio di contrarre la sindrome di Reye dopo l’infezione da virus influenzale;
- residenti di case di cura e altre strutture di assistenza a lungo termine;
- indiani d’america e nativi dell’Alaska; e
- persone estremamente obese (IMC ≥40).
ACIP raccomanda di non utilizzare LAIV4 durante la stagione 2017-18 per nessuna popolazione. I fornitori che scelgono di usarlo dovrebbero considerare le linee guida precedenti per l’uso della LAIV4 per le popolazioni ad alto rischio(Tabella 2).
Persone che vivono o si prendono cura di persone ad alto rischio di complicazioni legate all’influenza
Tutte le persone di età ≥6 mesi senza controindicazioni devono essere vaccinate ogni anno; tuttavia, si deve continuare a porre l’accento sulla vaccinazione delle persone che vivono con o che si prendono cura di persone a più alto rischio di complicazioni legate all’influenza. Quando l’offerta di vaccini è limitata, gli sforzi di vaccinazione dovrebbero concentrarsi sulla somministrazione di vaccini alle persone a più alto rischio di complicanze influenzali sopra elencate, così come a queste persone:
- il personale sanitario, compresi i medici, gli infermieri e gli altri lavoratori in strutture ospedaliere e ambulatoriali, gli operatori del pronto soccorso (ad esempio, i paramedici e i tecnici del pronto soccorso) e i dipendenti delle case di cura e delle strutture di assistenza a lungo termine che hanno contatti con pazienti o residenti, e gli studenti di queste professioni che avranno contatti con i pazienti. La guida ACIP per l’immunizzazione del personale sanitario è stata pubblicata in precedenza (21);
- contatti domestici (compresi i bambini) e assistenti di bambini di età ≤59 mesi (cioè di età inferiore ai 5 anni) e adulti di età ≥50 anni, in particolare contatti di bambini di età inferiore ai 6 mesi; e
- i contatti domestici (compresi i bambini) e gli assistenti di persone con condizioni mediche che li mettono ad alto rischio di gravi complicazioni da influenza.
ACIP raccomanda di non utilizzare LAIV4 durante la stagione 2017-18 per nessuna popolazione. I fornitori che scelgono di utilizzarlo dovrebbero prendere in considerazione le precedenti linee guida per l’uso di LAIV4 per le persone che curano o hanno contatti con persone immunocompromesse (22). Il personale sanitario e le persone che sono contatti di persone appartenenti a questi gruppi e che sono contatti di persone gravemente immunocompromesse (coloro che vivono in un ambiente protetto) possono ricevere qualsiasi IIV o RIV altrimenti indicato. L’ACIP e l’HICPAC hanno precedentemente raccomandato al personale sanitario che riceve LAIV di evitare di fornire cure a pazienti gravemente immunodepressi che necessitano di un ambiente protetto per 7 giorni dopo la vaccinazione, e ai visitatori dell’ospedale che hanno ricevuto LAIV4 di evitare contatti con persone gravemente immunodepresse (cioè persone che necessitano di un ambiente protetto) per 7 giorni dopo la vaccinazione. Tuttavia, a tali persone non dovrebbe essere impedito di visitare pazienti meno gravemente immunosoppressi.
Bambini da 6 mesi a 8 anni
Volume di dose per bambini dai 6 ai 35 mesi: I bambini dai 6 ai 35 mesi possono ricevere uno dei due prodotti al volume appropriato per ogni dose necessaria: 0,5 mL di Quadrivalente FluLaval (contenente 15 µ g diHA per virus vaccinale) o 0,25 mL di Quadrivalente Fluzone (contenente 7,5 µ g di HAper virus vaccinale). Questi sono gli unici due prodotti vaccinali antinfluenzali autorizzati per questa fascia d’età. Si deve fare attenzione a somministrare il volume appropriato per ogni dose necessaria di uno dei due prodotti. In entrambi i casi, il volume necessario può essere somministrato da un’appropriata siringa pre-riempita, da un flaconcino monodose o da un flaconcino multidose, come fornito dal produttore. Si noti, tuttavia, che se si usa un flaconcino monouso da 0,5 ml di Fluzone Quadivalent per un bambino dai 6 ai 35 mesi, solo metà del volume deve essere somministrato e l’altra metà deve essere scartata.
Prima del novembre 2016, le uniche formulazioni di vaccino antinfluenzale autorizzate per i bambini dai 6 ai 35 mesi erano le formulazioni di 0,25 ml (contenenti 7,5 µ g diHA per virus vaccinale) di Fluzone e Fluzone Quadrivalent. La raccomandazione per l’uso di un volume di dose ridotto per i bambini di questo gruppo di età (la metà di quella raccomandata per le persone di età ≥3 anni) si basava sull’aumento della reattogenicità osservato tra i bambini (in particolare tra i più piccoli) in seguito al ricevimento di vaccini antinfluenzali in studi condotti durante gli anni ’70. Questo aumento della reattogenicità è stato osservato principalmente con vaccini inattivati contro il virus intero (23–27). Studi con vaccini più simili ai prodotti inattivati da split-virus attualmente disponibili hanno dimostrato una minore reattogenicità (27). Recenti studi comparativi di 0,5 ml contro 0,25 ml di dosi di IIV3 condotti su bambini dai 6 ai 23 mesi (28) e da 6 a 35 mesi (29) non ha notato alcuna differenza significativa nella reattogenicità alla dose più alta. In uno studio randomizzato che confrontava l’immunogenicità e la sicurezza di 0,5 mL di FluLaval Quadrivalent con 0,25 mL di Fluzone Quadrivalent, la sicurezza e la reattogenicità erano simili tra i due vaccini. In un’analisi post-hoc, è stata riscontrata un’immunogenicità superiore per i componenti B di FluLaval Quadrivalent tra i neonati dai 6 ai 17 mesi e per i bambini non vaccinati (quelli che non avevano precedentemente ricevuto almeno 2 dosi di vaccino antinfluenzale) dai 6 ai 35 mesi (30).
Numero di dosi per bambini da 6 mesi a 8 anni: Le prove di diversi studi indicano che i bambini di età compresa tra 6 mesi e 8 anni richiedono 2 dosi di vaccino antinfluenzale (somministrate a distanza di almeno 4 settimane l’una dall’altra) durante la prima stagione di vaccinazione per una protezione ottimale (31–34). I bambini di età compresa tra 6 mesi e 8 anni che hanno precedentemente ricevuto ≥2 dosi totali di vaccino antinfluenzale trivalente o quadrivalente prima del 1 luglio 2017 richiedono solo 1 dose per il 2017-18. Le 2 dosi di vaccino antinfluenzale non devono essere state somministrate nella stessa stagione o in stagioni consecutive. I bambini di questa fascia d’età che non hanno ricevuto in precedenza ≥2 dosi di vaccino antinfluenzale trivalente o quadrivalente prima del 1° luglio 2017 richiedono 2 dosi per la stagione 2017-18. L’intervallo tra le 2 dosi dovrebbe essere di almeno 4 settimane(Figura).
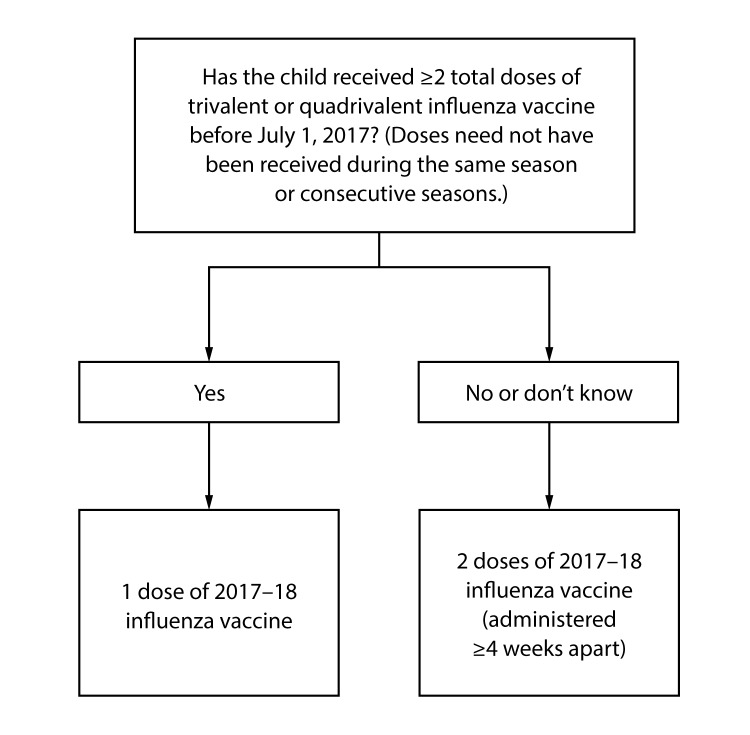
FIGURA. Algoritmo di dosaggio del vaccino antinfluenzale per bambini da 6 mesi a 8 anni – Advisory Committee on Immunization Practices, Stati Uniti, stagione influenzale 2017-18

FIGURA. Algoritmo di dosaggio del vaccino antinfluenzale per bambini da 6 mesi a 8 anni – Advisory Committee on Immunization Practices, Stati Uniti, stagione influenzale 2017-18
Donne incinte
Poiché le donne incinte e le donne in post-partum sono più a rischio di gravi malattie e complicazioni da influenza rispetto alle donne che non sono incinte, l’ACIP raccomanda che tutte le donne incinte o che potrebbero essere incinte nella stagione influenzale ricevano il vaccino antinfluenzale. Può essere utilizzato qualsiasi vaccino antinfluenzale autorizzato, raccomandato e adatto all’età. Il vaccino antinfluenzale può essere somministrato in qualsiasi momento durante la gravidanza, prima e durante la stagione influenzale. ACIP raccomanda di non utilizzare LAIV4 in nessuna popolazione per la stagione 2017-18. I fornitori dovrebbero notare che, come vaccino contro il virus vivo, LAIV4 non dovrebbe essere usato durante la gravidanza.
Anche se l’esperienza con l’uso di IIV è sostanziale, e i dati degli studi osservazionali sono disponibili per sostenere la sicurezza di questi vaccini in gravidanza, i dati sono più limitati per la vaccinazione durante il primo trimestre (vedi Sicurezza dei vaccini antinfluenzali: Donne in gravidanza e neonati nel documento di riferimento). Inoltre, vi è un’esperienza sostanzialmente inferiore con i prodotti IIV con licenza più recente (ad esempio, i vaccini quadrivalenti, le colture cellulari e i coadiuvanti) durante la gravidanza in generale. Per RIV (disponibile come RIV3 dalla stagione influenzale 2013-14 e come RIV3 e RIV4 per il 2017-18), i dati sono limitati alle segnalazioni di gravidanze avvenute accidentalmente durante gli studi clinici, alle segnalazioni di VAERS e ai rapporti del registro delle gravidanze. Per alcuni prodotti esistono registri di gravidanza e studi di sorveglianza; le informazioni possono essere trovate nei foglietti illustrativi (35–42), disponibile sul sito https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm094045.htm per i vaccini trivalenti e https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm295057.htm per i vaccini quadrivalenti.
Adulti anziani
Per le persone di età ≥65 anni, qualsiasi formulazione IIV adatta all’età (a dosi standard o ad alte dosi, trivalente o quadrivalente, non coadiuvato o coadiuvato) o RIV sono opzioni accettabili. Fluzone High-Dose (HD-IIV3; Sanofi Pasteur, Swiftwater, Pennsylvania) ha soddisfatto i criteri prestabiliti per un’efficacia superiore a quella di SD-IIV3 in uno studio randomizzato condotto su due stagioni su 31.989 persone di età ≥65 anni, e potrebbe fornire una protezione migliore di SD-IIV3 per questa fascia di età (43–45). In un’analisi esplorativa dei dati di uno studio randomizzato di una singola stagione condotto su 8.604 adulti di età ≥50 anni, Flublok Quadrivalent (RIV4; Protein Sciences, Meriden, Connecticut) è risultato più efficace di SD-IIV4 (46,47); tuttavia, non è stata approvata alcuna rivendicazione di superiorità per il foglietto illustrativo (47). L’influenza (aIIV3; Seqirus, Holly Springs, North Carolina) è stata più efficace contro l’influenza confermata in laboratorio rispetto a quella non compensata SD-IIV3 tra gli adulti di età ≥65 anni (N = 227) in un’analisi di un piccolo studio osservazionale (48). Non viene fatta alcuna raccomandazione preferenziale per un prodotto vaccinale specifico. La vaccinazione non dovrebbe essere ritardata se un prodotto specifico non è prontamente disponibile.
A causa della vulnerabilità di questa popolazione a gravi malattie influenzali, ospedalizzazione e morte, l’efficacia e l’efficacia dei vaccini antinfluenzali tra gli adulti più anziani è un’area di ricerca attiva (vedi Immunogenicità, Efficacia ed Efficacia dei vaccini antinfluenzali: HD-IIV3, aIIV3, e RIV4 per gli adulti anziani nel documento di riferimento). Recenti studi comparativi di efficacia/efficacia contro gli esiti dell’influenza confermati in laboratorio tra gli adulti più anziani si sono concentrati su HD-IIV3 (Fluzone High Dose; Sanofi Pasteur, Swiftwater, Pennsylvania) (43,49–51), aIIV3 (Fluad, Seqirus, Holly Springs, North Carolina) (48), e RIV4 (Flublok Quadrivalent; Scienze delle proteine, Meriden, Connecticut) (46). Le caratteristiche di questi studi sono riassunte(Tabella 3). In ogni caso, i vaccini di comparazione sono stati vaccini a dose standard, vaccini inattivati (SD-IIV3 come comparatore per HD-IIV3 e aIIV3; SD-IIV4 come comparatore per RIV4). Non sono ancora disponibili dati di studi che confrontino l’efficacia o l’efficacia di HD-IIV3, aIIV3 e RIV4 tra gli adulti più anziani. Questa mancanza di dati comparativi impedisce di raccomandare uno di questi tre vaccini rispetto ad un altro per questa popolazione. HD-IIV3 ha mostrato un’efficacia superiore rispetto ad un comparatore a dosi standard IIV3 per adulti di età ≥65 anni in un grande (N = 31.989) studio randomizzato a due stagioni, controllato, in doppio cieco (43,44), e potrebbe fornire una protezione migliore rispetto alle SD-IIV3 per questa fascia d’età. Ulteriori dati relativi all’efficacia relativa dell’HD-IIV3 per altri risultati clinici, così come le analisi del rapporto costo-efficacia e gli studi osservazionali, sono riassunti nel documento di base. In uno studio randomizzato, controllato e in doppio cieco, condotto in una sola stagione, che ha confrontato il RIV4 con un IIV4 a dose standard non coadiuvato tra gli adulti di età ≥50 anni (N = 8.604), il RIV4 è risultato più efficace; tuttavia, l’approvazione di un’affermazione di superiorità non è stata fatta come risultato di questa analisi esplorativa (46,47). Ulteriori dati, compresa la discussione degli studi di immunogenicità, sono descritti nel documento di base. L’influenza (aIIV3; Seqirus, Holly Springs, North Carolina) si è dimostrata più efficace contro l’influenza confermata in laboratorio rispetto alla SD-IIV3 non compensata tra gli adulti di età ≥65 anni (N = 227) in un’analisi di un piccolo studio osservazionale (48); non sono ancora disponibili dati sull’efficacia del Fluad rispetto alla IIV3 non additivata rispetto ai risultati di laboratorio confermati da uno studio randomizzato su questa popolazione. Ulteriori dati relativi all’aIIV3, provenienti da studi che esaminano l’immunogenicità e gli esiti dell’influenza non confermati in laboratorio, sono discussi nel documento di riferimento. L’ACIP continuerà a rivedere i dati relativi all’efficacia e all’efficienza di questi vaccini man mano che emergeranno ulteriori informazioni.
| Comparatore (nome di proprietà) | Studio di progettazione | Età iscritte | No. partecipanti | Stagione(i) (virus predominanti)† | Posizione | Risultato primario | Principali risultati di efficacia/efficacia |
|---|---|---|---|---|---|---|---|
| HD-IIV3 (Fluzone High-Dose, Sanofi Pasteur) | |||||||
| SD-IIV3 (Fluzone)§ | RCT, doppio cieco | ≥65 anni | 6.107 HD-IIV3 3.051 SD-IIV3 | 2009-10 ([H1N1]pdm09; non contenuto in HD-IIV3 o SD-IIV3) | Stati Uniti (99 siti) | Cultura e/o RT-PCR-confermata ILI, causata da tipi/sottotipi simili a quelli contenuti nel vaccino | Risultato primario non valutabile a causa dell’emergenza della pandemia (H1N1)pdm09 (non sono stati osservati casi che soddisfano l’endpoint primario dell’influenza confermata in laboratorio causata da tipi/sottotipi virali simili a quelli del vaccino; tutti i casi confermati erano dovuti a [H1N1]pdm09) |
| SD-IIV3 (Fluzone)¶ | RCT, doppio cieco | ≥65 anni | 15.990 HD-IIV3 15.993 SD-IIV3 | 2011-12 (H3N2) e 2012-13 ([H3N2], mismatch) | Stati Uniti, Canada (126 siti) | Influenza confermata in laboratorio (coltura e/o RT-PCR) causata da qualsiasi tipo o sottotipo virale influenzale, in associazione con l’ILI definito dal protocollo | Influenza confermata dalla cultura e/o RT-PCR; qualsiasi tipo o sottotipo, con ILI definito dal protocollo: tutta l’influenza: RE 24.2% (95% CI = 9.7-36.5);Influenza A: RE 24.0% (95% CI = 7.8-37.4);Influenza B: RE 25.5% (95% CI =-15.7-52.4);Influenza in coltura e/o RT-PCR-confermata; ceppi simili al vaccino, con ILI definito dal protocollo: tutta l’influenza: RE 35.4% (95% CI = 12.5-52.5);Influenza A: RE 31.7% (95% CI = 2.9-52.3);Influenza B: RE 45.2% (95% CI = -2.2-71.5);Influenza confermata in coltura; qualsiasi tipo o sottotipo, con ILI definito dal protocollo:Tutta l’influenza: RE 23.1% (95% CI = 7.5-36.2);Influenza A: RE 23.4% (95% CI = 6.0-37.6);Influenza B: RE 21.7% (95% CI =-23.8-50.8);Influenza confermata in coltura; ceppi simili al vaccino. con protocollo definito ILI:Allinfluenza: RE 31.5% (95% CI = 4.6-51.1)Influenza A: RE 27.0% (95% CI = -8.5-51.2)Influenza B: RE 41.4% (95% CI =-10.3-69.8) |
| RIV4 (Flublok Quadrivalente, Scienze delle proteine) | |||||||
| SD-IIV4 (Fluarix Quadrivalent)** | RCT, doppio cieco | ≥50 anni | 4.303 RIV4 4.301 IIV4 | 2014-15 (H3N2, disallineamento) | Stati Uniti (40 siti) | RT-PCR ha confermato l’ILI causato da qualsiasi tipo o sottotipo. | RT-PCR-positivo ILI definito dal protocollo; età≥50 anni: tutta l’influenza: RE 30% (95% CI = 10-47);Influenza A: RE 36% (95%CI = 14-53);Influenza B: RE 4% (95% CI =: -72-46);RT-PCR-positivoILI definito dal protocollo RT-PCR; 
Invecchiato ≥50 anni:
Tutta l’influenza: RE 42% (95% CI = 15-61)Età ≥65anni:Tutta l’influenza: RE 17% (95% CI = -20-43);Coltura-positivadefinita dal protocollo ILI:Invecchiato ≥50 anni:Tutta l’influenza: RE 43% (95% CI = 21-59);Influenza A: RE 44% (95% CI = 22-61);Influenza B: RE 25% (95% CI =-121-75);Coltura-positivadefinita dal protocollo ILI:Invecchiato 50-64 anni:Tutta l’influenza: RE 44% (95% CI = 10-65)Invecchiato≥65 anni:Tutta l‘influenza: RE 42% (95% CI = 9-65) |
| aIIV3 (Fluad, Seqirus) | |||||||
| SD-IIV3;non vaccinato†††† | Non randomizzato, osservazionale, test prospettico, test prospettico negativo caso-controllo | ≥65 anni, che presenta sintomi di ILI | 165 aIIV362 IIV355 non vaccinati | 2011-12 (H3N2) | Canada (3 autorità sanitarie) | RT-PCR- ILI confermato | Efficacia di aIIV3 vs. non vaccinato:58% (95% CI = 5-82) Efficaciadi IIV3 vs. non vaccinato: -2% (95% CI = -139-57) Efficacia diaIIV3 vs. IIV3: 63% (95% CI = 4-86) |
Persone Immunocompromesse
Gli stati immunocompromessi comprendono una gamma eterogenea di condizioni. In molti casi, sono disponibili dati limitati sull’uso di vaccini antinfluenzali nell’ambito di specifici stati immunocompromessi. ACIP raccomanda di non utilizzare LAIV4 in nessuna popolazione per la stagione 2017-18; i fornitori che ne considerano l’uso dovrebbero notare che i vaccini contro il virus vivo non dovrebbero essere utilizzati per le persone con la maggior parte delle forme di immunocompetenza alterata (52), dato il rischio incerto ma biologicamente plausibile di malattia attribuibile al virus del vaccino. Oltre ai potenziali problemi di sicurezza, la risposta immunitaria ai vaccini vivi o inattivati potrebbe essere attenuata in alcune situazioni cliniche, come per le persone con carenze immunitarie congenite, le persone che ricevono la chemioterapia per il cancro e le persone che ricevono farmaci immunosoppressori. Per questo motivo, la tempistica della vaccinazione potrebbe essere una considerazione (ad esempio, la vaccinazione durante un certo periodo prima o dopo un intervento immunocompromettente).
La Infectious Diseases Society of America (IDSA) ha pubblicato una guida dettagliata per la selezione e la tempistica dei vaccini per le persone con specifiche condizioni immunocompromettenti, compresi i disturbi immunitari congeniti, il trapianto di cellule staminali e di organi solidi, l’asplenia anatomica e funzionale e l’immunosoppressione terapeutica indotta da farmaci, così come per le persone con impianti cocleari o altre condizioni che portano ad una persistente comunicazione fluido cerebrospinale o orofaringea (53). L’ACIP continuerà a rivedere l’accumulo di dati sull’uso dei vaccini antinfluenzali in questi contesti.
Persone con una storia di sindrome di Guillain-Barré a seguito di vaccinazione contro l’influenza
Una storia della sindrome di Guillain-Barré (GBS) entro 6 settimane dopo una precedente dose di qualsiasi tipo di vaccino antinfluenzale è considerata una precauzione alla vaccinazione (Tabella2). Le persone che non sono ad alto rischio di complicanze influenzali gravi (vedi Popolazioni ad alto rischio per complicanze mediche attribuibili a grave influenza) e che sono note per aver sperimentato la GBS entro 6 settimane da una precedente vaccinazione antinfluenzale in genere non dovrebbero essere vaccinate. Come alternativa alla vaccinazione, i medici potrebbero prendere in considerazione l’uso di chemioprofilassi antivirale antinfluenzale per queste persone (54). Tuttavia, i benefici della vaccinazione antinfluenzale potrebbero superare i rischi per alcune persone che hanno una storia di GBS e che sono anche ad alto rischio di gravi complicazioni da influenza.
Persone con una storia di allergia all’uovo
Come per altri vaccini, i vaccini antinfluenzali contengono diversi componenti che possono causare reazioni allergiche e anafilattiche. Non tutte queste reazioni sono correlate alle proteine dell’uovo; tuttavia, la possibilità di reazioni ai vaccini antinfluenzali in persone allergiche all’uovo potrebbe essere una preoccupazione per queste persone e per i fornitori di vaccini. I vaccini antinfluenzali attualmente disponibili, con le eccezioni di RIV3, RIV4 e ccIIV4, sono preparati mediante la propagazione del virus nelle uova embrionate. Solo RIV3 e RIV4 sono considerati esenti da uova. Per ccIIV4 (Flucelvax Quadrivalent; Seqirus, Holly Springs, North Carolina), l’ovoalbumina non viene misurata direttamente. Durante la produzione di ccIIV4, i virus si propagano nelle cellule dei mammiferi piuttosto che nelle uova; tuttavia, alcuni dei virus forniti al produttore sono derivati dalle uova, e quindi le proteine delle uova possono potenzialmente essere introdotte all’inizio del processo di produzione. Una volta che questi virus sono ricevuti dal produttore, non vengono utilizzate uova, e le diluizioni in varie fasi del processo di produzione si traducono in un massimo teorico di 5×10-8μ g/0,5 mL di dose di proteine totali dell’uovo (Seqirus, dati non pubblicati, 2016).
Reazioni allergiche gravi ai vaccini, anche se rare, possono verificarsi in qualsiasi momento, nonostante l’anamnesi allergica del ricevente. Pertanto, tutti i fornitori di vaccini dovrebbero avere familiarità con il piano di emergenza dell’ufficio ed essere certificati nella rianimazione cardiopolmonare (52). Per le persone che segnalano un’anamnesi di allergia all’uovo, ACIP raccomanda quanto segue (in base ai precedenti sintomi del ricevente dopo l’esposizione all’uovo):
- Le persone con una storia di allergia all’uovo che hanno avuto solo orticaria (orticaria) dopo l’esposizione all’uovo dovrebbero ricevere il vaccino antinfluenzale. Può essere utilizzato qualsiasi vaccino antinfluenzale autorizzato e raccomandato (cioè qualsiasi IIV o RIV) che sia altrimenti appropriato per l’età e lo stato di salute del ricevente.
- Le persone che riferiscono di aver avuto reazioni all’uovo con sintomi diversi dall’orticaria (orticaria), come angioedema, difficoltà respiratorie, vertigini o emesi ricorrente, o che hanno richiesto l’epinefrina o un altro intervento medico d’emergenza, possono ugualmente ricevere qualsiasi vaccino antinfluenzale autorizzato e raccomandato (cioè, qualsiasi IIV o RIV) che sia altrimenti appropriato per l’età e lo stato di salute del ricevente. Il vaccino selezionato deve essere somministrato in un ambiente medico ospedaliero o ambulatoriale (inclusi, ma non necessariamente limitatamente a ospedali, cliniche, reparti sanitari e studi medici). La somministrazione del vaccino dovrebbe essere supervisionata da un fornitore di assistenza sanitaria che sia in grado di riconoscere e gestire gravi condizioni allergiche.
- Una precedente reazione allergica grave al vaccino antinfluenzale, indipendentemente dal componente sospettato di essere responsabile della reazione, è una controindicazione alla futura ricezione del vaccino.
Nessun periodo di osservazione post-vaccinazione è raccomandato specificamente per le persone allergiche all’uovo. Tuttavia, ACIP raccomanda ai fornitori di vaccino di considerare l’osservazione dei pazienti per 15 minuti dopo la somministrazione di qualsiasi vaccino per ridurre il rischio di lesioni in caso di sincope (52).
Le persone che sono in grado di mangiare uova leggermente cotte (ad esempio, uova strapazzate) senza reazione, è improbabile che siano allergiche. Le persone allergiche all’uovo potrebbero tollerare l’uso di uova in prodotti da forno (ad es. pane o torta). La tolleranza agli alimenti contenenti uova non esclude la possibilità di un’allergia alle uova. L’allergia all’uovo può essere confermata da un’anamnesi coerente di reazioni avverse alle uova e agli alimenti contenenti uova, più l’analisi della pelle e/o del sangue per l’immunoglobulina E diretta contro le proteine dell’uovo (55).
Casi occasionali di anafilassi in persone allergiche all’uovo sono stati segnalati a VAERS dopo la somministrazione di vaccini antinfluenzali (56,57). L’ACIP continuerà a rivedere i dati disponibili sui casi di anafilassi a seguito di vaccini antinfluenzali.
Problemi di vaccinazione per i viaggiatori
I viaggiatori che vogliono ridurre il rischio di infezione da influenza devono prendere in considerazione la vaccinazione antinfluenzale, preferibilmente almeno 2 settimane prima della partenza. In particolare, le persone residenti negli Stati Uniti che sono ad alto rischio di complicazioni influenzali e che non sono state vaccinate con il vaccino antinfluenzale durante l’autunno o l’inverno dell’emisfero settentrionale precedente dovrebbero prendere in considerazione la possibilità di ricevere il vaccino antinfluenzale prima della partenza, se hanno intenzione di viaggiare:
- ai tropici,
- con gruppi turistici organizzati o su navi da crociera, oppure
- all’emisfero australe durante la stagione influenzale dell’emisfero australe (aprile-settembre).
Non sono disponibili informazioni che indichino un beneficio per le persone che si vaccinano prima dei viaggi estivi e che sono già state vaccinate durante l’autunno precedente. In molti casi, la rivaccinazione non sarà possibile poiché le formulazioni del vaccino antinfluenzale dell’emisfero australe non sono generalmente disponibili negli Stati Uniti. Le persone ad alto rischio che ricevono il vaccino della stagione precedente prima del viaggio dovrebbero ricevere il vaccino corrente il successivo autunno o inverno. Le persone ad alto rischio di complicazioni influenzali dovrebbero consultare il proprio medico curante per discutere il rischio di influenza o altre malattie legate ai viaggi prima di intraprendere il viaggio durante l’estate.
Nelle regioni a clima temperato dell’emisfero settentrionale e meridionale, l’attività influenzale è stagionale e si verifica approssimativamente da ottobre a maggio nell’emisfero settentrionale e da aprile a settembre nell’emisfero meridionale. Ai tropici, l’influenza si verifica durante tutto l’anno. I viaggiatori possono essere esposti all’influenza quando si recano in un’area in cui circola l’influenza o quando viaggiano nell’ambito di grandi gruppi turistici (ad esempio, sulle navi da crociera) che comprendono persone provenienti da aree del mondo in cui circolano virus influenzali (58,59). In un sondaggio condotto tra i viaggiatori svizzeri nei Paesi tropicali e subtropicali, tra i 211 che hanno segnalato una malattia febbrile durante o dopo un viaggio all’estero e che hanno fornito campioni di siero in coppia, 40 hanno dimostrato l’evidenza sierologica di un’infezione influenzale (60). Tra i 109 viaggiatori di ritorno in Australia dai viaggi in Asia che hanno segnalato sintomi acuti di infezione respiratoria, quattro (3,7%) hanno avuto evidenza di infezione da influenza A (evidenziata da un aumento di quattro volte del titolo anticorpale) (61).
Il vaccino antinfluenzale formulato per l’emisfero australe potrebbe differire per composizione virale dal vaccino dell’emisfero settentrionale. Tuttavia, con l’eccezione della formulazione dell’emisfero meridionale del quadrivalente della zona fluviale (IIV4; Sanofi Pasteur, Swiftwater, Pennsylvania), i vaccini antinfluenzali stagionali per la formulazione dell’emisfero meridionale non sono autorizzati negli Stati Uniti, e le formulazioni dell’emisfero meridionale in genere non sono disponibili in commercio negli Stati Uniti. Maggiori informazioni sui vaccini antinfluenzali e sui viaggi sono disponibili sul sito https://www.cdc.gov/flu/travelers/travelersfacts.htm.
Uso di farmaci antivirali antinfluenzali
La somministrazione di IIV o RIV a persone che ricevono farmaci antivirali contro l’influenza per il trattamento o la chemioprofilassi è accettabile. ACIP raccomanda di non utilizzare LAIV4 durante la stagione 2017-18. Se usati, i fornitori devono tenere presente che i farmaci antivirali antinfluenzali possono ridurre l’efficacia di LAIV4 se somministrati entro 48 ore prima a 14 giorni dopo LAIV4 (62). Le persone che ricevono farmaci antivirali contro l’influenza durante questo periodo che circonda il ricevimento di LAIV4 possono essere rivaccinate con un’altra formulazione vaccinale appropriata (per esempio, IIV o RIV).
Amministrazione simultanea di vaccino antinfluenzale con altri vaccini
I dati relativi alla potenziale interferenza in seguito a somministrazione simultanea o sequenziale per le molte potenziali combinazioni di vaccini sono limitati. Pertanto, seguendo le linee guida generali ACIP per le migliori pratiche di vaccinazione è prudente (52). IIV e RIV possono essere somministrati contemporaneamente o in sequenza con altri vaccini inattivati o con vaccini vivi. LAIV4 non è raccomandato per l’uso nel 2017-18. I fornitori che ne considerano l’uso dovrebbero notare che, sebbene i vaccini inattivati o vivi possano essere somministrati simultaneamente con LAIV4, dopo la somministrazione di un vaccino vivo (come LAIV4), dovrebbero passare almeno 4 settimane prima che venga somministrato un altro vaccino vivo.
Sono disponibili dati relativamente limitati sulla somministrazione simultanea di vaccini antinfluenzali con altri vaccini. In uno studio che confronta l’immunogenicità del vaccino IIV e del vaccino zoster somministrato contemporaneamente o separato da un intervallo di 4 settimane ad adulti di età ≥50 anni, le risposte anticorpali sono state simili per entrambi i programmi (63). In alcuni studi, sono state rilevate risposte ridotte al PCV13 (64,65), antigeni del tetano (66), e antigeni della pertosse (66) quando è co-somministrato con l’IIV; nella maggior parte dei casi il significato clinico di questo è incerto. Sono stati osservati profili di sicurezza rassicuranti per la somministrazione simultanea di vaccino zoster (63), PCV13 (64,65), PPSV23 (67) e Tdap (66) tra gli adulti e di Tdap tra le donne in gravidanza (68). In alcuni di questi studi è stata osservata una maggiore prevalenza di reazioni avverse locali e/o sistemiche con somministrazione concomitante, ma questi sintomi sono stati generalmente segnalati come lievi o moderati. Tra i bambini, la co-somministrazione di IIV e PCV13 è stata associata ad un aumento del rischio di febbre il giorno della vaccinazione e il giorno successivo (cioè, giorni 0-1 postvaccinazione) dopo la vaccinazione in bambini dai 6 ai 23 mesi in uno studio condotto durante la stagione 2011-12 (69). Un aumento del rischio di crisi febbrile in questa fascia d’età è stato rilevato nei giorni 0-1 dopo la somministrazione di IIV con PCV7, PCV13 o vaccini contenenti DTaP durante le stagioni dal 2006-2007 al 2010-11 (70), e con PCV13 durante la stagione 2014-15 (71). Non sono state apportate modifiche alle raccomandazioni per la somministrazione di questi vaccini, e questi vaccini possono essere somministrati contemporaneamente. La sorveglianza delle crisi febbrili è in corso attraverso il VAERS, e la sorveglianza annuale della sicurezza del vaccino antinfluenzale del Vaccine Safety Datalink include il monitoraggio per le crisi successive alla vaccinazione.
La somministrazione contemporanea ai bambini di LAIV3 con il vaccino MMR e il vaccino contro la varicella non è stata associata ad una diminuita immunogenicità agli antigeni in nessuno dei vaccini in uno studio (72); una minore risposta alla rosolia è stata osservata in un altro esame di LAIV3 e MMR (73). La somministrazione di OPV non è stata associata ad interferenze quando è stata somministrata con LAIV (74). In questi studi non sono emersi problemi di sicurezza.
Composizione del vaccino contro l’influenza e prodotti disponibili
Composizione del vaccino contro l’influenza per la stagione 2017-18
Tutti i vaccini antinfluenzali autorizzati negli Stati Uniti conterranno componenti derivati da virus influenzali antigenici simili a quelli raccomandati dalla FDA (75). Negli Stati Uniti saranno disponibili vaccini contro l’influenza sia trivalenti che quadrivalenti. I vaccini antinfluenzali statunitensi 2017-18 conterranno i seguenti componenti:
- un virus A/Michigan/45/2015 (H1N1)pdm09-like,
- un virus simile a A/Hong Kong/4801/2014 (H3N2), e
- un virus di tipo B/Brisbane/60/2008 (lignaggio Victoria).
I vaccini quadrivalenti statunitensi 2017-18 conterranno gli stessi tre antigeni e un’ulteriore componente del virus B dell’influenza, un virus B/Phuket/3073/2013 simile al virus (lignaggio Yamagata). Rispetto al 2016-17, la composizione per il 2017-18 rappresenta un cambiamento nel virus dell’influenza A(H1N1)pdm09-like.
Prodotti vaccini per la stagione 2017-18
Una varietà di prodotti per il vaccino antinfluenzale sono autorizzati e disponibili da diversi produttori(Tabella 1). Per molti destinatari del vaccino, più di un tipo o marca di vaccino potrebbe essere appropriato all’interno delle indicazioni approvate e delle raccomandazioni ACIP. Dovrebbe essere usato un prodotto vaccino antinfluenzale con licenza e adatto all’età. Non tutti i prodotti sono probabilmente disponibili in modo uniforme in qualsiasi ambiente o località. La vaccinazione non dovrebbe essere ritardata per ottenere un prodotto specifico quando un prodotto appropriato è già disponibile. Nell’ambito di queste linee guida e delle indicazioni approvate, quando più di un tipo di vaccino è appropriato e disponibile, non viene fatta alcuna raccomandazione preferenziale per l’uso di qualsiasi prodotto vaccinale antinfluenzale rispetto ad un altro.
Dalla pubblicazione delle linee guida della stagione precedente, sono stati autorizzati due nuovi prodotti vaccinali antinfluenzali: Afluria Quadrivalent (IIV4; Seqirus, Parkville, Victoria, Australia) e Flublok Quadrivalent (RIV4; Protein Sciences, Meriden, Connecticut). Inoltre, è stata approvata una modifica dell’etichettatura per un prodotto precedentemente autorizzato: FluLaval Quadrivalent (IIV4, ID Biomedical Corporation of Quebec, Quebec City, Quebec, Canada) è ora autorizzato per i bambini dai 6 mesi in su. Questi sono descritti nella sezione Approvazioni di prodotti per vaccini contro l’influenza. Nuove licenze e modifiche all’etichettatura approvata dalla FDA potrebbero verificarsi in seguito a questo rapporto. Queste raccomandazioni si applicano a tutti i vaccini antinfluenzali autorizzati utilizzati nell’ambito di indicazioni autorizzate dalla FDA, comprese le modifiche all’etichettatura approvata dalla FDA che potrebbero verificarsi dopo la pubblicazione di questo rapporto. Tali modifiche si rifletteranno nella versione online della Tabella 1, disponibile all’indirizzo https://www.cdc.gov/flu/protect/vaccine/vaccines.htm.
Dosaggio, somministrazione, controindicazioni e precauzioni
Vaccini antinfluenzali inattivati (IIV)
Prodotti disponibili: Gli IIV comprendono più prodotti(Tabella 1). Sono disponibili sia formulazioni quadrivalenti che trivalenti.
Con una sola eccezione, gli IIV con licenza statunitense sono prodotti attraverso la propagazione del virus nelle uova. L’eccezione, il vaccino a base di coltura cellulare Flucelvax Quadrivalent (ccIIV4; Seqirus, Holly Springs, North Carolina), contiene virus vaccinali propagati in cellule di rene canino Madin-Darby. Flucelvax Quadrivalent non è considerato esente da uova, in quanto alcuni dei virus vaccini iniziali forniti al produttore dall’OMS sono derivati da uova. Per la stagione 2017-18, l’influenza A (H1N1) ed entrambi i componenti dell’influenza B saranno derivati dalle uova; il componente dell’influenza A (H3N2) sarà derivato dalle cellule.
Con una sola eccezione, gli IIV autorizzati negli Stati Uniti non contengono alcun coadiuvante. L’eccezione, Fluad (aIIV3; Seqirus, Holly Springs, North Carolina) contiene il coadiuvante MF59.
Esistono IIV con licenza per persone di età inferiore ai 6 mesi. Tuttavia, le indicazioni dell’età per i vari IIV individuali sono diverse(Tabella 1). Devono essere somministrati solo prodotti adatti all’età. Afluria (IIV3, Seqirus, Parkville, Victoria, Australia), che prima era raccomandato per persone di età ≥9 anni, ora è raccomandato per persone di età ≥5 anni. I fornitori dovrebbero consultare i foglietti illustrativi e la guida CDC/ACIP aggiornata per informazioni aggiornate.
Dosaggio e somministrazione: Tutti i preparati IIV contengono 15 µ g diHA per ceppo virale del vaccino (45 µ g in totaleper gli IIV3 e 60 µ g in totale per gli IIV4) per ogni dose di 0,5 mL, con due eccezioni. Fluzone High Dose (HD-IIV3; Sanofi Pasteur, Swiftwater, Pennsylvania), una IIV3 autorizzata per persone di età ≥65 anni, contiene 60 µ g diogni HA per ceppo virale del vaccino (180 µ g in totale) (44). Fluzone Intradermal Quadrivalent (intradermico IIV4; Sanofi Pasteur, Swiftwater, Pennsylvania), un IIV4 somministrato per via intradermica e autorizzato per persone di età compresa tra i 18 e i 64 anni, contiene 9 µ g diogni HA per ceppo virale del vaccino (36 µ g in totale)(36).
Per i bambini dai 6 ai 35 mesi, due prodotti IIV sono autorizzati dalla FDA. I volumi di dose approvati differiscono per questi due prodotti. I bambini di questa fascia di età possono ricevere 1) 0,5 ml di FluLaval Quadrivalent (ID Biomedical Corporation of Quebec, Quebec City, Quebec, Canada) (37), che contiene 15 µ g diHA per virus, o 2) 0,25 mL di dose di Fluzone Quadrivalent (Sanofi Pasteur, Swiftwater, Pennsylvania) (35), che contiene 7,5 µ g diHA per virus. Si deve fare attenzione a somministrare ciascuno alla dose appropriata per ogni prodotto in questa fascia d’età. Se non sono disponibili siringhe preriempite, la dose appropriata può essere presa da un flaconcino monouso o multidose, al volume appropriato per il prodotto dato.
I bambini di età compresa tra i 36 mesi e i 17 anni (per i quali sono autorizzati solo gli IIV intramuscolari) e gli adulti di età ≥18 anni che ricevono preparati intramuscolari di IIV dovrebbero ricevere 0,5 ml per dose. Se una dose più piccola di vaccino intramuscolare (ad esempio, 0,25 ml) viene somministrato inavvertitamente ad un adulto, una dose aggiuntiva di 0,25 ml deve essere somministrata per fornire una dose completa (0,5 ml). Se l’errore viene scoperto in seguito (dopo che il paziente ha lasciato l’impostazione di vaccinazione), una dose completa di 0,5 ml deve essere somministrata non appena il paziente può tornare. La vaccinazione con una formulazione approvata per uso adulto deve essere conteggiata come dose se somministrata inavvertitamente ad un bambino.
Ad eccezione del Fluzone Intradermal Quadrivalent (Sanofi Pasteur, Swiftwater, Pennsylvania), le IIV vengono somministrate per via intramuscolare. Per gli adulti e i bambini più grandi, il deltoide è il sito preferito. I neonati e i bambini più piccoli devono essere vaccinati nella coscia anterolaterale. Ulteriori indicazioni specifiche riguardanti la selezione del sito e la lunghezza dell’ago per la somministrazione intramuscolare sono fornite nelle Linee guida generali di buona pratica per l’immunizzazione ACIP (52). Fluzone Intradermal Quadrivalent è somministrato per via intradermica, preferibilmente sopra il muscolo deltoide, utilizzando il sistema di distribuzione incluso (36). Due IIV, Afluria e Afluria Quadrivalent (Seqirus, Parkville, Victoria, Australia), sono autorizzati alla somministrazione intramuscolare tramite iniettore a getto (Stratis; Pharmajet, Golden, Colorado) per persone di età compresa tra i 18 e i 64 anni (39,76).
Trivalente contro quadrivalente IIV: IIV sia trivalenti che quadrivalenti saranno disponibili durante la stagione 2017-18. I vaccini quadrivalenti contengono un virus di ciascuna delle due stirpi B dell’influenza (un virus B/Victoria e un virus B/Yamagata), mentre i vaccini trivalenti contengono un virus B dell’influenza di una stirpe. I vaccini trivalenti sono quindi progettati per fornire una protezione più ampia contro i virus B dell’influenza in circolazione. Tuttavia, non viene espressa alcuna preferenza né per l’IIV3 né per l’IIV4.
Controindicazioni e precauzioni per l’uso di IIV: I foglietti illustrativi del produttore e le linee guida CDC/ACIP aggiornate devono essere consultate per informazioni aggiornate sulle controindicazioni e le precauzioni per i singoli prodotti vaccinali. In generale, la storia di reazioni allergiche gravi al vaccino o a uno qualsiasi dei suoi componenti (uova incluse) è una controindicazione etichettata alla ricezione di IIV(Tabella 2). Tuttavia, l’ACIP formula raccomandazioni specifiche per l’uso del vaccino antinfluenzale per le persone con allergia all’uovo (vedi Persone con un’anamnesi di allergia all’uovo). Il vaccino antinfluenzale non è raccomandato per le persone con una storia di grave reazione allergica al vaccino o a componenti diversi dall’uovo. Le informazioni sui componenti del vaccino si trovano nei foglietti illustrativi di ogni produttore. L’uso profilattico di agenti antivirali è un’opzione per prevenire l’influenza tra le persone che non possono ricevere il vaccino (54).
Una malattia acuta moderata o grave, con o senza febbre, è una precauzione generale per la vaccinazione (52). Il GBS entro 6 settimane da una precedente dose di vaccino antinfluenzale è considerato una precauzione per l’uso di vaccini antinfluenzali(Tabella 2).
Vaccino per l’influenza ricombinante (RIV)
Prodotti disponibili: Due prodotti RIV, Flublok (RIV3) e Flublok Quadrivalent (RIV4), dovrebbero essere disponibili per la stagione influenzale 2017-18. RIV3 e RIV4 sono indicati per le persone di età ≥18 anni. I RIV sono prodotti senza l’uso di virus influenzali; pertanto, analogamente agli IIV, non si verificherà alcuna dispersione del virus del vaccino. Questi vaccini sono prodotti senza l’uso di uova e sono esenti da uova. Non viene espressa alcuna preferenza per i RIV rispetto agli IIV all’interno delle indicazioni specificate.
Dosaggio e somministrazione: I RIV sono somministrati per iniezione intramuscolare. Una dose di 0,5 ml contiene 45 µ g diHA derivati da ciascun virus vaccinale (135 µ g in totaleper RIV3 e 180 µ g in totale per RIV4).
RIVtrivalente contro RIV quadrivalente: Sia il RIV trivalente che il RIV quadrivalente saranno disponibili durante la stagione 2017-18. I vaccini quadrivalenti contengono un virus di ciascuna delle due stirpi B dell’influenza (un virus B/Victoria e un virus B/Yamagata), mentre i vaccini trivalenti contengono un virus B dell’influenza di una stirpe. I vaccini trivalenti sono quindi progettati per fornire una protezione più ampia contro i virus B dell’influenza in circolazione. Tuttavia, non viene espressa alcuna preferenza né per RIV3 né per RIV4.
Controindicazioni e precauzioni per l’uso del RIV: I RIV sono controindicati nelle persone che hanno avuto una grave reazione allergica a qualsiasi componente del vaccino. Una malattia acuta moderata o grave, con o senza febbre, è una precauzione generale per la vaccinazione (52). Il GBS entro 6 settimane da una precedente dose di vaccino antinfluenzale è considerato una precauzione per l’uso di vaccini antinfluenzali(Tabella 2). Flublok non è autorizzato per l’uso nei bambini di età inferiore ai 18 anni.
Vaccino antinfluenzale in diretta (LAIV4)
In attesa di ulteriori dati, per la stagione 2017-18, ACIP raccomanda di non utilizzare LAIV4 a causa delle preoccupazioni riguardanti la sua efficacia contro i virus dell’influenza A(H1N1)pdm09 negli Stati Uniti durante le stagioni 2013-14 e 2015-16. Poiché si tratta di un vaccino autorizzato e potrebbe essere disponibile durante il 2017-18, il materiale in questa sezione è fornito a titolo informativo.
Dosaggio e somministrazione: LAIV4 viene somministrato per via intranasale utilizzando l’irroratore monouso pre-riempito fornito, contenente 0,2 mL di vaccino. Circa 0,1 mL (cioè la metà del contenuto totale dello spruzzatore) viene spruzzato nella prima narice mentre il destinatario è in posizione eretta. Una clip divisore di dose allegata viene rimossa dallo spruzzatore per somministrare la seconda metà della dose nell’altra narice. Se il ricevente del vaccino starnutisce immediatamente dopo la somministrazione, la dose non deve essere ripetuta. Tuttavia, se è presente una congestione nasale che potrebbe impedire la somministrazione del vaccino alla mucosa nasofaringea, si dovrebbe considerare il rinvio della somministrazione fino alla risoluzione della malattia, o si dovrebbe invece somministrare un altro vaccino appropriato.
Controindicazioni e precauzioni: ACIP raccomanda di non utilizzare LAIV4 durante la stagione 2017-18. Le linee guida precedentemente emesse in merito alle controindicazioni e alle precauzioni sono fornite solo a scopo informativo(Tabella 2).
Nuove approvazioni di prodotti per vaccini antinfluenzali
Dalla pubblicazione della guida della stagione precedente, ci sono state due nuove approvazioni di prodotto (Afluria Quadrivalent e Flublok Quadrivalent) e una modifica dell’indicazione approvata per un prodotto esistente (estensione dell’indicazione dell’età per FluLaval Quadrivalent da ≥3 anni a ≥6 mesi).
Afluria Quadrivalent (IIV4)
Afluria Quadrivalent (IIV4, Seqirus, Parkville, Victoria, Australia) è stato autorizzato dalla FDA nell’agosto 2016, per persone di età ≥18 anni, ed è stato disponibile durante la stagione 2016-17 accanto alla formulazione trivalente di Afluria. In uno studio di prelicenziamento della sicurezza e dell’immunogenicità di Afluria Quadrivalent rispetto a due formulazioni di Afluria (ciascuna contenente uno dei due virus B dell’influenza contenuti nel quadrivalente) tra persone di età ≥18 anni, Afluria Quadrivalent ha soddisfatto criteri predefiniti di non inferiorità immunologica per tutti e quattro i virus del vaccino, e criteri di superiorità immunologica per ciascun virus B rispetto alla formulazione trivalente contenente il virus B alternativo.
Alcune reazioni locali del sito di iniezione sono state più comuni tra coloro che hanno ricevuto Afluria Quadrivalent, incluso uno squilibrio di indurimento/rigonfiamento del sito di iniezione di grado 3 allo 0.3% nel gruppo Afluria Quadrivalent e allo 0.06% nei gruppi trivalenti di Afluria in pool), ma i tassi di queste reazioni sono stati complessivamente bassi (77,78).
Flublok Quadrivalente (RIV4)
Flublok Quadrivalent (RIV4; Protein Sciences, Meriden, Connecticut) è stato autorizzato dalla FDA nell’ottobre 2016, per persone di età ≥18 anni. Si prevede che Flublok Quadrivalent sarà disponibile per la stagione 2017-18, accanto alla formulazione trivalente di Flublok. In un’analisi pre-licenziata dei dati di immunogenicità di un sottoinsieme di partecipanti iscritti a uno studio randomizzato di efficacia relativa che confronta il Flublok Quadrivalente con un comparatore standard IIV4 a dosi standard autorizzato tra persone di età ≥50 anni durante la stagione 2014-15, Flublok Quadrivalent ha soddisfatto i criteri di non inferiorità rispetto al comparatore IIV4 per gli antigeni A(H3N2) e B/Yamagata, ma non per gli antigeni A(H1N1) o B/Victoria (47). In un’analisi esplorativa dei dati di questo studio (N = 8.604), Flublok Quadrivalent ha dimostrato un’efficacia relativa superiore del 30% (intervallo di confidenza del 95% [CI] = 10-47) rispetto a IIV4 (46,47). In un secondo studio di prelicenziamento, che ha valutato la sicurezza, la reattogenicità e l’immunogenicità rispetto a un IIV4 autorizzato tra persone di età compresa tra i 18 e i 49 anni nella stagione 2014-15, Flublok Quadrivalent ha soddisfatto i criteri di non inferiorità rispetto al comparatore IIV4 per gli antigeni A(H1N1), A(H3N2) e B/Yamagata, ma non per l’antigene B/Victoria. I dati sulla sicurezza di entrambi gli studi hanno suggerito una sicurezza comparabile a quella del comparatore IIV4 per le persone di età ≥18 anni (47).
FluLaval Quadrivalente (IIV4)
Nel novembre 2016, la FDA ha approvato l’espansione dell’indicazione dell’età autorizzata per FluLaval Quadrivalent (IIV4; ID Biomedical Corporation of Quebec, Quebec City, Quebec, Canada). Precedentemente autorizzato per persone di età ≥3 anni, FluLaval Quadrivalent è ora autorizzato per persone di età ≥6 mesi. Il volume di dose approvato è di 0,5 ml per tutte le età. Ciò rappresenta una nuova opzione per la vaccinazione dei bambini dai 6 ai 35 mesi, per i quali in precedenza l’unica formulazione di vaccino antinfluenzale approvata era il volume di dose di 0,25 ml di Fluzone Quadrivalent. Con questa approvazione, i bambini di questa fascia di età possono ricevere 0,5 ml di FluLaval Quadrivalente o 0,25 ml di Fluzone Quadrivalente per ogni dose necessaria.
In uno studio di prelicenziamento che ha confrontato l’immunogenicità e la sicurezza di 0,5 ml di FluLaval Quadrivalent con quella di 0,25 ml di Fluzone Quadrivalent tra i bambini dai 6 ai 35 mesi, FluLaval Quadrivalent ha soddisfatto i criteri di non inferiorità immunogenica per tutti e quattro i ceppi vaccinali. Sicurezza e reattogenicità erano simili tra i due vaccini (30,79).
Stoccaggio e manipolazione di vaccini antinfluenzali
In tutti i casi, le informazioni sulla confezione del produttore approvato devono essere consultate per una guida autorevole sulla conservazione e la manipolazione di tutti i vaccini antinfluenzali. I vaccini devono essere protetti dalla luce e conservati a temperature raccomandate. In generale, si raccomanda di conservare i vaccini antinfluenzali in frigorifero tra i 2° e gli 8°C (da 36° a 46°F) e non devono essere congelati. Il vaccino che è stato congelato deve essere scartato. Inoltre, la catena del freddo deve essere mantenuta quando LAIV4 viene trasportato. Le fiale monodose non devono essere accessibili per più di una dose. I flaconcini a dose multipla devono essere riportati alle condizioni di conservazione raccomandate tra un uso e l’altro e, una volta accessibili per la prima volta, non devono essere conservati oltre il periodo di tempo raccomandato. Per informazioni sulle escursioni termiche consentite e altre deviazioni dalle condizioni di conservazione raccomandate che non sono discusse nell’etichettatura della confezione, contattare il produttore. I vaccini non dovrebbero essere utilizzati dopo la data di scadenza riportata sull’etichetta.
Ulteriori fonti di informazione sull’influenza e sui vaccini
Sorveglianza, prevenzione e controllo dell’influenza
Informazioni aggiornate sulla sorveglianza, il rilevamento, la prevenzione e il controllo dell’influenza sono disponibili sul sito https://www.cdc.gov/flu. I dati della sorveglianza statunitense vengono aggiornati settimanalmente nel periodo ottobre-maggio su FluView(https://www.cdc.gov/flu/weekly). Inoltre, gli aggiornamenti periodici relativi all’influenza sono pubblicati su MMWR(https://www.cdc.gov/mmwr). Ulteriori informazioni sul vaccino antinfluenzale possono essere ottenute presso il CDC chiamando il numero 1-800-232-4636. I dipartimenti sanitari statali e locali devono essere consultati in merito alla disponibilità di vaccino antinfluenzale, all’accesso ai programmi di vaccinazione, alle informazioni relative all’attività influenzale statale o locale, alla segnalazione di focolai di influenza e di decessi pediatrici legati all’influenza e ai consigli sul controllo dei focolai.
Sistema di segnalazione degli eventi avversi del vaccino
Il National Childhood Vaccine Injury Act del 1986 richiede ai fornitori di assistenza sanitaria di segnalare qualsiasi evento avverso elencato dal produttore del vaccino come controindicazione ad ulteriori dosi del vaccino, o qualsiasi evento avverso elencato nella VAERS Table of Reportable Events Following Vaccination(https://vaers.hhs.gov/docs/VAERS_Table_of_Reportable_Events_Following_Vaccination.pdf) che si verifica entro il periodo di tempo specificato dopo la vaccinazione. Oltre alla segnalazione obbligatoria, i fornitori di assistenza sanitaria sono incoraggiati a segnalare alla VAERS qualsiasi evento avverso clinicamente significativo dopo la vaccinazione. Informazioni su come segnalare un evento avverso del vaccino sono disponibili all’indirizzo https://vaers.hhs.gov/index.html. Ulteriori informazioni su VAERS e sulla sicurezza del vaccino sono disponibili all’indirizzo e-mail info@vaers.org o chiamando il numero 1-800-822-7967.
Programma nazionale di compensazione degli infortuni da vaccino
Il National Vaccine Injury Compensation Program (VICP), istituito dal National Childhood Vaccine Injury Act del 1986, e successive modifiche, fornisce un meccanismo attraverso il quale è possibile pagare un risarcimento per conto di una persona che si ritiene sia stata ferita o sia morta in seguito alla ricezione di un vaccino coperto dal VICP. La Vaccine Injury Table(https://www.hrsa.gov/vaccinecompensation/vaccineinjurytable.pdf) elenca i vaccini coperti dal VICP e le lesioni e le condizioni associate (compreso il decesso) che potrebbero ricevere una presunzione legale di causalità. Se la lesione o la condizione non è presente sulla Tabella, o non si verifica entro il periodo di tempo specificato sulla Tabella, le persone devono provare che il vaccino ha causato la lesione o la condizione. L’ammissibilità al risarcimento non è influenzata dal fatto che un vaccino coperto sia utilizzato off-label o in contrasto con le raccomandazioni.
Per avere diritto al risarcimento ai sensi del VICP, il reclamo deve essere presentato entro 3 anni dal primo sintomo della lesione da vaccino. Le richieste di risarcimento per decesso devono essere presentate entro 2 anni dal decesso legato al vaccino e non più di 4 anni dopo l’inizio del primo sintomo della lesione legata al vaccino da cui è avvenuto il decesso. Quando un nuovo vaccino è coperto dal VICP o quando un nuovo infortunio/condizione viene aggiunto alla Tabella, le richieste di risarcimento che non soddisfano le linee guida generali di deposito devono essere presentate entro 2 anni dalla data in cui il vaccino o l’infortunio/condizione viene aggiunto alla Tabella per lesioni o decessi verificatisi fino a 8 anni prima del cambiamento della Tabella (80). Le persone di tutte le età che ricevono un vaccino coperto da VICP potrebbero avere diritto a presentare una richiesta di rimborso. Ulteriori informazioni sono disponibili all’indirizzo https://www.hrsa.gov/vaccinecompensation o chiamando il numero 1-800-338-2382.
Risorse aggiuntive
Dichiarazioni ACIP
- Linee guida generali sulle migliori pratiche per l’immunizzazione: Guida alle migliori pratiche del Comitato consultivo sulle pratiche di vaccinazione (ACIP). https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/index.html
- Immunizzazione del personale sanitario: Raccomandazioni del Comitato consultivo sulle pratiche di vaccinazione (ACIP), 2011. MMWR Recomm Recommended Rep 2011;60(No. RR-7). https://www.cdc.gov/mmwr/preview/mmwrhtml/rr6007a1.htm
- Programmi di vaccinazione consigliati per adulti, 2017: https://www.cdc.gov/vaccines/schedules/hcp/adult.html
- Programma di vaccinazione raccomandato per bambini e adolescenti di età pari o inferiore ai 18 anni, 2017: https://www.cdc.gov/vaccines/schedules/hcp/child-adolescent.html
Fogli informativi sui vaccini (VIS)
- VIS per IIV e RIV: https://www.cdc.gov/vaccines/hcp/vis/vis-statements/flu.pdf
- VIS per LAIV: https://www.cdc.gov/vaccines/hcp/vis/vis-statements/flulive.pdf
Influenza Vaccino pacchetto inserti
- Vaccini trivalenti: https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm094045.htm
- Vaccini quadrivalenti: https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm295057.htm
CDC Influenza Guida Antivirale CDC
- Farmaci antivirali: Informazioni per gli operatori sanitari: https://www.cdc.gov/flu/professionals/antivirals/index.htm
Guida dell’Accademia Americana di Pediatria (AAP)
- Raccomandazioni AAP per la prevenzione e il controllo dell’influenza nei bambini: https://redbook.solutions.aap.org/ss/influenza-resources.aspx
Guida della Società Americana per le Malattie Infettive (IDSA)
- 2013 IDSA Clinical Practice Guideline for Vaccination of the Immunocompromised Host: https://academic.oup.com/cid/article/58/3/e44/336537/2013-IDSA-Clinical-Practice-Guideline-for-IDSA-Clinical-Practice-Guideline-for*Un elenco dei membri del gruppo di lavoro si trova a pagina 20 di questo rapporto.
References
- Excess pneumonia and influenza associated hospitalization during influenza epidemics in the United States, 1970–78.. Am J Public Health. 1986; 76:761-5. DOI | PubMed
- Impact of epidemic type A influenza in a defined adult population.. Am J Epidemiol. 1980; 112:798-811. DOI | PubMed
- New Vaccine Surveillance Network. The underrecognized burden of influenza in young children.. N Engl J Med. 2006; 355:31-40. DOI | PubMed
- Influenza Incidence Surveillance Project Working Group. Incidence of medically attended influenza during pandemic and post-pandemic seasons through the Influenza Incidence Surveillance Project, 2009-13.. Lancet Respir Med. 2015; 3:709-18. DOI | PubMed
- Pandemic H1N1 Influenza in Pregnancy Working Group. Pandemic 2009 influenza A(H1N1) virus illness among pregnant women in the United States.. JAMA. 2010; 303:1517-25. DOI | PubMed
- Vaccine Safety Datalink Adult Working Group. Influenza- and RSV-associated hospitalizations among adults.. Vaccine. 2007; 25:846-55. DOI | PubMed
- Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010.. MMWR Recomm Rep. 2010; 59(No. RR-8):1-62. PubMed
- Prevention and control of seasonal influenza with vaccines.. MMWR Recomm Rep. 2016; 65(No. RR-5)PubMed
- Advisory Committee on Immunization Practices (ACIP). 2016.
- CDC. 2015. Publisher Full Text
- Low and decreasing vaccine effectiveness against influenza A(H3) in 2011/12 among vaccination target groups in Europe: results from the I-MOVE multicentre case-control study.. Euro Surveill. 2013; 18PubMed
- Waning vaccine protection against influenza A (H3N2) illness in children and older adults during a single season.. Vaccine. 2015; 33:246-51. DOI | PubMed
- Primary Health Care Sentinel Network. Network for Influenza Surveillance in Hospitals of Navarre. Decline in influenza vaccine effectiveness with time after vaccination, Navarre, Spain, season 2011/12.. Euro Surveill. 2013; 18(
- Vaccine effectiveness of 2011/12 trivalent seasonal influenza vaccine in preventing laboratory-confirmed influenza in primary care in the United Kingdom: evidence of waning intra-seasonal protection.. Euro Surveill. 2013; 18(:18. PubMed
- Evaluation of the efficacy of split-product trivalent A(H1N1), A(H3N2), and B influenza vaccines: reactogenicity, immunogenicity and persistence of antibodies following two doses of vaccines.. Microbiol Immunol. 1986; 30:1141-9. DOI | PubMed
- Kinetics of humoral antibody response to trivalent inactivated split influenza vaccine in subjects previously vaccinated or vaccinated for the first time.. Vaccine. 1996; 14:1108-10. DOI | PubMed
- Long-term immunogenicity of influenza vaccine among the elderly: risk factors for poor immune response and persistence.. Vaccine. 2010; 28:3929-35. DOI | PubMed
- Persistence of antibodies to influenza hemagglutinin and neuraminidase following one or two years of influenza vaccination.. J Infect Dis. 2015; 212:1914-22. DOI | PubMed
- Rapid decline of influenza vaccine-induced antibody in the elderly: is it real, or is it relevant?. J Infect Dis. 2008; 197:490-502. DOI | PubMed
- Intraseason waning of influenza vaccine protection: Evidence from the US Influenza Vaccine Effectiveness Network, 2011–12 through 2014–15.. Clin Infect Dis. 2017; 64:544-50. PubMed
- Immunization of health-care personnel: recommendations of the Advisory Committee on Immunization Practices (ACIP).. MMWR Recomm Rep. 2011; 60(No. RR-7)PubMed
- Influenza vaccination of health-care personnel: recommendations of the Healthcare Infection Control Practices Advisory Committee (HICPAC) and the Advisory Committee on Immunization Practices (ACIP).. MMWR Recomm Rep. 2006; 55(No. RR-2)PubMed
- Trials of influenza A/New Jersey/76 virus vaccine in normal children: an overview of age-related antigenicity and reactogenicity.. J Infect Dis. 1977; 136(Suppl):S731-41. DOI | PubMed
- Summary of clinical trials of influenza vaccines–II.. J Infect Dis. 1976; 134:633-8. DOI | PubMed
- Clinical reactions and serologic response following inactivated monovalent influenza type B vaccine in young children and infants.. J Pediatr. 1976; 88:31-5. DOI | PubMed
- Reactogenicity and immunogenicity of bivalent influenza vaccine in one- and two-dose trials in children: a summary.. J Infect Dis. 1977; 136(Suppl):S616-25. DOI | PubMed
- Clinical reactions and serologic responses after vaccination with whole-virus or split-virus influenza vaccines in children aged 6 to 36 months.. Pediatrics. 1982; 69:404-8. PubMed
- Randomized controlled trial of dose response to influenza vaccine in children aged 6 to 23 months.. Pediatrics. 2011; 128:e276-89. DOI | PubMed
- Safety and immunogenicity of full-dose trivalent inactivated influenza vaccine (TIV) compared with half-dose TIV administered to children 6 through 35 months of age.. J Pediatric Infect Dis Soc. 2015; 4:214-24. DOI | PubMed
- Time to change dosing of inactivated quadrivalent influenza vaccine in young children: evidence from a Phase III, randomized, controlled trial.. J Pediatric Infect Dis Soc. 2017; 6:9-19. PubMed
- Immunogenicity and reactogenicity of 1 versus 2 doses of trivalent inactivated influenza vaccine in vaccine-naive 5-8-year-old children.. J Infect Dis. 2006; 194:1032-9. DOI | PubMed
- Influenza vaccine effectiveness in healthy 6- to 21-month-old children during the 2003-2004 season.. J Pediatr. 2006; 149:755-62. DOI | PubMed
- Effectiveness of the 2003-2004 influenza vaccine among children 6 months to 8 years of age, with 1 vs 2 doses.. Pediatrics. 2005; 116:153-9. DOI | PubMed
- New Vaccine Surveillance Network. Vaccine effectiveness against laboratory-confirmed influenza in children 6 to 59 months of age during the 2003–2004 and 2004-2005 influenza seasons.. Pediatrics. 2008; 122:911-9. DOI | PubMed
- .
- .
- .
- .
- .
- . Flucelvax Quadrivalent [package insert]. Holly Springs, NC: Seqirus;
- .
- .
- Efficacy of high-dose versus standard-dose influenza vaccine in older adults.. N Engl J Med. 2014; 371:635-45. DOI | PubMed
- .
- Food and Drug Administration. 2014.
- PSC12 Study Team. Efficacy of recombinant influenza vaccine in adults 50 years of age or older.. N Engl J Med. 2017; 376:2427-36. DOI | PubMed
- Food and Drug Administration. 2016.
- The comparative effectiveness of adjuvanted and unadjuvanted trivalent inactivated influenza vaccine (TIV) in the elderly.. Vaccine. 2013; 31:6122-8. DOI | PubMed
- Prevention of serious events in adults 65 years of age or older: A comparison between high-dose and standard-dose inactivated influenza vaccines.. Vaccine. 2015; 33:4988-93. DOI | PubMed
- Efficacy and immunogenicity of high-dose influenza vaccine in older adults by age, comorbidities, and frailty.. Vaccine. 2015; 33:4565-71. DOI | PubMed
- High-dose trivalent influenza vaccine compared to standard dose vaccine in elderly adults: safety, immunogenicity and relative efficacy during the 2009-2010 season.. Vaccine. 2013; 31:861-6. DOI | PubMed
- 2017. Publisher Full Text
- Infectious Diseases Society of America. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host.. Clin Infect Dis. 2014; 58:309-18. DOI | PubMed
- CDC.Publisher Full Text
- 2009. DOI
- CDC. 2012.
- CDC. 2013.
- Cruise ships: high-risk passengers and the global spread of new influenza viruses.. Clin Infect Dis. 2000; 31:433-8. DOI | PubMed
- Alaska/Yukon Territory Respiratory Outbreak Investigation Team. Large summertime influenza A outbreak among tourists in Alaska and the Yukon Territory.. Clin Infect Dis. 2003; 36:1095-102. DOI | PubMed
- Influenza virus infection in travelers to tropical and subtropical countries.. Clin Infect Dis. 2005; 40:1282-7. DOI | PubMed
- Incidence and risk factors for acute respiratory illnesses and influenza virus infections in Australian travellers to Asia.. J Clin Virol. 2013; 57:54-8. DOI | PubMed
- .
- Safety and immunogenicity profile of the concomitant administration of ZOSTAVAX and inactivated influenza vaccine in adults aged 50 and older.. J Am Geriatr Soc. 2007; 55:1499-507. DOI | PubMed
- Randomized, controlled trial of a 13-valent pneumococcal conjugate vaccine administered concomitantly with an influenza vaccine in healthy adults.. Clin Vaccine Immunol. 2012; 19:1296-303. DOI | PubMed
- A randomized, double-blind trial to evaluate immunogenicity and safety of 13-valent pneumococcal conjugate vaccine given concomitantly with trivalent influenza vaccine in adults aged ≥65 years.. Vaccine. 2011; 29:5195-202. DOI | PubMed
- Comparison of the safety and immunogenicity of concomitant and sequential administration of an adult formulation tetanus and diphtheria toxoids adsorbed combined with acellular pertussis (Tdap) vaccine and trivalent inactivated influenza vaccine in adults.. Vaccine. 2007; 25:3464-74. DOI | PubMed
- Immunogenicity and safety of concomitant MF59-adjuvanted influenza vaccine and 23-valent pneumococcal polysaccharide vaccine administration in older adults.. Vaccine. 2015; 33:4647-52. DOI | PubMed
- Safety of tetanus toxoid, reduced diphtheria toxoid, and acellular pertussis and influenza vaccinations in pregnancy.. Obstet Gynecol. 2015; 126:1069-74. DOI | PubMed
- Risk of fever after pediatric trivalent inactivated influenza vaccine and 13-valent pneumococcal conjugate vaccine.. JAMA Pediatr. 2014; 168:211-9. PubMed
- Post licensure surveillance of influenza vaccines in the Vaccine Safety Datalink in the 2013–2014 and 2014–2015 seasons.. Pharmacoepidemiol Drug Saf. 2016; 8:928-34.
- LAIV Study Group. Safety and immunogenicity of concurrent administration of live attenuated influenza vaccine with measles-mumps-rubella and varicella vaccines to infants 12 to 15 months of age.. Pediatrics. 2008; 121:508-16. DOI | PubMed
- Influenza vaccine concurrently administered with a combination measles, mumps, and rubella vaccine to young children.. Vaccine. 2010; 28:1566-74. DOI | PubMed
- A multinational, randomized, placebo-controlled trial to assess the immunogenicity, safety, and tolerability of live attenuated influenza vaccine coadministered with oral poliovirus vaccine in healthy young children.. Vaccine. 2009; 27:5472-9. DOI | PubMed
- Food and Drug Administration. 2017.
- .
- Food and Drug Administration. 2016.
- Immunogenicity and safety of a quadrivalent inactivated influenza vaccine compared with two trivalent inactivated influenza vaccines containing alternate B strains in adults: A phase 3, randomized noninferiority study.. Vaccine. 2017; 35:1856-64. DOI | PubMed
- Food and Drug Administration. 2016.
- Health Resources and Services Administration. 2017.
Fonte
Grohskopf LA, Sokolow LZ, Broder KR, Walter EB, Bresee JS, et al. (2017) Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2017–18 Influenza Season. MMWR Recommendations and Reports 66(2): . https://doi.org/10.15585/mmwr.rr6602a1





