Introduzione
Il modello a due processi per la regolazione del sonno, postulato per la prima volta da Borbély nel 1982, è ancora oggi considerato il quadro concettuale più accurato per descrivere come la pressione del sonno si costruisce e si disperde nel corso della giornata (Borbély, 1982). Secondo il modello, la propensione al sonno in un dato momento integra due meccanismi biologici indipendenti: un regolatore circadiano (processo C) e un regolatore omeostatico (processo S). Il regolatore circadiano è sotto controllo dell’orologio circadiano e indipendente da fattori esterni. Il regolatore omeostatico, invece, è un tracciatore del sonno passato ed è responsabile dell’accumulo di pressione del sonno dopo la privazione del sonno, o del suo rilascio dopo un pisolino(Borbély e Achermann, 1999). L’idea di un ‘processo S’ si basa storicamente sulle registrazioni elettrofisiologiche ottenute nei mammiferi e, in particolare, sull’osservazione che i correlati elettrofisiologici a bassa frequenza dell’attività neuronale – il sonno a onde lente – aumentano con la privazione del sonno, si dissipano con il sonno e possono quindi agire come marcatori biologici della pressione del sonno. La separazione di base tra un regolatore circadiano e un regolatore omeostatico, tuttavia, è un concetto fondamentale che vive al di là dell’elettrofisiologia e può essere adottato per modellare la pressione del sonno anche negli animali in cui i correlati elettroencefalografici (EEG) del sonno sono molto diversi o sconosciuti(Campbell e Tobler, 1984). In quasi tutti gli animali testati finora, la privazione del sonno porta ad un conseguente aumento del rimbalzo del sonno(Cirelli e Tononi, 2008). La comprensione delle basi biologiche del processo C e del processo S è un importante compito investigativo, non solo per scoprire i meccanismi che regolano il sonno, ma anche la sua funzione. Scoprire come e perché la pressione del sonno aumenta in seguito alla privazione del sonno può essere fondamentale per scoprire a cosa serve il sonno.
Oltre a un omeostatico e a un controllore circadiano, sappiamo che altri fattori possono modulare il sonno. La maggior parte delle persone nella società occidentale si lamenterà delle cattive abitudini di sonno e questo non è generalmente dovuto al malfunzionamento del processo S o del processo C, ma, invece, a cause sociali o generalmente ambientali ed emotive (ad esempio, stress, ansia, eccitazione, fame, amore)(Ohayon, 2002; Adolescent Sleep Working Group et al., 2014).
Dal punto di vista sperimentale, le variazioni della temperatura ambientale e le restrizioni alimentari costituiscono due importanti esempi di modulazione del sonno in base alle condizioni ambientali. Nelle mosche, è stato dimostrato che un aumento della temperatura durante la notte ha effetti profondi sul modello del sonno, ma non necessariamente sulla quantità totale di sonno(Lamaze et al., 2017; Parisky et al., 2016). Nei ratti(Danguir e Nicolaidis, 1979), negli esseri umani(MacFadyen et al., 1973) e nelle mosche(Keene et al., 2010) è stato dimostrato che la fame porta a una rapida diminuzione della quantità di sonno. Nei mammiferi, ciò è correlato anche con le differenze qualitative del modello EEG(Danguir e Nicolaidis, 1979). Oltre ad una forte conservazione evolutiva a livello comportamentale, l’apporto calorico e il sonno sono anche geneticamente collegati, poiché è stato dimostrato che le stesse proteine e i neuromodulatori controllano entrambi(Willie et al., 2001). Tuttavia, il rapporto tra i due è complicato anche dal fatto che la restrizione calorica ha profonde conseguenze sul metabolismo.
Qui descriviamo un nuovo paradigma per studiare la connessione comportamentale, neuronale e genetica tra ambiente e sonno: il desiderio sessuale. Troviamo che, nelle mosche maschili, l’eccitazione sessuale ha effetti profondi sul sonno, e che l’esperienza sessuale o anche l’esposizione ai soli feromoni sono stimoli sufficienti per contrastare la pressione del sonno dopo la privazione del sonno.
Risultati
Effetti paradossali della privazione sociale del sonno sul rimbalzo del sonno
Dopo essere stata privata con forza del sonno, Drosophila melanogaster mostra costantemente un aumento della pressione del sonno, sotto forma di un concomitante aumento della quantità di sonno(Huber et al., 2004) e della soglia di eccitazione(Faville et al., 2015). In altre parole, le mosche, come i mammiferi, sembrano dormire più a lungo e più profondamente dopo la privazione del sonno ed entrambi sono chiari segni di quello che normalmente viene definito “rimbalzo del sonno”, un segno distintivo dell’omeostasi del sonno. Per privare le mosche del sonno, la maggior parte dei ricercatori utilizzerebbe macchine meccaniche, come gli agitatori da laboratorio, che sottopongono gli animali a frequenti, se non continui, stimoli vibratori(Faville et al., 2015; Huber et al., 2004). In precedenza abbiamo dimostrato che un’interazione forzata e limitata dal punto di vista spaziale tra due maschi porta anche ad una robusta privazione del sonno che ha le stesse caratteristiche comportamentali e cellulari della privazione meccanica, compresa una simile misura di rimbalzo rilevabile e correlati biochimici comparabili(Gilestro et al., 2009). Per indagare ulteriormente su come l’interazione sociale influisce sul sonno, abbiamo ideato un paradigma sperimentale basato sull’analisi video assistita dal computer del comportamento. Utilizzando etoscopi, macchine di tracciamento video recentemente sviluppate nel nostro laboratorio(Geissmann et al., 2017), abbiamo monitorato e annotato il comportamento delle mosche sia in isolamento (giorni di base e di rimbalzo) che in gruppi di due (giorno di interazione). I vantaggi dell’uso del video tracking rispetto al sistema di divisione del raggio infrarosso quando si misura il sonno sono stati discussi a lungo altrove(Donelson et al., 2012; Gilestro, 2012; Zimmerman et al., 2008) e, probabilmente, il video tracking diventa ancora più convincente quando si monitorano più mosche che interagiscono nello stesso spazio.
Nel nostro esperimento archetipico, le mosche maschio di tipo selvaggio (CantonS) sono state tenute in isolamento sociale in piccoli tubi di vetro per cinque giorni, al fine di acclimatarsi al loro ambiente e di registrare la loro attività di base (vedi Materiali e metodi). Poi, all’inizio della giornata di interazione, abbiamo introdotto un secondo individuo nello spazio di registrazione ristretto: l’intruso. Per le interazioni MM, l’intruso era un altro maschio di diverso colore degli occhi(bianco1118, ciano in cifre). Per le interazioni MF, una femmina vergine di tipo selvaggio (pesca in cifre). Mock control maschi animali maschi hanno subito la stessa manipolazione sperimentale, ma sono stati tenuti in isolamento anche durante il giorno di interazione (mock, grigio in cifre). In tutti i casi, l’interazione è durata non più di 24 ore. Confermando i risultati precedenti(Gilestro et al., 2009), abbiamo trovato che le interazioni MM costantemente portato ad una privazione del sonno durante il periodo di interazione, e ad un notevole rimbalzo subito dopo(Figura 1A-D e Figura 1-figure supplement 1A,B). L’interazione MF ha portato ad una privazione di sonno ancora maggiore(Figura 1C) ma, sorprendentemente, non ha mostrato alcun rimbalzo successivo (pesca nella Figura 1B). Perché?
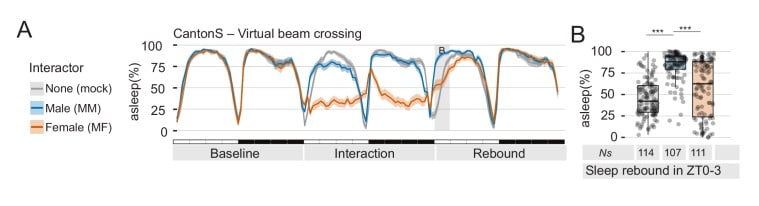
Figura 1-figure supplement 3.L’interazione sociale porta ad effetti paradossali sul rimbalzo del sonno.analisi del rimbalzo del sonno.punteggio comportamentale assistito umano del sonno a mosca singola in Mock, condizione solitaria(A), durante l’interazione MF (B), o interazione MM(C) per convalidare il punteggio automatico.dati DAM del fenotipo archetipico principale di questo lavoro, pubblicato per motivi di riproducibilità.(A) Profilo del sonno delle mosche CantonS maschi socialmente isolati che sono stati costretti a interagire per 24 ore con femmine vergini di tipo selvaggio (MF, pesca), maschi dagli occhi bianchi (MM, ciano) o finti manipolati (finto, grigio). Lo sfondo grigio ombreggiato indica l’area analizzata in B, C e D. La linea verticale del cruscotto indica il punto temporale per le dissezioni cerebrali mostrate in E,F.(B) Quantificazione del rimbalzo del sonno durante ZT0-3 il giorno del rimbalzo per gli esperimenti mostrati in A. Ns sotto le trame delle barre indicano il numero di animali utilizzati.(C) Quantificazione della quantità di sonno il giorno di interazione per le mosche mostrato in A. Il giorno di interazione, mock sono stati stimati per essere addormentato 40,6 ± 13% del tempo; MM 16 ± 8%; MF 1,1 ± 2% – media ±SD.(D) Rappresentante classificazione comportamentale del giorno di interazione per l’accoppiamento MM (pannello superiore n = 11) o MF accoppiamento (pannello inferiore n = 11). Ogni riga mostra il profilo comportamentale di un maschio durante le 24 ore di interazione sociale.(E) Immagine rappresentativa di tutto il montaggio anti-GFP immunostained mosche che esprimono CaLexA nei corpi ellissoidali utilizzando il driver R30G03. Barra di scala 10 µm.(F) Quantificazione dell’esperimento in E. In tutte le figure, * indica un p<0,05; **p<0,01; ***p<0,001 – pairwise Wilcoxon rank sum test con Benjamini e Hochberg correzione. In tutti gli etogrammi, le linee di colore scuro indicano i valori medi per il sonno, mentre i bordi opachi indicano un intervallo di confidenza di ricampionamento del 95% (vedi Materiali e metodi).(A) La lunghezza media dei periodi di sonno nella finestra ZT0-3 è ridotta dopo l’interazione MF ma non dopo l’interazione MM (Mock: 9,11 ± 0,24; MM: 9,07 ± 0,19; MF: 8,48 ± 0,29; minuti medi ± SE).(B) Il numero di episodi di sonno è aumentato dopo MM, ma non dopo l’interazione MF (Mock: 4,03 ± 0,27; MM: 7,55 ± 0,37; MF: 4,75 ± 0,35; media ±SE).La posizione di volo è stata segnata una volta ogni 240 s e i bidoni con movimento inferiore a metà della dimensione del corpo della mosca (30 pixel) sono stati segnati come addormentati. Ogni riga mostra i dati di una singola mosca maschile.L’attività e il sonno sono stati calcolati utilizzando il criterio della divisione del raggio infrarosso (divisione virtuale del raggio). Questa figura mostra ciò che gli utenti dovrebbero aspettarsi quando si esegue lo stesso paradigma nei monitor Trikinetics (Trikinetics inc.).

Figura 1-figure supplement 3.Figura 1— supplemento alla figura 3. L’interazione sociale porta ad effetti paradossali sul rimbalzo del sonno.l’analisi del rimbalzo del sonno.il punteggio comportamentale assistito umano del sonno a mosca singola in Mock, condizione solitaria(A), durante l’interazione MF (B), o l’interazione MM (C) per convalidare il punteggio automatico.i dati DAM del fenotipo archetipico principale di questo lavoro, pubblicato per motivi di riproducibilità.(A) Profilo del sonno delle mosche CantonS maschi socialmente isolati che sono stati costretti a interagire per 24 ore con femmine vergini di tipo selvaggio (MF, pesca), maschi dagli occhi bianchi (MM, ciano) o finti manipolati (finto, grigio). Lo sfondo grigio ombreggiato indica l’area analizzata in B, C e D. La linea verticale del cruscotto indica il punto temporale per le dissezioni cerebrali mostrate in E,F.(B) Quantificazione del rimbalzo del sonno durante ZT0-3 il giorno del rimbalzo per gli esperimenti mostrati in A. Ns sotto le trame delle barre indicano il numero di animali utilizzati.(C) Quantificazione della quantità di sonno il giorno di interazione per le mosche mostrato in A. Il giorno di interazione, mock sono stati stimati per essere addormentato 40,6 ± 13% del tempo; MM 16 ± 8%; MF 1,1 ± 2% – media ±SD.(D) Rappresentante classificazione comportamentale del giorno di interazione per l’accoppiamento MM (pannello superiore n = 11) o MF accoppiamento (pannello inferiore n = 11). Ogni riga mostra il profilo comportamentale di un maschio durante le 24 ore di interazione sociale.(E) Immagine rappresentativa di tutto il montaggio anti-GFP immunostained mosche che esprimono CaLexA nei corpi ellissoidali utilizzando il driver R30G03. Barra di scala 10 µm.(F) Quantificazione dell’esperimento in E. In tutte le figure, * indica un p<0,05; **p<0,01; ***p<0,001 – pairwise Wilcoxon rank sum test con Benjamini e Hochberg correzione. In tutti gli etogrammi, le linee di colore scuro indicano i valori medi per il sonno, mentre i bordi opachi indicano un intervallo di confidenza di ricampionamento del 95% (vedi Materiali e metodi).(A) La lunghezza media dei periodi di sonno nella finestra ZT0-3 è ridotta dopo l’interazione MF ma non dopo l’interazione MM (Mock: 9,11 ± 0,24; MM: 9,07 ± 0,19; MF: 8,48 ± 0,29; minuti medi ± SE).(B) Il numero di episodi di sonno è aumentato dopo MM, ma non dopo l’interazione MF (Mock: 4,03 ± 0,27; MM: 7,55 ± 0,37; MF: 4,75 ± 0,35; media ±SE).La posizione di volo è stata segnata una volta ogni 240 s e i bidoni con movimento inferiore a metà della dimensione del corpo della mosca (30 pixel) sono stati segnati come addormentati. Ogni riga mostra i dati di una singola mosca maschile.L’attività e il sonno sono stati calcolati utilizzando il criterio della divisione del raggio infrarosso (divisione virtuale del raggio). Questa figura mostra ciò che gli utenti dovrebbero aspettarsi quando si esegue lo stesso paradigma nei monitor Trikinetics (Trikinetics inc.).
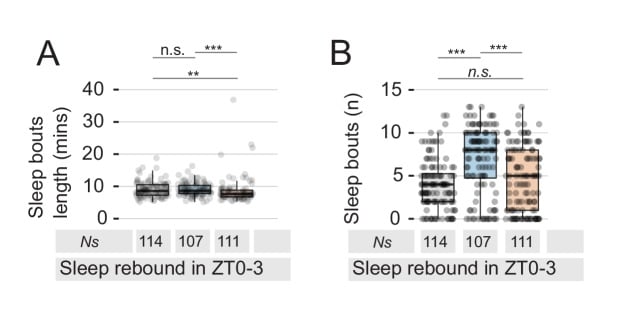
Figura 1-figure supplement 1.Analisi del rimbalzo del sonno.(A) La lunghezza media dei rimbalzi del sonno nella finestra ZT0-3 è ridotta dopo l’interazione MF ma non dopo l’interazione MM (Mock: 9,11 ± 0,24; MM: 9,07 ± 0,19; MF: 8,48 ± 0,29; minuti medi ± SE).(B) Il numero di episodi di sonno è aumentato dopo MM, ma non dopo l’interazione MF (Mock: 4,03 ± 0,27; MM: 7,55 ± 0,37; MF: 4,75 ± 0,35; media ±SE).
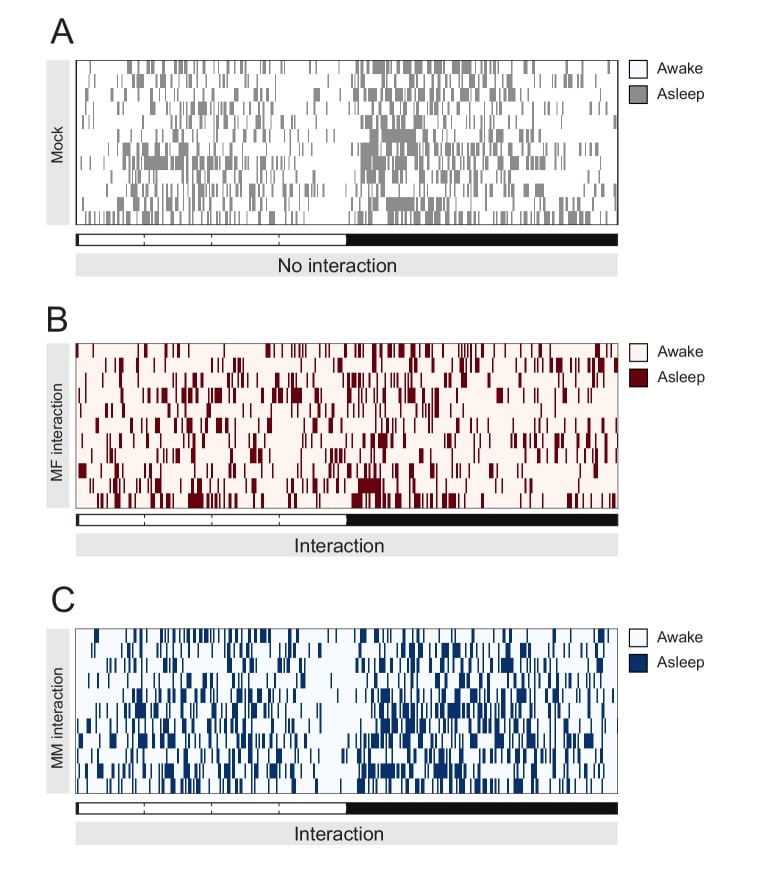
Figura 1-figure supplement 2.Umana assistita punteggio comportamentale del sonno mosca singola in Mock, condizione solitaria(A), durante l’interazione MF (B), o interazione MM(C) per convalidare il punteggio automatico.Posizione della mosca è stato segnato una volta ogni 240 s e bidoni con movimento più piccolo della metà di una dimensione del corpo mosca (30 pixel) sono stati segnati come addormentato. Ogni riga mostra i dati di una singola mosca maschile.

Figura 1-figure supplement 3.Dati DAM del principale fenotipo archetipico di questo lavoro, pubblicati per motivi di riproducibilità.L’attività ed il sonno sono stati calcolati utilizzando il criterio della divisione del raggio infrarosso (divisione virtuale del raggio). Questa figura mostra ciò che gli utenti dovrebbero aspettarsi quando si esegue lo stesso paradigma nei monitor Trikinetics (Trikinetics inc.).
L’interazione sociale porta a deprivazioni del sonno quantitativamente e qualitativamente diverse
Una prima spiegazione potrebbe essere che il nostro sistema di tracciamento sopravvaluta l’entità della privazione del sonno sperimentata nell’interazione MF. Per esplorare questa possibilità, abbiamo videoregistrato gli animali che interagiscono e abbiamo segnato manualmente il loro comportamento(Figura 1D e video interattivo attualmente disponibile su https://lab.gilest.ro/projects/raw-data/regulation-of-sleep-homeostasis-by-sex-pheromones-supplementary-videos/ – MF: 1082 bidoni segnaposti al giorno; MM: 1247 bidoni segnaposti al giorno) così come le loro coordinate euclidee (segnate 347 volte al giorno per Mock, MM e MF. Nmock = 12, NMMM = 11, NMF = 11). Il punteggio umano ha confermato il punteggio della macchina, così come i risultati precedenti(Fujii et al., 2007), e ha mostrato che l’interazione MF ha effettivamente portato ad un aumento sostenuto dell’attività(Figura 1D e Figura 1-figure supplement 2). In particolare, anche se tutte le coppie si sono copulate in pochi minuti dall’inizio dell’interazione (16,6 ± 15,7 min; media ±SD), i maschi hanno comunque trascorso in media il 47% del loro tempo a corteggiare attivamente la femmina (47 ± 16% nelle 24 ore; 61 ± 25% durante il giorno e 33 ± 12% durante la notte; media ±SD). Le mosche impegnate nell’interazione MM, d’altra parte, non erano fisicamente attive come le mosche in MF(Figura 1D e Figura 1-figure supplement 2), quindi non spiega ma rafforza il paradosso apparente di assenza di rimbalzo del sonno dopo l’interazione con una femmina.
Per caratterizzare ulteriormente le conseguenze dell’interazione sociale, abbiamo anche utilizzato un saggio CaLexA recentemente stabilito(Liu et al., 2016) per confrontare, a posteriori, l’attività neuronale nei neuroni R2 del corpo ellissoide dopo 24 ore di interazione sociale (MM o MF) o 24 ore di deprivazione meccanica del sonno (Figura 1E,F). Il sistema CaLexA utilizza un fattore di trascrizione calcio-responsabile per guidare una proteina fluorescente verde (GFP) nei neuroni che subiscono una prolungata attività di cottura(Masuyama et al., 2012). Il tasso di cottura dei neuroni R2 ha dimostrato di essere correlato con la stimolazione del sonno, quindi un aumento della fluorescenza CaLexA in quei neuroni può essere interpretato come un vero e proprio proxy per la cottura neuronale e, in ultima analisi, per la pressione del sonno(Liu et al., 2016). In tutte e tre le condizioni sperimentali, i neuroni R2 etichettati dal driver R30G03-GAL4 hanno mostrato un aumento sostenuto e simile nei livelli rilevabili di CaLexA-GFP rispetto al mock(Figura 1E,F), suggerendo che tutte e tre le condizioni suscitano una privazione del sonno relativamente efficiente.
Il sonno di rimbalzo è regolato da feromoni specifici della specie
Insieme, questi risultati mostrano che i maschi che si impegnano nell’interazione sessuale (a) sperimentano una privazione del sonno altamente efficiente(Figura 1C e Figura 1-figure supplement 2) e (b) mostrano aumenti dei marcatori neuronali che tipicamente compaiono dopo una veglia prolungata (Figura 1E e F). Perché allora non mostrano un sonno di rimbalzo? Una possibilità è che il ricordo del loro recente incontro sessuale possa motivarli a continuare a cercare un partner per l’accoppiamento. Per testare questa ipotesi, abbiamo sottoposto due mutanti della memoria canonica allo stesso paradigma sperimentale: dunce e rutabaga(Figura 2A,B e Figura 2-figure supplement 1A,B). Entrambi i mutanti sono tra i primi e i più caratteristici mutanti della memoria scoperti in Drosophila(Davis e Dauwalder, 1991; Levin et al., 1992) e hanno dimostrato di non essere in grado di consolidare la memoria in molte condizioni paradigmatiche, compreso il condizionamento del corteggiamento(Griffith e Ejima, 2009). Mentre il ruolo dell’ontano e della rutabaga nel contesto del condizionamento del corteggiamento è ben descritto(Joiner e Griffith, 1999), non si sa se le mosche posseggano una qualche memoria delle esperienze sessuali passate. Abbiamo ipotizzato che se il ricordo dell’esperienza passata è responsabile della soppressione del rimbalzo, ci si può aspettare di vedere un regolare rimbalzo nelle mosche dimenticate. Questo non è stato il caso(Figura 2A,B e Figura 2-figure supplement 1A,B). Come osservato nelle mosche di tipo selvaggio, i mutanti che apprendono hanno anche sperimentato un forte grado di privazione del sonno quando sono stati costretti ad interagire con le femmine(Figura 2-figure supplement 1A,B), ma anche loro non hanno avuto un rimbalzo del sonno il giorno dopo. Un rimbalzo regolare è stato osservato ancora una volta dopo l’interazione con le MM.
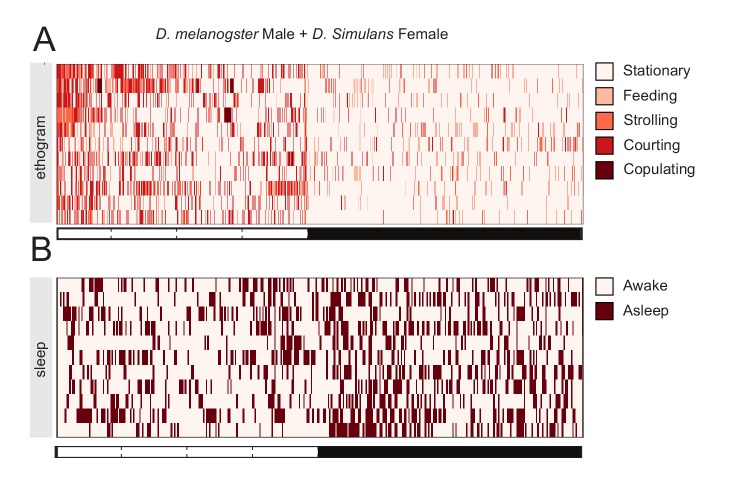
Figura 2-figure supplement 2.La rilevazione di feromoni femminili non volatili è sufficiente per sopprimere il rimbalzo del sonno dopo la privazione del sonno.etogrammi di tre giorni di sonno degli esperimenti descritti nella Figura 2.Inter-specifica interazione maschio-femmina.Tutti i grafici mostrano la quantificazione del rimbalzo del sonno durante lo ZT0-3 nel giorno del rimbalzo. Il numero totale di animali è mostrato sotto le trame dei box. Rimbalzo del sonno nella memoria dell’onciadifettosa1(A) e in rutabaga1(B) mutanti dopo Mock, MM o MF. La leggenda a sinistra di(A) si applica all’intera figura.(C) CantonS maschio vola dopo 24 ore di interazione con altri maschi, D. melanogaster femmine, D. simulans femmine o in finto controllo.(D) Sonno di rimbalzo in orcoanosmico1 mutanti dopo l’interazione Mock, MM, o MF.(E) CantonS maschio vola dopo l’interazione finta o l’interazione con i maschi dagli occhi bianchi seguita, al rimbalzo, dal controllo del veicolo o dai feromoni femminili.I grafici includono un giorno di linea di base, un giorno di interazione e un giorno di recupero. In tutti i pannelli, l’area grigia indica la finestra corrispondente dei dati mostrati in Figura 2. Effetti dell’interazione MM e MF nei mutanti di memoria dei geni somaro(A) e rutabaga(B).(C) Effetti dell’interazione tra i maschi di CantonS e le femmine di tipo selvaggio (pesca), i maschi di tipo selvaggio (ciano) o le femmine di tipo selvaggio D. simulans (malva).(D) Stesso paradigma sperimentale, in orcoanosmico1 maschi mutanti.(E) CantonS maschio vola dopo una finta interazione o un’interazione con maschi dagli occhi bianchi seguita, al rimbalzo, dal controllo del veicolo (blu scuro) o da feromoni femminili (blu chiaro).(A) Rappresentante classificazione comportamentale del giorno di interazione per l’accoppiamento di un maschio D. melanogaster con una femmina D. Simulans (N = 11). Ogni riga mostra il profilo comportamentale di un maschio durante le 24 ore di interazione sociale.(B) Umano assistito punteggio comportamentale comportamentale del sonno mosca singolo maschio dello stesso set di dati mostrato in A.
Se non è un ricordo dell’esperienza passata ad essere responsabile della soppressione del rimbalzo del sonno, potrebbe essere dovuto ad una traccia fisica lasciata nell’ambiente? Un feromone sessuale volatile o non volatile potrebbe essere lasciato nel tubo dopo l’interazione MF, contribuendo così a prolungare un segnale di eccitazione sessuale? Abbiamo calcolato che un modo per affrontare questa ipotesi sarebbe quello di forzare un’interazione sessuale interspecie: un gran numero di stimoli olfattivi e gustativi contribuisce al complesso rituale di corteggiamento tra maschi e femmine(Dweck et al., 2015) e un modo conveniente per governare molti in una volta sola è quello di forzare l’interazione tra i maschi di D. melanogaster e un parente evolutivo stretto, come D. simulans(Manning, 1959; Sturtevant, 1919). Abbiamo quindi collocato i maschi di D. melan ogaster wild-type con le femmine di D. simulans nel giorno dell’interazione e videoregistrato, poi segnato, il loro comportamento. In conformità con la letteratura classica(Schilcher e Dow, 1977), l’interazione inter-specie MF ha portato ad una copulazione limitata (solo 2 mosche su 11 che sono stati visivamente monitorati, Figura 2-figure supplemento 2A), ma con un certo grado di corteggiamento soprattutto durante il giorno (10.8 ± 2,3% su 24 ore, ma solo 2,3 ± 1,4% durante ZT 12-24; media ±SD), seguita dalla privazione del sonno durante la notte (Figura 2-figure supplement2B). Tuttavia, dopo l’interazione inter-specie MF inter-specie, mosche maschio finalmente ha mostrato un rimbalzo del sonno che è stato anche maggiore del rimbalzo osservato dopo le interazioni MM(Figura 2C e Figura 2-figure supplement 1C). È interessante notare che, anche se non abbiamo mai osservato comportamenti di combattimento tra i maschi di D. melanogaster e le femmine di D. simulans, il profilo di attività, il corteggiamento limitato e il rimbalzo ricordavano più l’interazione MM che l’interazione MF.

Figura 2-figure supplemento 2.La rilevazione di feromoni femminili non volatili è sufficiente per sopprimere il rimbalzo del sonno dopo la privazione del sonno.tre giorni di sonno etogrammi di sonno degli esperimenti descritti nella Figura 2.Inter-specifica interazione maschio-femmina.Tutti i grafici mostrano la quantificazione del rimbalzo del sonno durante lo ZT0-3 nel giorno del rimbalzo. Il numero totale di animali è mostrato sotto le trame dei box. Rimbalzo del sonno nella memoria dell’onciadifettosa1(A) e in rutabaga1(B) mutanti dopo Mock, MM o MF. La leggenda a sinistra di(A) si applica all’intera figura.(C) CantonS maschio vola dopo 24 ore di interazione con altri maschi, D. melanogaster femmine, D. simulans femmine o in finto controllo.(D) Sonno di rimbalzo in orcoanosmico1 mutanti dopo l’interazione Mock, MM, o MF.(E) CantonS maschio vola dopo l’interazione finta o l’interazione con i maschi dagli occhi bianchi seguita, al rimbalzo, dal controllo del veicolo o dai feromoni femminili.I grafici includono un giorno di linea di base, un giorno di interazione e un giorno di recupero. In tutti i pannelli, l’area grigia indica la finestra corrispondente dei dati mostrati in Figura 2. Effetti dell’interazione MM e MF nei mutanti di memoria dei geni somaro(A) e rutabaga(B).(C) Effetti dell’interazione tra i maschi di CantonS e le femmine di tipo selvaggio (pesca), i maschi di tipo selvaggio (ciano) o le femmine di tipo selvaggio D. simulans (malva).(D) Stesso paradigma sperimentale, in orcoanosmico1 maschi mutanti.(E) CantonS maschio vola dopo una finta interazione o un’interazione con maschi dagli occhi bianchi seguita, al rimbalzo, dal controllo del veicolo (blu scuro) o da feromoni femminili (blu chiaro).(A) Rappresentante classificazione comportamentale del giorno di interazione per l’accoppiamento di un maschio D. melanogaster con una femmina D. Simulans (N = 11). Ogni riga mostra il profilo comportamentale di un maschio durante le 24 ore di interazione sociale.(B) Umano assistito punteggio comportamentale comportamentale del sonno mosca singolo maschio dello stesso set di dati mostrato in A.
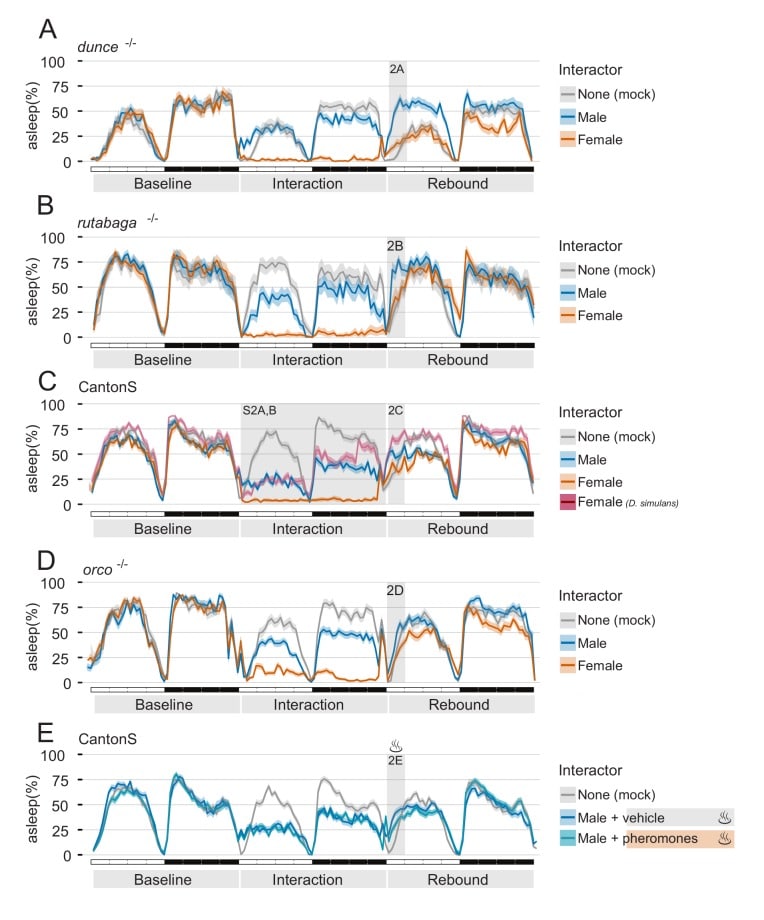
Figura 2-figure supplemento 1.Etogrammi di tre giorni di sonno degli esperimenti descritti nella Figura 2.I grafici includono un giorno di linea di base, un giorno di interazione e un giorno di recupero. In tutti i pannelli, l’area grigia indica la finestra corrispondente dei dati mostrati in Figura 2. Effetti dell’interazione MM e MF nei mutanti di memoria dei geni dell’oncia(A) e rutabaga(B).(C) Effetti dell’interazione tra i maschi di CantonS e le femmine di tipo selvaggio (pesca), i maschi di tipo selvaggio (ciano) o le femmine di tipo selvaggio D. simulans (malva).(D) Stesso paradigma sperimentale, in orcoanosmico1 maschi mutanti.(E) CantonS maschio vola dopo una finta interazione o un’interazione con maschi dagli occhi bianchi seguita, al rimbalzo, dal controllo del veicolo (blu scuro) o da feromoni femminili (blu chiaro).

Figura 2-figure supplement 2.Interazione interspecifica maschio-femmina.(A) Rappresentante classificazione comportamentale del giorno di interazione per l’accoppiamento di un maschio D. melanogaster maschio con una femmina D. Simulans (N = 11). Ogni riga mostra il profilo comportamentale di un maschio durante 24 ore di interazione sociale.(B) Umano assistito punteggio comportamentale comportamentale del sonno mosca singolo maschio dello stesso set di dati mostrato in A.
Ruolo dei feromoni non volatili
Il rimbalzo del sonno osservato dopo l’interazione inter-specie suggerisce che un segnale chimico eventualmente eccitante lasciato dalla femmina può essere responsabile per la soppressione del rimbalzo dopo D. melanogaster specifica interazione MF . In Drosophila, alcuni feromoni hanno un certo grado di volatilità(Farine et al., 2012) e, per verificare se un segnale olfattivo è stato coinvolto con questo processo, abbiamo misurato il rimbalzo dopo l’interazione sociale nei mutanti anosmici orco(Larsson et al., 2004), ma non abbiamo trovato alcuna differenza tra mosche wild-type e mosche orco mutanti: anche i maschi anosmici mancava il rimbalzo dopo la privazione del sonno indotta da MF(Figura 2D e Figura 2-figure supplement 1D). Se c’è un segnale eccitante che le mosche anosmiche possono ancora percepire, potrebbe essere un feromone non volatile? Le femmine di D. melanogaster e D. simulans hanno diversi idrocarburi cuticolari che agiscono come feromoni sessuali, con il primo recante prevalentemente 7,11-Heptacosadiene (7,11-ND) e il secondo 7-Tricosene (7-HD)(Jallon, 1984; Marcillac et al., 2005). Se i segnali olfattivi non sono coinvolti, abbiamo ragionato che un feromone della cuticola specifico di D. melanogaster potrebbe essere responsabile del fenotipo sconcertante. Abbiamo, quindi, sottoposto le mosche di tipo selvatico maschio all’interazione MM e poi, all’alba del giorno del rimbalzo, abbiamo rimosso l’intruso e inserito nel tubo di registrazione un frammento di carta su cui avevamo precedentemente diluito un mix di feromoni sessuali specie-specifici 7,11-ND e 7,11-HD o il solvente da solo come controllo(Figura 2E e Figura 2-figure supplement 1E). Alla fine, abbiamo trovato che la semplice presenza di feromoni cuticolari femminili D. melanogaster potrebbe effettivamente inibire il rimbalzo del sonno dopo l’interazione MM, suggerendo che i feromoni lasciati dalla femmina erano sufficienti a contrastare la pressione del sonno accumulata al giorno del rimbalzo.
Le mosche maschili percepiscono i feromoni non volatili femminili attraverso i neuroni situati sulla punta distale delle loro zampe anteriori(Lu et al., 2012; Starostina et al., 2012; Thistle et al., 2012; Toda et al., 2012; Vijayan et al., 2014). All’inizio del rituale di corteggiamento sessuale, le mosche maschili picchiettano la femmina per assaporare e riconoscere presumibilmente i segnali specifici del sesso(Spieth, 1974) che sono importanti per il proseguimento del corteggiamento. In particolare, 7,11-ND e 7,11-HD sono percepiti dai neuroni che esprimono i membri della famiglia dei canali degenerativi/epiteliali del sodio (DEG/ENaC) – Ppk25, Ppk23 e Ppk29 – e i mutanti di mosche maschili in uno di questi recettori mostrano un livello di corteggiamento ridotto (Liu et al.,2012; Starostina et al., 2012; Toda et al., 2012; Vijayan et al., 2014). I dati comportamentali ed elettrofisiologici hanno mostrato che il rilevamento dei feromoni sessuali è quasi completamente perso nei maschi mutanti ppk23(Lu et al., 2012; Thistle et al., 2012; Toda et al., 2012) e quindi abbiamo ragionato che i mutanti ppk23 potrebbero servire come un buon modello per testare, ancora una volta, l’ipotesi che la soppressione del rimbalzo del sonno sia dovuta alla segnalazione dei feromoni. Abbiamo poi sottoposto i mutanti maschi ppk23 mutanti maschi a quattro condizioni sperimentali: L’interazione MF, l’interazione MM, e l’interazione MM con o senza l’aggiunta di feromoni esogeni(Figura 3).
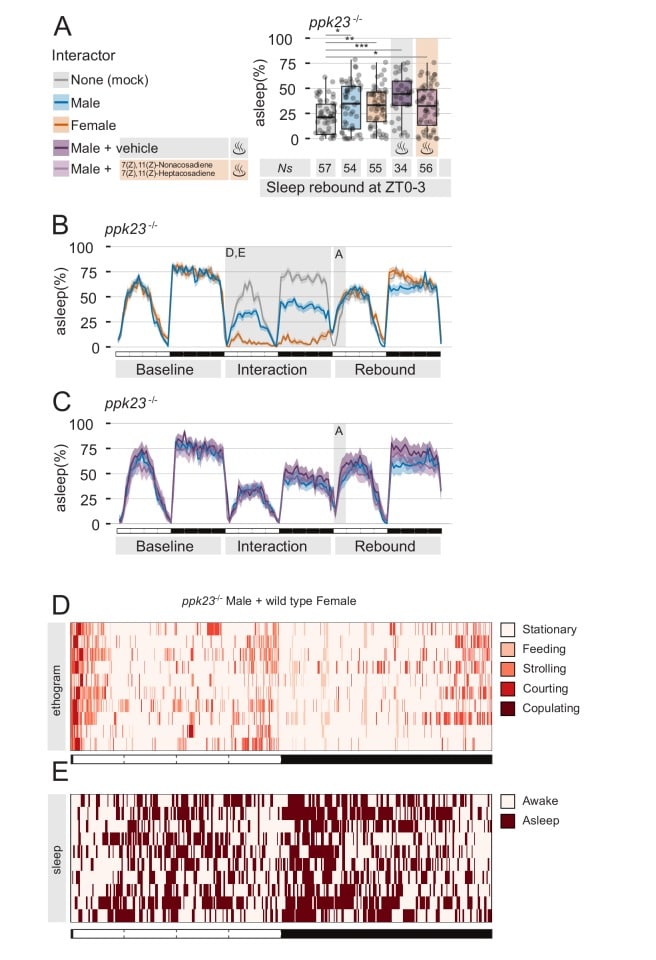
Figura 3.Il recettore dei feromoni Ppk23 è necessario per la soppressione del sonno dopo la privazione del sonno.(A) Rimbalzo durante ZT0-3 in ppk23Δ mutanti dopo l’interazione Mock, MM, MF, MM seguita da veicolo di controllo, o MM seguita da feromoni femmina. La leggenda a sinistra si applica a A, B, C.(B,C) Etogrammi di tre giorni di sonno delle condizioni sperimentali mostrate in(A). I dati sono divisi in due pannelli per motivi di visualizzazione. La stessa riga MM (blu) è riprodotta in entrambi.(D) Rappresentativo classificazione comportamentale ottenuto con punteggio umano in interazione MF tra ppk23Δ maschi mutanti e femmine di tipo selvaggio. Confrontare con le MF di tipo selvaggio nella figura 1D.(E) Valutazione umana del sonno della mosca singola per un sottoinsieme (N = 10) delle mosche mostrate in C.
Come previsto, le mosche hanno subito il livello previsto di privazione del sonno(Figura 3B-E), ma la condizione MF non ha mostrato un rimbalzo del sonno anormale (Figura 3A), indicando che la segnalazione ppk23 durante l’interazione gioca un ruolo nella soppressione del rimbalzo del sonno.

Figura 3.Il recettore dei feromoni Ppk23 è necessario per la soppressione del sonno dopo la privazione del sonno.(A) Rimbalzo durante ZT0-3 in ppk23Δ mutanti dopo l’interazione Mock, MM, MF, MM seguita da veicolo di controllo, o MM seguita da feromoni femmina. La leggenda a sinistra si applica a A, B, C.(B,C) Etogrammi di tre giorni di sonno delle condizioni sperimentali mostrate in(A). I dati sono divisi in due pannelli per motivi di visualizzazione. La stessa riga MM (blu) è riprodotta in entrambi.(D) Rappresentativo classificazione comportamentale ottenuto con punteggio umano in interazione MF tra ppk23Δ maschi mutanti e femmine di tipo selvaggio. Confrontare con le MF di tipo selvaggio nella figura 1D.(E) Valutazione umana del sonno della mosca singola per un sottoinsieme (N = 10) delle mosche mostrate in C.
La stimolazione dei feromoni è sufficiente per sopprimere il rimbalzo del sonno dopo la privazione del sonno
I dati raccolti fino a questo punto mostrano che le mosche maschili, esposte al feromone femminile, ridimensionano il loro naturale bisogno di rimbalzo del sonno dopo la privazione del sonno. Tuttavia, il lettore attento si sarà reso conto che tutti gli esperimenti effettuati finora si basano su un paradigma sociale per la deprivazione del sonno, introducendo così una condizione confondente: la mera presenza di feromoni è davvero sufficiente a sopprimere la deprivazione del sonno, o è in qualche modo collegata alla natura sociale del nostro paradigma comportamentale? Dopotutto, sappiamo che l’interazione sociale nelle mosche può avere effetti profondi sul loro sonno(Ganguly-Fitzgerald et al., 2006). Per testare la sufficienza dell’effetto dei feromoni sul rimbalzo del sonno, abbiamo ideato due serie di esperimenti, in cui abbiamo sostituito la deprivazione del sonno di tipo sociale con la deprivazione meccanica del sonno, utilizzando il modulo di deprivazione del sonno dei nostri etoscopi(Figure 4 e 5). Gli etoscopi possono interagire con singole mosche in modo dipendente dal contesto, innescando eventi in base ad un’analisi del comportamento in tempo reale(Geissmann et al., 2017). Abbiamo programmato gli etoscopi per far ruotare un tubo ogni volta che l’animale al suo interno è stato rilevato completamente inattivo per 60 s. Chiamiamo questo paradigma: deprivazione dinamica del sonno(Geissmann et al., 2017). Nella prima serie di esperimenti(Figura 4), le mosche CantonS sono state sottoposte a SD dinamica per 24 ore, poi trasferite nel loro stesso tubo (manipolazione finta – Figura 4A,B), in un tubo pulito e fresco (Figura4C,D), o trasferiti in un tubo in cui una femmina vergine è stata precedentemente ospitata per cinque giorni (Figura 4E,F). Rimbalzo del sonno dopo la SD è stato osservato nei primi due casi, ma non nell’ultimo, suggerendo che i feromoni lasciati dalla femmina precedentemente ospitata sono effettivamente sufficienti a sopprimere il rimbalzo. Per testare in ultima analisi la sufficienza dei feromoni sessuali, abbiamo condotto una seconda serie di esperimenti in cui le mosche sono stati progettati per esprimere il canale termoattivato TrpA1 nelle cellule di rilevamento dei feromoni che esprimono il driver ppk23-GAL4(Figura 5). Queste mosche sono state anche sottoposte a SD dinamico per 24 ore e poi la temperatura è stata aumentata dalla condizione di inattivazione (22°C) alla condizione di attivazione (29°C) per stimolare sinesteticamente la sensazione di feromone. Di tutte le condizioni sperimentali(Figura 5 e Figura 5-figure supplement 1), la mancanza di rimbalzo dopo SD è stato osservato solo quando le cellule di rilevamento dei feromoni sono stati stimolati termogeneticamente (Figura 5E,F).
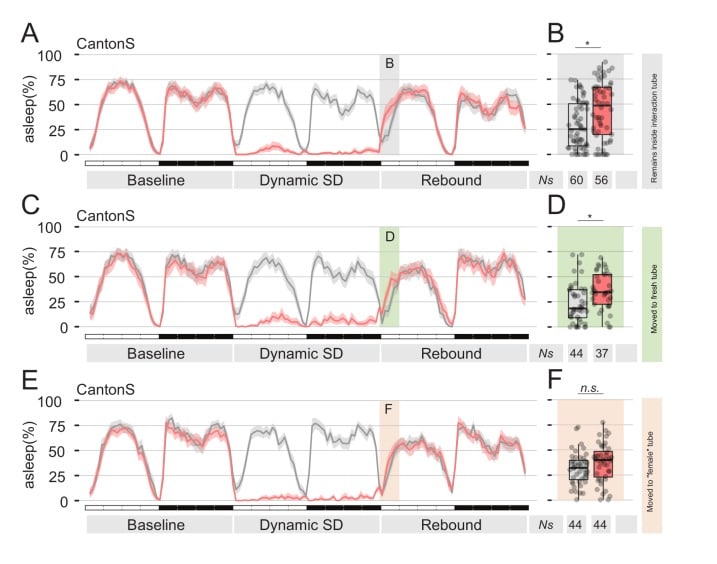
Figura 4.La presenza di feromoni femminili è sufficiente per sopprimere il rimbalzo del sonno dopo la privazione del sonno.(A,C,E) Profilo del sonno delle mosche dei Cantoni S che, subito dopo la privazione del sonno, sono state trasferite nella stessa provetta (A), in una provetta pulita e fresca(C), o in una provetta vuota dove una mosca femmina vergine è stata precedentemente alloggiata per 24 ore (E, ‘provetta femmina’). In tutti i pannelli, le linee grigie mostrano le condizioni finte che hanno subito lo stesso trattamento ma non sono state private del sonno.(B, D e F) Quantificazione del rimbalzo ZT0-3 per A, C ed E rispettivamente.
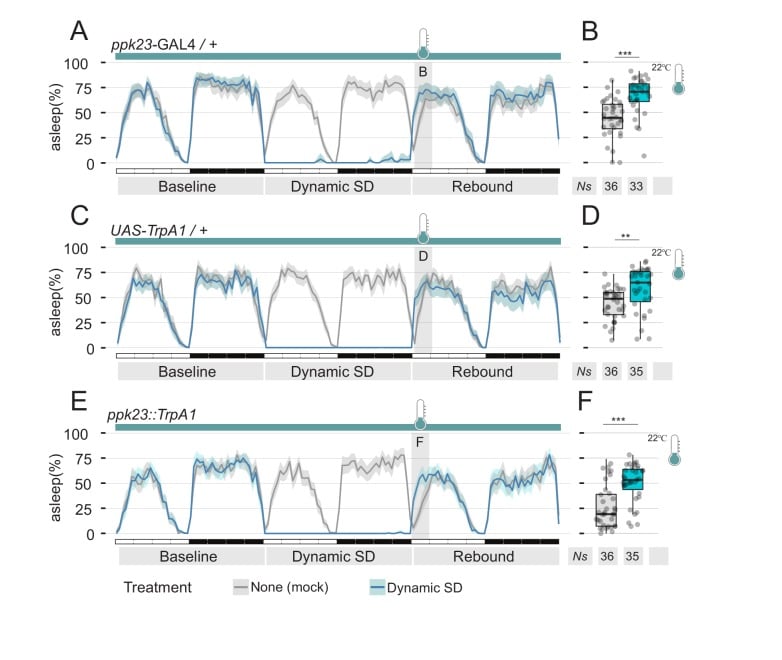
Figura 5-figure supplemento 1.La manipolazione delle cellule di rilevamento dei feromoni è sufficiente per sopprimere il sonno.condizioni di controllo della temperatura per gli esperimenti mostrati in Figura 5.(A-D) Genotipi di controllo parentale (E,F)vola esprimendo il canale termoattivato TrpA1 sotto il controllo di ppk23 GAL4. Tracce rosse indicano il modello di sonno delle mosche sottoposte a deprivazione meccanica del sonno alla temperatura non attiva (22°C); durante il tempo di rimbalzo ZT0-3, la temperatura è stata aumentata a 29°C. Le linee grigie indicano il profilo di sonno delle mosche di controllo finto che hanno subito lo stesso trattamento di temperatura ma non sono state private del sonno.(B, D, F) Quantificazione del rimbalzo del sonno durante ZT0-3 del giorno di rimbalzo per le mosche mostrate in A, C, ed E, rispettivamente.(A, C, E) Stessi genotipi e trattamento mostrati in Figura 5. La temperatura è mantenuta costante a 22°C per tutta la durata dell’esperimento.(B, D, F) Quantificazione del rimbalzo del sonno durante ZT0-3 del giorno di rimbalzo per le mosche mostrate in A, C, E, rispettivamente.

Figura 4.Figura 4. La presenza di feromoni femminili è sufficiente per sopprimere il rimbalzo del sonno dopo la privazione del sonno.(A,C,E) Profilo del sonno delle mosche dei Cantoni S che, immediatamente dopo la privazione del sonno, sono stati trasferiti nella stessa provetta (A), in una provetta pulita e fresca(C), o in una provetta vuota dove una mosca femmina vergine era precedentemente alloggiata per 24 ore (E, ‘provetta femmina’). In tutti i pannelli, le linee grigie mostrano le condizioni finte che hanno subito lo stesso trattamento ma non sono state private del sonno.(B, D e F) Quantificazione del rimbalzo ZT0-3 per A, C ed E rispettivamente.

Figura 5-figure supplemento 1.La manipolazione delle cellule di rilevamento dei feromoni è sufficiente per sopprimere il sonno.condizioni di controllo della temperatura per gli esperimenti mostrati in Figura 5.(A-D) Genotipi di controllo parentale (E,F)vola esprimendo il canale termoattivato TrpA1 sotto il controllo di ppk23 GAL4. Tracce rosse indicano il modello di sonno delle mosche sottoposte a deprivazione meccanica del sonno alla temperatura non attiva (22°C); durante il tempo di rimbalzo ZT0-3, la temperatura è stata aumentata a 29°C. Le linee grigie indicano il profilo di sonno delle mosche di controllo finto che hanno subito lo stesso trattamento di temperatura ma non sono state private del sonno.(B, D, F) Quantificazione del rimbalzo del sonno durante ZT0-3 del giorno di rimbalzo per le mosche mostrate in A, C, ed E, rispettivamente.(A, C, E) Stessi genotipi e trattamento mostrati in Figura 5. La temperatura è mantenuta costante a 22°C per tutta la durata dell’esperimento.(B, D, F) Quantificazione del rimbalzo del sonno durante ZT0-3 del giorno di rimbalzo per le mosche mostrate in A, C, E, rispettivamente.

Figura 5-figure supplemento 1.Condizioni di controllo della temperatura per gli esperimenti mostrati in Figura 5.(A, C, E) Stessi genotipi e trattamento mostrati in Figura 5. La temperatura è mantenuta costante a 22°C per tutta la durata dell’esperimento.(B, D, F) Quantificazione del rimbalzo del sonno durante ZT0-3 del giorno di rimbalzo per le mosche mostrate in A, C, E rispettivamente.
Ruolo generale dei feromoni e dell’eccitazione sessuale nel controllo del sonno
I risultati raccolti finora indicano che la segnalazione dei feromoni ha la capacità di sopprimere il rimbalzo del sonno dopo la privazione del sonno. Tuttavia, il feromone è l’unico segnale in grado di farlo? Dopo tutto, la soppressione del sonno osservata nell’esperimento archetipico(Figura 1A) sembra essere ancora più forte della soppressione osservata dopo l’esposizione delle mosche al solo feromone. Per rispondere a questa domanda, abbiamo eseguito due serie di esperimenti. In una prima serie, abbiamo sottoposto le mosche al solito paradigma di interazione sociale ma, alla fine della giornata di interazione, abbiamo rimosso gli intrusi e trasferito le mosche focali non nel loro tubo come fatto in precedenza, ma in un tubo pulito e fresco(Figura 6A,B). Infatti, abbiamo scoperto che anche quando trasferite in un tubo pulito – e quindi in assenza di feromoni femminili residui nel loro ambiente – le mosche maschio hanno mostrato un rimbalzo soppresso (Figura 6A,B – confronta con la Figura 1A ,B). In una seconda serie di esperimenti, abbiamo usato la forma termosensibile dell’inibitore neuronale shibire(shiTS) per silenziare selettivamente i neuroni ppk23 all’alba del giorno del rimbalzo, dopo l’interazione sociale(Figura 6C-H). Come previsto, il silenziamento delle cellule di segnalazione dei feromoni dopo l’interazione MF non ha salvato il fenotipo del rimbalzo del sonno. Questi risultati suggeriscono fortemente che la soppressione del rimbalzo del sonno può essere dovuta ad uno stato generale di eccitazione sessuale, che potrebbe essere suscitato sia dalla recente esperienza sessuale che dalla presenza di feromoni sessuali: la combinazione di entrambi i fattori può quindi agire in sinergia per manifestare l’effetto più forte mostrato nella Figura 1A,B.
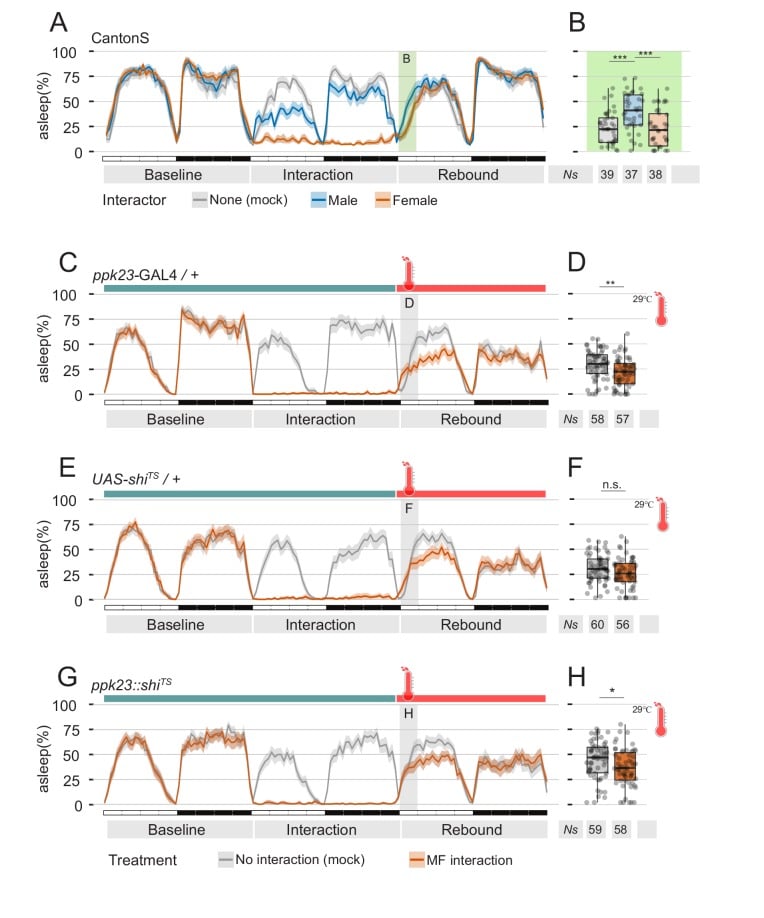
Figura 6.La percezione dei feromoni femminili dopo l’interazione sociale non è necessaria per sopprimere il sonno.(A) Profilo di sonno di tre giorni di sonno delle mosche CantonS, che mostra il giorno di riferimento, il giorno di interazione e il giorno di rimbalzo. Alla fine del giorno di interazione, le mosche erano finte trasferite in un tubo pulito e fresco.(B) Quantificazione del rimbalzo a ZT0-3 per l’esperimento mostrato in A.(C-H) L’inattivazione delle cellule ppk23 durante il rimbalzo non salva il fenotipo del sonno. Genotipi di controllo parentale(C-E) vola portando o l’inserimento ppk23 GAL4 (C,D)o il UAS-shiST inserimento(E,F). Voli sperimentali che trasportano entrambi(G,H). Le tracce rosse indicano il modello di sonno delle mosche soggette all’interazione MF a temperature non attive (22°C); il giorno del rimbalzo la temperatura è stata portata a 29°C. Linee grigie indicano il profilo di sonno delle mosche di controllo finto che hanno subito lo stesso trattamento di temperatura, ma non hanno sperimentato l’interazione sociale.(D, F, H) Quantificazione del rimbalzo del sonno durante ZT0-3 del giorno di rimbalzo per le mosche mostrate in C, E. e G, rispettivamente.
L’eccitazione sessuale nei maschi di D. melanogaster è nota per essere in gran parte sotto controllo del gruppo P1 sessualmente dimorfico di neuroni che esprimono neuroni infruttuosi(Yamamoto e Koganezawa, 2013). I neuroni P1 sono attivati dal contatto con le femmine(Kohatsu e Yamamoto, 2015) e, al contrario, l’attivazione sperimentale dei neuroni P1 è sufficiente per innescare o migliorare il comportamento di corteggiamento(Kohatsu et al., 2011), generando eventualmente uno stato interno di eccitazione sessuale. Pertanto, per testare la forma definitiva della nostra ipotesi, abbiamo espresso il canale termoattivato TrpA1 nei neuroni P1 e abbiamo aumentato la temperatura alla condizione di attivazione (29°C) per 24 ore (Figura 7). L’attivazione prolungata e prolungata dei neuroni P1 ha portato ad un fenotipo di attività prolungata e alla soppressione quasi totale del sonno(Figura 7D), in gran parte simile a quella osservata quando si accoppia una mosca maschio con un partner femminile. Soprattutto, la privazione del sonno indotta dall’attivazione dei neuroni P1 non ha portato ad un rimbalzo del sonno ma, al contrario, ad una notevole riduzione del sonno nel giorno del rimbalzo(Figura 7D,E).
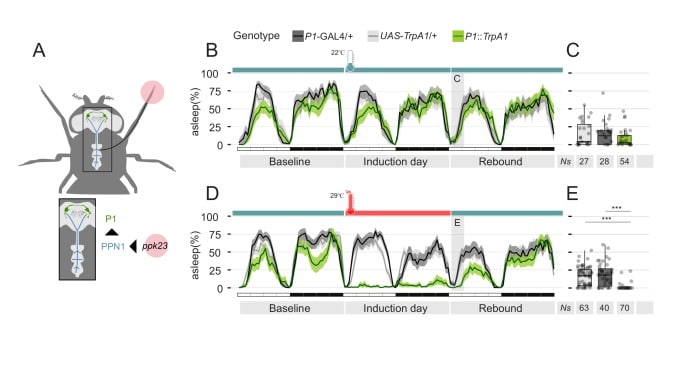
Figura 7.L’eccitazione sessuale residua dopo l’attivazione della P1 porta alla soppressione del rimbalzo del sonno.(A) Diagramma del percorso dei feromoni. Il segnale dai neuroni sensoriali periferici ppk23 viene trasferito ai neuroni PPN1 prima e centrale P1 alla fine.(B, D) Profilo del sonno delle linee di controllo parentale (grigio chiaro e grigio scuro) o linea sperimentale che esprime il canale termoattivato TrpA1 sotto il controllo del driver P1-split-GAL4 (verde). Le mosche sperimentali(D) hanno registrato un aumento della temperatura da 22°C a 29°C per 24 ore. Il giorno seguente la temperatura è stata nuovamente impostata a 22°C. Le mosche di controllo non hanno subito alcun cambiamento di temperatura.(C, E) Quantificazione del rimbalzo a ZT0-3 per B e D rispettivamente.

Figura 6.Figura 6. Percezione dei feromoni femminili dopo l’interazione sociale non è necessario per sopprimere il sonno.(A) Profilo del sonno di tre giorni di sonno delle mosche CantonS, che mostra il giorno di riferimento, il giorno di interazione e il giorno di rimbalzo. Alla fine del giorno di interazione, le mosche erano finte trasferite in un tubo pulito e fresco.(B) Quantificazione del rimbalzo a ZT0-3 per l’esperimento mostrato in A.(C-H) L’inattivazione delle cellule ppk23 durante il rimbalzo non salva il fenotipo del sonno. Genotipi di controllo parentale(C-E) vola portando o l’inserimento ppk23 GAL4 (C,D)o il UAS-shiTS inserimento(E,F). Voli sperimentali che trasportano entrambi(G,H). Le tracce rosse indicano il modello di sonno delle mosche soggette all’interazione MF a temperature non attive (22°C); il giorno del rimbalzo la temperatura è stata portata a 29°C. Linee grigie indicano il profilo di sonno delle mosche di controllo finto che hanno subito lo stesso trattamento di temperatura, ma non hanno sperimentato l’interazione sociale.(D, F, H) Quantificazione del rimbalzo del sonno durante ZT0-3 del giorno di rimbalzo per le mosche mostrate in C, E. e G, rispettivamente.

Figura 7.L’eccitazione sessuale residua dopo l’attivazione della P1 porta alla soppressione del rimbalzo del sonno.(A) Diagramma del percorso dei feromoni. Il segnale dai neuroni sensoriali periferici ppk23 viene trasferito ai neuroni PPN1 prima e centrale P1 in ultima analisi.(B, D) Profilo del sonno delle linee di controllo parentale (grigio chiaro e grigio scuro) o linea sperimentale che esprime il canale termoattivato TrpA1 sotto il controllo del driver P1-split-GAL4 (verde). Le mosche sperimentali(D) hanno registrato un aumento della temperatura da 22°C a 29°C per 24 ore. Il giorno seguente la temperatura è stata nuovamente impostata a 22°C. Le mosche di controllo non hanno subito alcun cambiamento di temperatura.(C, E) Quantificazione del rimbalzo a ZT0-3 per B e D rispettivamente.
Manipolazione dell’estensione e della natura dell’eccitazione sessuale
Per confermare ulteriormente che la soppressione del rimbalzo del sonno è effettivamente controllata dall’eccitazione sessuale, abbiamo eseguito due manipolazioni genetiche finali, entrambe che coinvolgono il percorso di sintesi di octopamina e tiramina(Figura 8A). Il sistema octopaminergico è un regolatore chiave del comportamento della Drosofila, coinvolto tra gli altri, con la modulazione dell’attività sessuale(Huang et al., 2016; Zhou et al., 2012), l’aggressività maschio-maschio(Zhou et al., 2008) e il sonno(Crocker e Sehgal, 2008; Crocker et al., 2010; Yang et al., 2015). Nella prima serie di esperimenti, abbiamo sottoposto le mosche mutanti per l’enzima TβH al paradigma dell’interazione sociale. Nelle mosche mutanti TβH, la sintesi dell’octopamina è compromessa e questo è stato collegato a un deficit nella capacità di formare il condizionamento del corteggiamento (Zhouet al., 2012), un paradigma in cui le mosche maschili imparano a sopprimere i loro istinti sessuali, dopo essere state ripetutamente rifiutate (Griffithe Ejima, 2009). In un’ipotesi colta, abbiamo ragionato che le mosche mutanti TβH prive di condizionamento di corteggiamento possono, quindi, mostrare un aumento anormale dell’eccitazione sessuale dopo una prolungata interazione sociale e, possibilmente, mostrare un aumento dell’effetto di soppressione del rimbalzo. Questo è stato effettivamente il caso(Figura 8B,C). Le mosche mutanti TβH hanno mostrato un chiaro rimbalzo dopo l’interazione MM e una forte soppressione del rimbalzo dopo l’interazione MF.
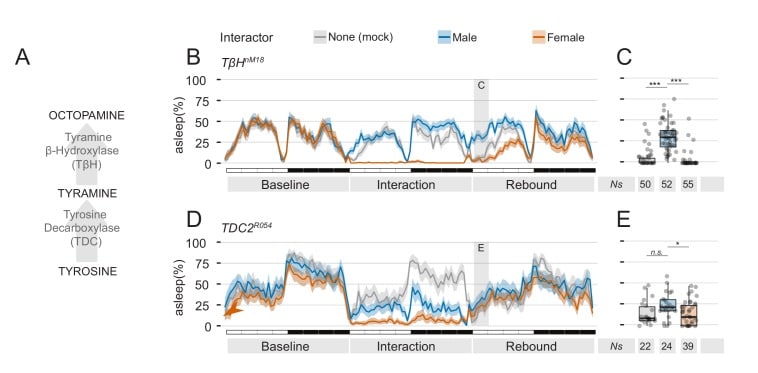
Figura 8.Figura 8. Mutanti nella tiramina, via octopamina può essere impiegato per manipolare la quantità e la qualità dell’eccitazione sessuale.(A) Diagramma del percorso noto per la generazione di octopamina dalla tirosina.(B) Tre giorni di trama etogramma per il profilo del sonno dei maschimutanti TβHnM18 sottoposti a interazione sociale. In queste mosche, l’effetto dell’interazione MF sul rimbalzo del sonno è esacerbato.(C) Stesso esperimento, utilizzando TDC2R054 mosche maschio mutante TDC2R054. In queste mosche, l’interazione MM porta anche alla soppressione del rimbalzo del sonno.(C,E) Quantificazione di ZT0-3 per gli esperimenti mostrati in B e D rispettivamente.
Infine, per indagare se la semplice eccitazione sessuale è responsabile di questo effetto, abbiamo usato mosche mutanti nel gene TDC2, che possiedono livelli più bassi di tiramina e octopamina(Crocker e Sehgal, 2008) e sono stati precedentemente dimostrati a corte maschio così come mosche femmina(Huang et al., 2016). Abbiamo ipotizzato che se queste mosche sono sessualmente eccitate sia dal partner maschile che da quello femminile, dovrebbero poi rispondere con una soppressione del rimbalzo del sonno ad entrambe le condizioni di interazione sociale. Questo è ciò che abbiamo osservato(Figura 8D,E). Nelle mosche con un orientamento bi-sessuale, sia l’interazione MF che quella MM portano ad una forte soppressione del rimbalzo del sonno.

Figura 8.I mutanti nella via tiramina, octopamina possono essere impiegati per manipolare la quantità e la qualità dell’eccitazione sessuale.(A) Schema del percorso noto per la generazione di octopamina dalla tirosina.(B) Tre giorni di trama etogramma per il profilo del sonno dei maschimutanti TβHnM18 sottoposti a interazione sociale. In queste mosche, l’effetto dell’interazione MF sul rimbalzo del sonno è esacerbato.(C) Stesso esperimento, utilizzando TDC2R054 mosche maschio mutante TDC2R054. In queste mosche, l’interazione MM porta anche alla soppressione del rimbalzo del sonno.(C,E) Quantificazione di ZT0-3 per gli esperimenti mostrati in B e D rispettivamente.
Discussione
La scoperta principale di questo lavoro è che l’eccitazione sessuale ha la capacità di modulare la pressione del sonno. Utilizziamo diversi paradigmi comportamentali per promuovere uno stato di eccitazione sessuale nelle mosche maschili e dimostriamo che, in tutti i casi, questo si traduce in una soppressione del rimbalzo del sonno dopo la privazione del sonno. Perché questo è importante?
Negli ultimi 15 anni, la Drosophila è emersa come uno dei modelli animali più promettenti per studiare le basi biologiche del sonno. Molti geni che influenzano il sonno in Drosophila sono stati identificati finora, e sono stati descritti molti circuiti neuronali che possono alterare il sonno quando vengono manipolati(Potdar e Sheeba, 2013; Tomita et al., 2017). Dato che il quadro per la regolazione del sonno è stabilmente incentrato sul modello a due processi, i neuroni recentemente identificati che modulano il sonno sono normalmente classificati o come coinvolti con la regolazione circadiana – e quindi appartenenti al processo C – o come coinvolti con la regolazione omeostatica – e quindi appartenenti al processo S. Qui, abbiamo identificato uno stato interno che ha la capacità di modulare il sonno e la pressione del sonno, ma probabilmente non appartiene a nessuno dei due processi.
Storicamente, la regolazione accessoria del sonno è stata attribuita ai neuromodulatori e, ancora una volta, Drosophila si è dimostrata strumentale nel comprendere come i neuromodulatori influenzano il sonno(Griffith, 2013). Tuttavia, è probabile che il controllo ambientale del sonno si estenda oltre i neuromodulatori e che comprenda anche specifici circuiti sensoriali e centrali. Utilizzando l’optogenetica e la termogenetica, è ora possibile attivare e silenziare singoli neuroni o interi circuiti alla ricerca di correlati funzionali del comportamento. Una corretta caratterizzazione dei possibili esiti è un passo necessario: come distinguere se il compito principale di un neurone è quello di regolare direttamente la pressione del sonno o, ad esempio, di creare uno stato di ansia, fame o eccitazione sessuale, che modula indirettamente la pressione del sonno? Parafrasando un famoso saggio di Thomas Nagel, non possiamo sapere cosa significhi essere una mosca(Nagel, 1974): l’esposizione ai feromoni sessuali crea uno stato interiore di eccitazione sessuale che poi contrasta il sonno, o interferisce direttamente con la regolazione del sonno senza ulteriori implicazioni sessuali? La manipolazione dei neuroni ppk23, sia termogeneticamente che con l’uso di sostanze chimiche, non suscita alcun chiaro segno di corteggiamento (dati non mostrati) e questo è in accordo con la letteratura precedente, dove è stato anche dimostrato che l’attivazione dei neuroni ppk23 da sola non è sufficiente a indurre alcun segno di comportamento sessuale in mosche isolate(Starostina et al., 2012; Toda et al., 2012) e che i feromoni giusti possono agire, invece, per potenziare altri stimoli sessuali concomitanti. Nel nostro paradigma, anche l’attivazione dei neuroni P1 non mostra alcun chiaro segno di corteggiamento, come il canto attraverso l’estensione delle ali (dati non mostrati).
Per il campo del sonno, questo lavoro offre un nuovo paradigma sperimentale che potrebbe essere utilizzato per analizzare, in modo ecologicamente significativo, come le pulsioni interne o gli stimoli ambientali influenzano la regolazione del sonno e l’omeostasi del sonno. L’interazione tra sesso e sonno in Drosophila, e più specificamente la gerarchia di queste due pulsioni biologiche concorrenti, è stata inizialmente descritta nel quadro dell’interazione circadiana(Fujii et al., 2007) e molto recentemente le basi neuronali sono state indagate da due gruppi indipendenti(Chen et al., 2017; Machado et al., 2017). In particolare, Machado et al. (2017) e Chen et al. (201 7) trovano anche un ruolo per i neuroni P1 nel deviare l’interesse di un animale dal sonno al sesso. Il nostro lavoro, tuttavia, non si concentra sulla scelta binaria tra sonno e corteggiamento, ma scopre piuttosto un nuovo ruolo per l’eccitazione sessuale sulla modulazione dell’omeostasi del sonno, anche in assenza di un partner femminile. Il concetto che l’omeostasi del sonno non è inviolabile e può essere effettivamente modulata non è nuovo: gli uccelli migratori e i cetacei sono stati segnalati come capaci di sopprimere il sonno in alcuni periodi importanti della loro vita, cioè durante la migrazione o subito dopo il parto(Fuchs et al., 2009; Lyamin et al., 2005; Rattenborg et al., 2004); le mosche, analogamente, hanno dimostrato di non avere un rimbalzo del sonno dopo la privazione del sonno indotta dalla fame(Thimgan et al., 2010) o dopo l’induzione della privazione del sonno attraverso specifici cluster neuronali(Seidner et al., 2015). Forse ancora più calzante con i nostri risultati è l’osservazione che i pettorali maschili, un tipo di uccello artico, possono rinunciare al sonno a favore del corteggiamento durante le tre settimane di fertilità femminile(Lesku et al., 2012). Sembra, quindi, che gli animali siano in grado di bilanciare le esigenze di sonno con altre, varie, spinte biologiche. Sarebbe interessante vedere se queste pulsioni agiscono per sopprimere il sonno attraverso un circuito di regolazione comune. Il sonno di rimbalzo è sempre stato considerato una delle caratteristiche più importanti del sonno stesso. Assieme alla notizia della morte per deprivazione di sonno, viene spesso utilizzata a sostegno dell’ipotesi che il sonno non sia un fenomeno accessorio, ma un bisogno fondamentale dell’organismo(Cirelli e Tononi, 2008). La comprensione della regolazione del sonno di rimbalzo, quindi, può essere fondamentale per comprendere la funzione stessa del sonno. È interessante notare che nel nostro paradigma il sonno di rimbalzo non è rimandato, ma piuttosto eliminato. Inoltre, nel giorno del rimbalzo, l’architettura del sonno delle mosche maschili sessualmente eccitate non sembra essere influenzata: il numero di attacchi di sonno sembra essere simile alle loro controparti di controllo, mentre la durata degli attacchi di sonno è, semmai, leggermente ridotta(Figura 1-figure supplement 1).
L’ultima osservazione che emerge dalla nostra scoperta riguarda l’uso della Drosophila melanogaster come modello per funzioni cerebrali complesse, come le emozioni. La neurobiologia della Drosophila sta vivendo un periodo di rinascita, guidato da un’esplosione cambriana di genomica, etomica e connettivologia. Il campo potrebbe presto essere in grado di utilizzare i moscerini della frutta per modelli comportamentali che un tempo erano considerati un’esclusiva dei mammiferi – o anche degli esseri umani. Esempi passati di questi comportamenti sono l’aggressività o il sonno stesso. Studiare le emozioni o gli stati interni degli animali non è un compito facile, data la loro natura soggettiva. Tuttavia, lo studio degli effetti delle emozioni sul sonno può aprire una finestra di opportunità, fornendo un risultato facilmente quantificabile.
Materiali e metodi
Stock di mosche
Le mosche sono state allevate con un regime di 12 ore di luce:12 ore di buio (LD) a 25 su media standard di mais e lievito. Nello studio sono state utilizzate le seguenti linee: CantonS di Ralf Stanewsky (UCL, UK); D. simulans di Virginie Orgogozo (IJM, Francia); ppk23-GAL4 e ppk23Δ mutanti(Toda et al., 2012) di Barry Dickson (HHMI, USA); CaLexA(Masuyama et al., 2012) di Marc Dionne (ICL, UK); UAS-shiTS da James Jepson (UCL); R30G03-GAL4 (#49646)(Liu et al., 2016), somaro1 (#6020), rutabaga1 (#9404), e orco1 (#23129) mutanti, UAS-TrpA1 (#26263) del Bloomington Drosophila Stock Centre (Indiana, USA). Il driver P1-split-GAL4 è stato creato e fornito da Eric Hoopfer(Hoopfer et al., 2015). TβHnM18e TDC2R054sono di Stephen Goodwin (CNCB, Oxford).
Attività neuronale nei neuroni R2 del corpo ellissoidale, misure di CaLexA
Gli animali sono stati cresciuti e trattati nelle stesse condizioni degli esperimenti comportamentali. Dopo una giornata di interazione sociale o di privazione meccanica del sonno, gli animali sono stati anestetizzati e il loro cervello è stato sezionato e fissato come descritto in precedenza(Beckwith et al., 2013). Per le misurazioni CaLexA, i cervelli di mosca sono stati immunizzati con anti-GFP (1:400, ab290 Abcam). Le immagini sono state scattate con ingrandimento 40X e analizzate nelle Fiji/ImageJ(Schindelin et al., 2012). Per misurare l’intensità del segnale, è stata generata una proiezione di massima intensità di tutta la pila che comprende l’anello R2. Una regione di interesse a forma di ciambella è stata sovrapposta per misurare il valore medio del grigio per ogni anello R2. L’intensità su una regione adiacente non etichettata è stata misurata e sottratta. Per consentire il confronto con i dati pubblicati in precedenza(Liu et al., 2016), la deprivazione meccanica del sonno è stata condotta ponendo le mosche sulla sommità di uno shaker da laboratorio controllato da un timer Arduino attivato a impulsi da 5 a 30 s a intervalli pseudo-casuali di 1 a 7 min (codice Arduino e istruzioni su https://github.com/gilestrolab/fly-sleepdeprivator).
Esperimenti di interazione sociale
Le registrazioni del sonno sono state effettuate utilizzando etoscopi(Geissmann et al., 2017) in condizioni di 12:12 LD, 50-70% di umidità, in incubatrici impostate a 25. In tutti gli esperimenti, i valori ambientali di temperatura, umidità e luce sono stati registrati e monitorati ogni 5 min. Per le interazioni sociali, le mosche da zero a un giorno sono state rimosse da una fiala condivisa e collocate in tubi di vetro di 70 mm x 5 mm contenenti cibo standard. Venti tubi sono stati collocati in ogni arena dell’etoscopio. Le mosche sono state acclimatate in tubi di vetro comportamentali per 5 giorni, di cui gli ultimi 2 giorni sono stati registrati come linea di base. Il giorno dell’interazione, gli intrusi (femmine CantonS o maschi bianchi1118) sono stati aggiunti a ZT0. Gli intrusi sono stati poi rimossi da ZT23 a ZT24, finendo 10 minuti prima della transizione dal buio alla luce. Il periodo di rimbalzo è stato poi registrato per due giorni consecutivi. Tutte le cifre mostrano l’ultimo giorno di riferimento e il primo giorno di rimbalzo.
Punteggio umano dell’interazione sociale
La manipolazione delle mosche e la registrazione delle interazioni è stata effettuata come in tutti gli altri esperimenti con la sola differenza che gli esperimenti sono stati videoregistrati utilizzando la funzione di registrazione degli etoscopi. I video sono stati registrati con una risoluzione di 1920 × 1080 pixel e un frame rate di 25 FPS. Il grado di interazione è stato poi valutato utilizzando un’interfaccia grafica basata sul web, disponibile su richiesta. L’etichettatura comportamentale è stata effettuata con una frequenza di circa una volta ogni 60 s, mentre il punteggio di posizione con una frequenza di una volta ogni 240 s.
Consegna dei feromoni
Per gli esperimenti sui feromoni, un piccolo frammento di carta da filtro di 3 MM contenente la miscela di feromoni (70 ng in 10 µl di 7(Z),11(Z)-Nonacosadiene e 70 ng in 10 µl di 7(Z),11(Z)-Ettacosadiene; Cayman Chemicals, Ann Arbor, Michigan 48108 USA) o il veicolo (esano) è stato aggiunto alla provetta subito dopo la rimozione dell’intruso maschio.
Privazione dinamica del sonno
La privazione del sonno è stata condotta utilizzando il modulo dei servomotori della piattaforma etoscopica(Geissmann et al., 2017). Tutti gli attacchi di immobilità della durata di almeno 60 s sono stati automaticamente interrotti dalla macchina che ruotava i singoli tubi sperimentali, risvegliando così le mosche solo quando erano quiescenti. Per ogni stimolazione, i motori ruotano tre volte: -85° 200 ms, +170° 300 ms, -85° 200 ms.
Termogenetica
Per gli esperimenti che impiegano TrpA1 e shiTSGli animali sono stati allevati in incubatrici a 22°C. Le registrazioni di base e la privazione del sonno sono state eseguite anche in incubatrici impostate alla stessa temperatura, ma la temperatura effettiva registrata oscillava tra 22°C e 24°C a causa del calore prodotto dagli etoscopi stessi. La termo-manipolazione è stata condotta a 29°C. In tutti gli esperimenti, le condizioni ambientali di luce, temperatura e umidità sono state registrate con una frequenza di una volta ogni 5 min. Per gli esperimenti shiTS mostrati in Figura 6C-H, la temperatura è stata aumentata a 29°C a ZT23:30.
Analisi statistica e riproducibilità dei dati
Tutte le analisi dei dati sono state eseguite in R(Core Team, 2014) o in Python(Team, 2015). I dati comportamentali sono stati analizzati con il pacchetto Rethomics(https://github.com/gilestrolab/rethomics) e l’analisi statistica è consistita in un test a coppie di Wilcoxon rank sum test (cioè il test Mann-Whitney U) con aggiustamento del valore P per confronti multipli (Benjaminie Hochberg, 1995). Per gli etogrammi, è stato eseguito un ricampionamento bootstrap con 5000 repliche, al fine di generare un intervallo di confidenza del 95%(Carpenter e Bithell, 2000) (nastri ombreggiati intorno alla media nelle figure). Tutti gli esperimenti sono stati replicati da due a cinque volte. In tutte le figure, le N rappresentano il numero totale di mosche su tutti gli esperimenti. Le statistiche sono state fatte su dati aggregati. Gli outlier non sono mai stati esclusi. Le mosche morte nel corso dell’esperimento sono state escluse da tutte le analisi. Tutte le cifre sono state generate in R, utilizzando ggplot2(Wickam, 2009). Per tutte le boxplot, la parte inferiore e superiore della scatola (cerniere) mostrano rispettivamente il primo e il terzo quartile. La linea orizzontale all’interno della scatola è il secondo quartile (mediana). La regola di Tuckey (il default), è stata usata per disegnare i ‘baffi’ (linee verticali): i baffi si estendono fino agli ultimi valori estremi entro ±1.5 IQR, dalle cerniere, dove IQR è Q3-Q1. Un riassunto dettagliato di tutti i confronti statistici è fornito come file supplementare 1.
1. Video supplementari
Video supplementari S1, S2, S3, S4 (disponibili su https://lab.gilest.ro/projects/raw-data/regulation-of-sleep-homeostasis-by-sex-pheromones-supplementary-videos/ data la natura interattiva di questa figura). (S1) Interazione tra mosche maschio e femmina di tipo selvaggio D. melanogaster (MF). (S2) Interazione tra il maschio di tipo selvaggio D. melan ogaster e i maschi dagli occhi bianchi (MM). (S3) Interazione tra ppk23Δ Il mutante D. melanogaster maschio e la selvaggia D. melanogaster femmina vola. (S4) Interazione tra maschi wild-type e D. simulans femmina. S1 e S2 mostrano lo stesso set di dati della Figura 1D. S3 ha lo stesso set di dati della Figura 3D. S4 mostra lo stesso set di dati come in Figura 2-figure supplement 2. In tutti i video, posizionare il cursore del mouse sull’etogramma per evidenziare la regione di interesse corrispondente nel video. 3. Cliccare sull’etogramma o sulla barra giorno/notte per cercare la relativa posizione del video. Legenda per la classificazione comportamentale come nella figura 1C. I video sono compressi per facilitare l’accesso. Set di dati completo e non compresso accessibile su Zenodo via doi: 10.5281/zenodo.167551 o https://zenodo.org/record/167551#.Wbo5OkqGMsk(Gilestroet al., 2016). Quando si clicca sugli etogrammi, consentire un errore sull’asse temporale di ±10 min sul relativo video.
References
- Adolescent Sleep Working Group, Committee on Adolescence, Owens J. Insufficient sleep in adolescents and young adults: an update on causes and consequences. Pediatrics. 2014; 134:e921-e932. DOI | PubMed
- Beckwith EJ, Gorostiza EA, Berni J, Rezával C, Pérez-Santángelo A, Nadra AD, Ceriani MF. Circadian period integrates network information through activation of the BMP signaling pathway. PLoS Biology. 2013; 11DOI | PubMed
- Benjamini Y, Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. Journal of the Royal Statistical Society. Series B. 1995; 57:289-300. DOI
- Borbély AA, Achermann P. Sleep homeostasis and models of sleep regulation. Journal of Biological Rhythms. 1999; 14:559-570. DOI
- Borbély AA. A two process model of sleep regulation. Human Neurobiology. 1982; 1:195-204. PubMed
- Campbell SS, Tobler I. Animal sleep: a review of sleep duration across phylogeny. Neuroscience & Biobehavioral Reviews. 1984; 8:269-300. DOI | PubMed
- Carpenter J, Bithell J. Bootstrap confidence intervals: when, which, what? A practical guide for medical statisticians. Statistics in Medicine. 2000; 19:1141-1164. PubMed
- Chen D, Sitaraman D, Chen N, Jin X, Han C, Chen J, Sun M, Baker BS, Nitabach MN, Pan Y. Genetic and neuronal mechanisms governing the sex-specific interaction between sleep and sexual behaviors in Drosophila. Nature Communications. 2017; 8DOI | PubMed
- Cirelli C, Tononi G. Is sleep essential?. PLoS Biology. 2008; 6DOI | PubMed
- Core Team R. R Foundation for Statistical Computing: Vienna, Austria; 2014.
- Crocker A, Sehgal A. Octopamine regulates sleep in drosophila through protein kinase A-dependent mechanisms. Journal of Neuroscience. 2008; 28:9377-9385. DOI | PubMed
- Crocker A, Shahidullah M, Levitan IB, Sehgal A. Identification of a neural circuit that underlies the effects of octopamine on sleep:wake behavior. Neuron. 2010; 65:670-681. DOI | PubMed
- Danguir J, Nicolaidis S. Dependence of sleep on nutrients’ availability. Physiology & Behavior. 1979; 22:735-740. DOI | PubMed
- Davis RL, Dauwalder B. The Drosophila dunce locus: learning and memory genes in the fly. Trends in Genetics. 1991; 7:224-229. DOI | PubMed
- Donelson NC, Donelson N, Kim EZ, Slawson JB, Vecsey CG, Huber R, Griffith LC. High-resolution positional tracking for long-term analysis of Drosophila sleep and locomotion using the "tracker" program. PLoS One. 2012; 7DOI | PubMed
- Dweck HK, Ebrahim SA, Thoma M, Mohamed AA, Keesey IW, Trona F, Lavista-Llanos S, Svatoš A, Sachse S, Knaden M, Hansson BS. Pheromones mediating copulation and attraction in Drosophila. PNAS. 2015; 112:E2829-E2835. DOI | PubMed
- Farine JP, Ferveur JF, Everaerts C. Volatile Drosophila cuticular pheromones are affected by social but not sexual experience. PLoS One. 2012; 7DOI | PubMed
- Faville R, Kottler B, Goodhill GJ, Shaw PJ, van Swinderen B, Swinderen Bvan. How deeply does your mutant sleep? Probing arousal to better understand sleep defects in Drosophila. Scientific Reports. 2015; 5DOI | PubMed
- Fuchs T, Maury D, Moore FR, Bingman VP. Daytime micro-naps in a nocturnal migrant: an EEG analysis. Biology Letters. 2009; 5:77-80. DOI | PubMed
- Fujii S, Krishnan P, Hardin P, Amrein H. Nocturnal male sex drive in Drosophila. Current Biology. 2007; 17:244-251. DOI | PubMed
- Ganguly-Fitzgerald I, Donlea J, Shaw PJ. Waking experience affects sleep need in Drosophila. Science. 2006; 313:1775-1781. DOI | PubMed
- Geissmann Q, Rodriguez LG, Beckwith EJ, French AS, Jamasb AR, Gilestro GF. Ethoscopes: An Open Platform For High-Throughput Ethomics. PLoS Biology. 2017; 15DOI | PubMed
- Gilestro GF, Beckwith EJ, Geissmann Q. Zenodo. 2016. DOI
- Gilestro GF, Tononi G, Cirelli C. Widespread changes in synaptic markers as a function of sleep and wakefulness in Drosophila. Science. 2009; 324:109-112. DOI | PubMed
- Gilestro GF. Video tracking and analysis of sleep in Drosophila melanogaster. Nature Protocols. 2012; 7:995-1007. DOI | PubMed
- Griffith LC, Ejima A. Courtship learning in Drosophila melanogaster: diverse plasticity of a reproductive behavior. Learning & Memory. 2009; 16:743-750. DOI | PubMed
- Griffith LC. Neuromodulatory control of sleep in Drosophila melanogaster: integration of competing and complementary behaviors. Current Opinion in Neurobiology. 2013; 23:819-823. DOI | PubMed
- Hoopfer ED, Jung Y, Inagaki HK, Rubin GM, Anderson DJ. P1 interneurons promote a persistent internal state that enhances inter-male aggression in Drosophila. eLife. 2015; 4DOI | PubMed
- Huang J, Liu W, Qi YX, Luo J, Montell C. Neuromodulation of Courtship Drive through Tyramine-Responsive Neurons in the Drosophila Brain. Current Biology. 2016; 26:2246-2256. DOI | PubMed
- Huber R, Hill SL, Holladay C, Biesiadecki M, Tononi G, Cirelli C. Sleep homeostasis in Drosophila melanogaster. Sleep. 2004; 27:628-639. DOI | PubMed
- Jallon JM. A few chemical words exchanged by Drosophila during courtship and mating. Behavior Genetics. 1984; 14:441-478. DOI | PubMed
- Joiner MA, Griffith LC. Mapping of the anatomical circuit of CaM kinase-dependent courtship conditioning in Drosophila. Learning & memory. 1999; 6:177-192. PubMed
- Keene AC, Duboué ER, McDonald DM, Dus M, Suh GS, Waddell S, Blau J. Clock and cycle limit starvation-induced sleep loss in Drosophila. Current Biology. 2010; 20:1209-1215. DOI | PubMed
- Kohatsu S, Koganezawa M, Yamamoto D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 2011; 69:498-508. DOI | PubMed
- Kohatsu S, Yamamoto D. Visually induced initiation of Drosophila innate courtship-like following pursuit is mediated by central excitatory state. Nature Communications. 2015; 6DOI | PubMed
- Lamaze A, Öztürk-Çolak A, Fischer R, Peschel N, Koh K, Jepson JE. Regulation of sleep plasticity by a thermo-sensitive circuit in Drosophila. Scientific Reports. 2017; 7DOI | PubMed
- Larsson MC, Domingos AI, Jones WD, Chiappe ME, Amrein H, Vosshall LB. Or83b encodes a broadly expressed odorant receptor essential for Drosophila olfaction. Neuron. 2004; 43:703-714. DOI | PubMed
- Lesku JA, Rattenborg NC, Valcu M, Vyssotski AL, Kuhn S, Kuemmeth F, Heidrich W, Kempenaers B. Adaptive sleep loss in polygynous pectoral sandpipers. Science. 2012; 337:1654-1658. DOI | PubMed
- Levin LR, Han PL, Hwang PM, Feinstein PG, Davis RL, Reed RR. The Drosophila learning and memory gene rutabaga encodes a Ca2+/Calmodulin-responsive adenylyl cyclase. Cell. 1992; 68:479-489. DOI | PubMed
- Liu S, Liu Q, Tabuchi M, Wu MN. Sleep drive Is encoded by neural plastic changes in a dedicated circuit. Cell. 2016; 165:1347-1360. DOI | PubMed
- Liu T, Starostina E, Vijayan V, Pikielny CW. Two Drosophila DEG/ENaC channel subunits have distinct functions in gustatory neurons that activate male courtship. Journal of Neuroscience. 2012; 32:11879-11889. DOI | PubMed
- Lu B, LaMora A, Sun Y, Welsh MJ, Ben-Shahar Y. ppk23-Dependent chemosensory functions contribute to courtship behavior in Drosophila melanogaster. PLoS Genetics. 2012; 8DOI | PubMed
- Lyamin O, Pryaslova J, Lance V, Siegel J. Animal behaviour: continuous activity in cetaceans after birth. Nature. 2005; 435DOI | PubMed
- MacFadyen UM, Oswald I, Lewis SA. Starvation and human slow-wave sleep. Journal of applied physiology. 1973; 35:391-394. PubMed
- Machado DR, Afonso DJ, Kenny AR, Öztu Rk-Çolak A, Moscato EH, Mainwaring B, Kayser M, Koh K. Identification of octopaminergic neurons that modulate sleep suppression by male sex drive. eLife. 2017; 6DOI | PubMed
- Manning A. The sexual isolation between Drosophila melanogaster and Drosophila simulans. Animal Behaviour. 1959; 7:60-65. DOI
- Marcillac F, Houot B, Ferveur JF. Revisited roles of Drosophila female pheromones. Chemical Senses. 2005; 30 Suppl 1:i273-i274. DOI | PubMed
- Masuyama K, Zhang Y, Rao Y, Wang JW. Mapping neural circuits with activity-dependent nuclear import of a transcription factor. Journal of Neurogenetics. 2012; 26:89-102. DOI | PubMed
- Nagel T. What Is It Like to Be a Bat?. The Philosophical Review. 1974; 83:435-450. DOI
- Ohayon MM. Epidemiology of insomnia: what we know and what we still need to learn. Sleep Medicine Reviews. 2002; 6:97-111. DOI | PubMed
- Parisky KM, Agosto Rivera JL, Donelson NC, Kotecha S, Griffith LC. Reorganization of Sleep by Temperature in Drosophila Requires Light, the Homeostat, and the Circadian Clock. Current Biology. 2016; 26:882-892. DOI | PubMed
- Potdar S, Sheeba V. Lessons from sleeping flies: insights from Drosophila melanogaster on the neuronal circuitry and importance of sleep. Journal of Neurogenetics. 2013; 27:23-42. DOI | PubMed
- Rattenborg NC, Mandt BH, Obermeyer WH, Winsauer PJ, Huber R, Wikelski M, Benca RM. Migratory sleeplessness in the white-crowned sparrow (Zonotrichia leucophrys gambelii). PLoS Biology. 2004; 2DOI | PubMed
- Schilcher F, Dow M. Courtship Behaviour in Drosophila: Sexual Isolation or Sexual Selection?. Zeitschrift für Tierpsychologie. 1977; 43:304-310. DOI
- Schindelin J, Arganda-Carreras I, Frise E, Kaynig V, Longair M, Pietzsch T, Preibisch S, Rueden C, Saalfeld S, Schmid B, Tinevez JY, White DJ, Hartenstein V, Eliceiri K, Tomancak P, Cardona A. Fiji: an open-source platform for biological-image analysis. Nature Methods. 2012; 9:676-682. DOI | PubMed
- Seidner G, Robinson JE, Wu M, Worden K, Masek P, Roberts SW, Keene AC, Joiner WJ. Identification of Neurons with a Privileged Role in Sleep Homeostasis in Drosophila melanogaster. Current Biology. 2015; 25:2928-2938. DOI | PubMed
- Spieth HT. Courtship behavior in Drosophila. Annual Review of Entomology. 1974; 19:385-405. DOI | PubMed
- Starostina E, Liu T, Vijayan V, Zheng Z, Siwicki KK, Pikielny CW. A Drosophila DEG/ENaC subunit functions specifically in gustatory neurons required for male courtship behavior. Journal of Neuroscience. 2012; 32:4665-4674. DOI | PubMed
- Sturtevant AH. A New Species Closely Resembling Drosophila Melanogaster. Psyche: A Journal of Entomology. 1919; 26:153-155. DOI
- Team PC. (Python Software Foundation). 2015.
- Thimgan MS, Suzuki Y, Seugnet L, Gottschalk L, Shaw PJ. The perilipin homologue, lipid storage droplet 2, regulates sleep homeostasis and prevents learning impairments following sleep loss. PLoS Biology. 2010; 8DOI | PubMed
- Thistle R, Cameron P, Ghorayshi A, Dennison L, Scott K. Contact chemoreceptors mediate male-male repulsion and male-female attraction during Drosophila courtship. Cell. 2012; 149:1140-1151. DOI | PubMed
- Toda H, Zhao X, Dickson BJ. The Drosophila female aphrodisiac pheromone activates ppk23(+) sensory neurons to elicit male courtship behavior. Cell Reports. 2012; 1:599-607. DOI | PubMed
- Tomita J, Ban G, Kume K. Genes and neural circuits for sleep of the fruit fly. Neuroscience Research. 2017; 118:82-91. DOI | PubMed
- Vijayan V, Thistle R, Liu T, Starostina E, Pikielny CW. Drosophila pheromone-sensing neurons expressing the ppk25 ion channel subunit stimulate male courtship and female receptivity. PLoS Genetics. 2014; 10DOI | PubMed
- Wickam H. ggplot2 – Elegant Graphics for Data Analysis. Springer; 2009.
- Willie JT, Chemelli RM, Sinton CM, Yanagisawa M. To eat or to sleep? Orexin in the regulation of feeding and wakefulness. Annual Review of Neuroscience. 2001; 24:429-458. DOI | PubMed
- Yamamoto D, Koganezawa M. Genes and circuits of courtship behaviour in Drosophila males. Nature Reviews Neuroscience. 2013; 14:681-692. DOI | PubMed
- Yang Z, Yu Y, Zhang V, Tian Y, Qi W, Wang L. Octopamine mediates starvation-induced hyperactivity in adult Drosophila. PNAS. 2015; 112:5219-5224. DOI | PubMed
- Zhou C, Huang H, Kim SM, Lin H, Meng X, Han KA, Chiang AS, Wang JW, Jiao R, Rao Y. Molecular genetic analysis of sexual rejection: roles of octopamine and its receptor OAMB in Drosophila courtship conditioning. Journal of Neuroscience. 2012; 32:14281-14287. DOI | PubMed
- Zhou C, Rao Y, Rao Y. A subset of octopaminergic neurons are important for Drosophila aggression. Nature Neuroscience. 2008; 11:1059-1067. DOI | PubMed
- Zimmerman JE, Raizen DM, Maycock MH, Maislin G, Pack AI. A video method to study Drosophila sleep. Sleep. 2008; 31:1587-1598. DOI | PubMed
Fonte
Beckwith EJ, Geissmann Q, French AS, Gilestro GF, Griffith LC, et al. () Regulation of sleep homeostasis by sexual arousal. eLife 6e27445. https://doi.org/10.7554/eLife.27445





