Introduzione
Uno dei primi paesi ad introdurre il vaccino pentavalente (difterite combinata, tetano, pertosse, Hib ed epatite B) è stato lo Sri Lanka1. Il 1° gennaio 2008 è stato introdotto nello Sri Lanka un vaccino pentavalente, il Quinvaxem (Crucell). Il 29 aprile dello stesso anno il vaccino è stato ritirato dal governo a seguito di cinque decessi. Un team di esperti dell’Organizzazione Mondiale della Sanità (OMS) ha indagato sugli eventi avversi successivi all’immunizzazione (AEFI) e ha riferito che i decessi erano “improbabili” per essere collegati alla vaccinazione. Il rapporto completo non era ampiamente disponibile prima di essere presentato all’Alta Corte di Delhi, India2. Dal rapporto completo è emerso chiaramente che non c’era una spiegazione alternativa per tre morti. Pertanto, avrebbero dovuto essere classificati come “probabili/ probabili” in relazione all’immunizzazione, utilizzando i criteri di Brighton dell’OMS per la classificazione dell’AEFI (vedi Box 1). Gli esperti hanno eliminato le categorie “probabile” e “possibile” dalla classificazione AEFI che hanno utilizzato per la valutazione e hanno poi riferito che i decessi erano “improbabili” legati alla vaccinazione. Il modo in cui la classificazione di Brighton è stata modificata per consentire questa classificazione fuorviante dei decessi in Sri Lanka è stata riportata nell’Indian Journal of Medical Research e nel British Medical Journal.3,4.
Il 4 maggio 2013 il Ministero della Salute del Vietnam ha sospeso l’uso di Quinvaxem (Crucell) dopo che aveva causato 12 morti5. Gli esperti dell’OMS hanno indagato sulle morti in Vietnam. Questa volta hanno riferito: “Quinvaxem è stato pre-qualificato dall’OMS …, nessun evento avverso mortale dopo l’immunizzazione (AEFI) è mai stato associato a questo vaccino”.5. Questa è la stessa marca di vaccino pentavalente che è stata usata nello Sri Lanka dove gli esperti dell’OMS avevano precedentemente documentato i decessi dell’AEFI. Sembra che dopo l’indagine in Sri Lanka e poco prima dell’indagine in Vietnam, la metodologia utilizzata per la classificazione AEFI sia stata rivista. Utilizzando la valutazione riveduta della causalità dell’AEFI, l’AEFI ha riferito dallo Sri Lanka potrebbe essere classificato come “Non è un caso di [AEFI]”. Sia lo Sri Lanka che il Vietnam sono stati convinti a reintrodurre il vaccino pentavalente dopo il rapporto dell’OMS. Il nuovo meccanismo che permette di classificare l’AEFI come “Non è un caso di [AEFI]” sarà discusso.
| Termine di causalità | Criteri di valutazione |
| Molto probabile/Certezza | Un evento clinico con un rapporto temporale plausibile con la somministrazione di vaccini e che non può essere spiegato da una malattia concomitante o da altri farmaci o sostanze chimiche. |
| Probabile | Un evento clinico con un rapporto temporale ragionevole con la somministrazione del vaccino; è improbabile che sia attribuito a una malattia concomitante o ad altri farmaci o sostanze chimiche. |
| Possibile | Un evento clinico con un rapporto temporale ragionevole con la somministrazione di vaccini, ma che potrebbe anche essere spiegato da una concomitante malattia o da altri farmaci o sostanze chimiche. |
| Improbabile | Un evento clinico il cui rapporto temporale con la somministrazione del vaccino rende improbabile una connessione causale, ma che potrebbe essere plausibilmente spiegato da una malattia sottostante o da altri farmaci o sostanze chimiche. |
| Non correlato | Un evento clinico con un rapporto temporale incompatibile e che potrebbe essere spiegato da una malattia sottostante o da altri farmaci o sostanze chimiche |
| Non classificabile | Un evento clinico con informazioni insufficienti per consentire la valutazione e l’identificazione della causa |
Sezione A
Cenni storici sulla valutazione della causalità: da Hume a Brighton
L’evoluzione della logica della valutazione della causalità è affascinante. Eminenti filosofi, scienziati, luminari del diritto e statistici hanno affrontato il problema e su di esso si è scritto molto. Sarà impossibile distillare tutto questo per questo scritto, se non a rischio di una semplificazione eccessiva. Dato che ci preoccupiamo soprattutto di assegnare la causalità alle presunte reazioni ai farmaci, solo alcuni aspetti del dibattito sono fondamentali per questa discussione.
Definire causa ed effetto (X è la causa di Y) non è stato facile. Secondo Hume6Le caratteristiche principali della causalità sono la precedenza temporale (X deve precedere Y), la contiguità e la regolarità dell’associazione delle cause e dei loro effetti. La confusione, tuttavia, è possibile grazie ad un terzo fattore.
È noto che il consumo di gelato è maggiore quando c’è un picco nell’incidenza delle scottature solari. Si può concludere erroneamente che il consumo di gelato può causare scottature solari. Il terzo fattore in questo caso è costituito dalle condizioni climatiche calde. Sia il consumo di gelato che le scottature solari sono associate alle giornate di sole. Hume ha evitato il problema della confusione stabilendo che X può essere considerato come causa di Y solo se X è sufficiente per Y. Questo è, tuttavia, fallace. Colpire un fiammifero può accendere un fuoco solo se c’è ossigeno. Di per sé, colpire il fiammifero non è sufficiente. La posizione alternativa potrebbe essere che X sia causa di Y se, e solo se, X è necessario per Y7. John Mackie ha suggerito che in natura potrebbero esserci molteplici ragioni (cause) per lo stesso risultato8. Quindi X può non essere necessario per Y, ma allo stesso tempo X può essere sufficiente per Y. Un edificio può essere incendiato da una scintilla di un corto circuito nel cablaggio elettrico (X) o come risultato di un atto di incendio doloso (Z). Quindi né (X) né (Z) sono necessari per Y, ma sia (X) che (Z) sono cause sufficienti per Y. La questione allora è se Y si sarebbe verificato se non fosse stato per il fattore X. Questo è noto come il test “ma per”. In giurisprudenza, è stato riconosciuto che laddove vi sono cause multiple che lavorano simultaneamente, il “ma per test è impraticabile e la questione della causalità è se la causa putativa abbia contribuito materialmente al risultato.9. Questo è stato sostenuto nel caso diGrahamDickie V. Flexcon Glenrothes Limited [2009] ScotSC 143 (04 settembre 2009). Peter M. Willcock e James M. Lepp hanno discusso la“Causazione nei casi di negligenza medica” che si occupa di questi temi.
In biologia, c’è un ulteriore elemento probabilistico alla causalità. Se uomini della stessa altezza e donne della stessa altezza dovessero avere figli, i loro figli non saranno tutti della stessa altezza. Per lo stesso insieme di fattori causali osservati, c’è una distribuzione probabilistica delle possibili altezze7.
Per valutare la causalità Bradford Hill10 descritto 9 principi guida che favoriscono un’associazione causale: 1) Forza – dimensione dell’effetto; 2) Coerenza – riproducibilità con osservazioni simili in luoghi diversi da parte di persone diverse; 3) Specificità – assenza di una spiegazione alternativa; 4) Temporaneamente con causa sempre procedendo l’effetto; 5) Gradiente biologico che dimostra un gradiente di risposta alla dose; 6) Plausibilità biologica – anche se questo può essere limitato dallo stato delle conoscenze attuali; 7) Coerenza tra epidemiologia e risultati di laboratorio; 8) Evidenza sperimentale; e 9) Analogia – guardando l’effetto di fattori simili. Queste considerazioni sono applicabili anche a presunte reazioni al vaccino.
Reazioni avverse ai farmaci
Reazioni avverse ai farmaci (ADR) possono seguire dopo l’uso di qualsiasi farmaco. È necessaria un’attenta valutazione per distinguere gli eventi che sono causalmente correlati al farmaco da quelli casuali. La valutazione della causalità è cruciale perché gli eventi potrebbero essere iatrogeni ed evitabili. Di solito solo pochi reagiscono negativamente ai farmaci in commercio, mentre altri sono illesi. L’attribuzione della causalità per tali eventi occasionali è particolarmente complessa. Le indagini sugli ADR mettono l’associazione causale su una scala di probabilità. Il sistema di valutazione della causalità sviluppato dal Centro di Collaborazione dell’Organizzazione Mondiale della Sanità per il monitoraggio internazionale delle droghe è chiamato Uppsala WHO Centre (WHO-UMC) Scale. Questa scala è ampiamente utilizzata in quanto offre una metodologia semplice (cfr. riquadro2). In consonanza con i postulati di Hume, il primo passo è quello di confermare la priorità temporale e la contiguità. L’evento avverso deve apparire dopo la somministrazione del farmaco sospetto ed entro un ragionevole lasso di tempo. Gli eventi in cui il tempo di assunzione della droga rende improbabile una relazione sono classificati come “improbabili” da mettere in relazione. Gli eventi in un tempo ragionevole e per i quali non esiste una spiegazione alternativa (che non può essere attribuita alla malattia o ad altri farmaci) sono classificati come “probabile/probabile” in relazione al farmaco in questione. La reazione al farmaco è classificata come “possibile” quando esiste una relazione temporale ragionevole, ma per la quale esistono anche spiegazioni alternative. In termini di aforisma di John Mackie, il farmaco è considerato sufficiente ma non necessario per l’effetto.
| Termine di causalità | Criteri di valutazione |
| Alcuni | – Anomalia dell’evento o dell’esame di laboratorio, con una relazione temporale plausibile con l’assunzione di farmaci- Non può essere spiegata da malattia o altri farmaci- Risposta all’astinenza plausibile (farmacologicamente, patologicamente)- Evento definitivo dal punto di vista farmacologico o fenomenologico (cioè un disturbo medico obiettivo e specifico o un fenomeno farmacologico riconosciuto)- Rechallenge soddisfacente, se necessario |
| Probabile/Piccola | – Anomalia dell’evento o del test di laboratorio, con un rapporto di tempo ragionevole con l’assunzione di farmaci, difficilmente attribuibile a malattie o altri farmaci- Risposta all’astinenza clinicamente ragionevole- Rechallenge non richiesto |
| Possibile | – Anomalia di un evento o di un test di laboratorio, con una relazione temporale ragionevole con l’assunzione di droga – Potrebbe anche essere spiegata da malattie o da altri farmaci – Le informazioni sull’astinenza da droghe possono essere carenti o non chiare |
| Improbabile | – L’evento o l’anomalia del test di laboratorio, con un tempo di assunzione del farmaco che rende improbabile (ma notimpossible) una relazione (ma notimpossible) – La malattia o altri farmaci forniscono spiegazioni plausibili |
|
Condizionale /
Non classificato |
– Anomalia di un evento o di un test di laboratorio – Sono necessari ulteriori dati per una corretta valutazione, oppure – Ulteriori dati in esame |
|
Non valutabile/
Non classificabile |
– Rapporto che suggerisce una reazione avversa – Non può essere giudicato perché le informazioni sono insufficienti o contraddittorie – I dati non possono essere integrati o verificati |
Per essere classificata come “molto probabile/certain” la reazione deve essere un disturbo medico oggettivo e specifico o un fenomeno farmacologico riconosciuto, e ci devono essere prove di una reazione correlata alla dose o prove in termini di ricomparsa dei sintomi in caso di recidiva. Se la morte dovesse verificarsi come ADR, la rechallenge è impossibile. Di solito è difficile essere certi della causalità dell’ADR fatale e la reazione è spesso classificata come “probabile / probabile” o “possibile”.
La differenza tra certo e probabile/probabile è semplicemente lo standard di prova accettabile. Per “certamente” si richiede una prova inconfutabile di alto livello (falsificazione della teoria con un unico esito irregolare). Una singola e ben documentata contestazione spontanea è una forte prova di regolarità (anche se in un solo paziente). Per “molto probabile”, lo standard di prova è una prova al di là di ogni ragionevole dubbio.
L'”equilibrio di probabilità” è il livello di prova necessario per classificare come “probabile” o “possibile” e questo è lo standard di prova, che è rilevante per la medicina e per la farmacovigilanza. Con questo livello di prova (prima facie true), il“Principio di precauzione” deve essere attivato. Questo è descritto più avanti.
Eventi avversi a seguito di immunizzazione
I vaccini sono farmaci usati come misura preventiva, somministrati a intere coorti di persone sane. Poiché vengono somministrati in assenza di malattie, ci si aspetta che producano pochi effetti avversi. Ma c’è una bassa tolleranza per gli eventi avversi e i decessi gravi. Gli eventi avversi successivi all’immunizzazione (AEFI) devono essere monitorati più attentamente di altri farmaci. Un sistema credibile di valutazione della sicurezza delle vaccinazioni e di monitoraggio è essenziale per il successo dei programmi di immunizzazione. L’OMS ha sviluppato l'”Adverse Events Following Immunization (AEFI)”: Valutazione della causalità” altrimenti nota come Classificazione di Brighton. È molto simile alle categorie di causalità dell’OMS-UMC per l’ADR. Fino a poco tempo fa, questa era la pietra di contatto utilizzata dagli esperti dell’OMS quando l’AEFI è stata segnalata (cfr. riquadro1).
Una misura della sensibilità e della reattività delle categorie di causalità dell’OMS-UMC (che hanno preceduto la classificazione di Brighton) è l’alacrità con cui il vaccino contro il rotavirus RotaShield è stato ritirato nel 1999 dopo 12 casi di intussuscezioni indotte dal vaccino. Circa 1 bambino su 2000 bambini di età inferiore ai 2 mesi sviluppa l’intussuscezione da altre cause. Sulla base dei risultati delle indagini, il Centro per il controllo delle malattie (CDC) ha stimato che uno o due ulteriori casi di intussuscezione sarebbero stati causati tra ogni 10.000 neonati vaccinati con il vaccino RotaShield. Dopo che circa 100.000 neonati sono stati immunizzati, il vaccino è stato ritirato11. Nel 2013 la classificazione di Brighton è stata abbandonata e sostituita dalla nuova classificazione AEFI. Il ragionamento che ha spinto ad abbandonare la classificazione di Brighton non è stato dichiarato esplicitamente nel manuale AEFI riveduto12.
Sezione B
Brighton Abbandonata: Revisione della valutazione della causalità
Il Consiglio per le Organizzazioni Internazionali delle Scienze Mediche (CIOMS) / OMS: Relazione sulla farmacovigilanza dei vaccini. Nell’ottobre 2010, dopo una serie di incontri, 40 esperti (di cui 19 rappresentanti del settore con possibili conflitti di interesse) hanno contribuito a riscrivere i criteri di classificazione per gli AEFI. Il documento intitolato “Definizioni e applicazione dei termini per la farmacovigilanza dei vaccini” è riportato per “fornire strumenti per una maggiore eccellenza nella rilevazione dei segnali e nell’investigazione di eventi avversi a seguito di immunizzazione”.13.
A pagina 170 di questo documento di 193 pagine, alla voce Note per le linee guida, è riportato a caratteri piccoli: “Se vi sono prove adeguate che un evento non corrisponde alla definizione di un caso, tale evento deve essere respinto e deve essere riportato come “Non è un caso di [AEFI]”. Tale evidenza è considerata adeguata, se un criterio di esclusione è soddisfatto, o un’indagine rivela un riscontro negativo di un criterio necessario (condizione necessaria) per la diagnosi. Tale evento dovrebbe essere respinto e classificato come “Non è un caso di [AEFI]”.13
Il CIOMS/WHO ‘strumento per l’eccellenza nella rilevazione dei segnali’ funziona chiudendo un occhio sull’AEFI, classificando l’AEFI come ‘Non è un caso di [AEFI]’. Non solo viene negata l’associazione causale di AEFI all’immunizzazione, ma viene fatto apparire che l’AEFI non si è mai verificata. Il rilevamento del segnale non è più possibile una volta che gli AEFI sono stati rimossi dal sistema dopo essere stati designati come ‘Non un caso di [AEFI]’. La storia inIntroduzione sopra dove l’OMS ha affermato nel maggio 2013 che nessun AEFI fatale è mai stato associato ad un vaccino pentavalente5, suggerisce le morti dell’AEFI dello Sri Lanka2 sono ora riclassificati come ‘Non è un caso di [AEFI]’ utilizzando lo strumento CIOMS/WHO.
Sono prese in considerazione solo le reazioni che soddisfano le definizioni dei casi di reazioni associate al vaccino in precedenza. Secondo il rapporto CIOMS / OMS (pagina 11), una definizione del caso può essere adottata dalla letteratura standard o dai revisori stessi.
La definizione del caso aiuta ad attingere a precedenti ricerche epidemiologiche e facilita ulteriori ricerche per confermare un nesso causale. Tuttavia, escludendo la causalità in relazione a un singolo evento non può dipendere da quell’evento conforme a una definizione di caso preesistente. L’uso peggiorativo del termine “rifiutato” (nella dichiarazione; “Un tale evento dovrebbe essere rifiutato e classificato come “Non è un caso di [AEFI]”), suggerisce una postura difensiva. È stato sottolineato in precedenza che i rapporti di AEFI dovrebbero essere valutati per la causalità e classificati: non devono essere “respinti”.14.
Il manuale AEFI riveduto dall’OMS
Nel marzo 2013 è stato pubblicato il “Manuale d’uso dell’OMS per l’AEFI”, riveduto dall’OMS, con un nuovo algoritmo12. Il manuale riconosce di aver adattato le definizioni e i concetti del rapporto CIOMS / OMS. Il nuovo algoritmo per AEFI è riprodotto inFigure1.
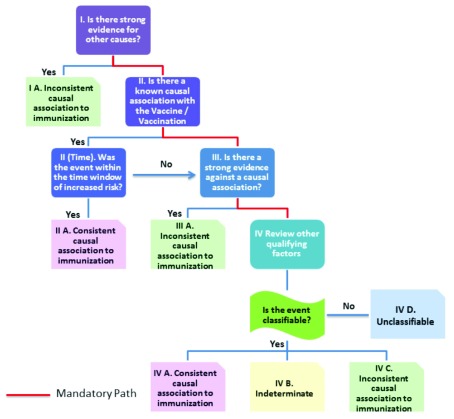
Figura 1.Diagramma di flusso che dimostra il nuovo algoritmo di classificazione AEFI rivisto.

Figura 1.Figura 1. Diagramma di flusso che mostra il nuovo algoritmo di classificazione riveduto dell’AEFI.
Classificazione AEFI riveduta: nuove categorie di causalità
Solo gli eventi che si verificano dopo la somministrazione del vaccino sono idonei per la valutazione della causalità da parte dell’AEFI. Questo primo passo ricorda il motto di Hume sulla priorità e la contiguità. Nel nuovo schema, la causalità è classificata in quattro categorie: “Associazione causale coerente all’immunizzazione”, “Indeterminata”, “Associazione causale incoerente all’immunizzazione” e “Non classificabile”.
Associazione causale coerente con l’immunizzazione
Questo è il più alto livello di associazione causale in questa nuova classificazione. È meno definitivo di “molto probabile / certo” nel vecchio schema. Non richiede una prova inconfutabile o addirittura una prova al di là di ogni ragionevole dubbio. Non è nemmeno valutato l’equilibrio di probabilità. Nel nuovo schema, un evento avverso può essere classificato contemporaneamente come “Associazione causale coerente con l’immunizzazione” e “Associazione causale incoerente con l’immunizzazione”. A pagina 36 del manuale revisionato per l’AEFI12 è l’esempio della paralisi flaccida acuta in un bambino dopo il vaccino orale contro la polio, che aveva avuto la febbre 1 mese prima dell’inizio della paralisi. La coltura delle feci ha mostrato il ceppo vaccinale del virus della polio. È stata classificata come “Associazione causale coerente con l’immunizzazione” in quanto si tratta di una reazione nota dopo la vaccinazione antipolio e la paralisi è avvenuta entro una finestra di tempo di aumento del rischio. È stato anche classificato come ‘Inconsistente associazione causale con l’immunizzazione’ perché la febbre, 1 mese prima della paralisi non era stata studiata completamente. Questa ambiguità, che ammette contemporaneamente una conclusione diametralmente opposta, è una caratteristica del nuovo schema.
Nel manuale riveduto dell’AEFI si suggerisce che prima di rispondere alla domanda “Il vaccino somministrato ad un particolare individuo ha causato il particolare evento segnalato?” (la domanda di “Lo ha fatto?”), si deve rispondere alla domanda “Il vaccino somministrato può causare un particolare evento avverso? L’inferenza è che solo se ci sono prove a livello di popolazione che il vaccino può causare l’evento avverso, la reazione è classificata come “Coerente con l’associazione causale con l’immunizzazione”.
Questa illazione è errata per due motivi. Da un lato, nega tutte le nuove associazioni viste negli studi di Fase 4. Dall’altro, se si tratta di una reazione avversa nota, l’associazione causale è accettata anche quando gli eventi potrebbero essere accaduti per coincidenza. Proprio perché le intussuscezioni sono riconosciute come evento avverso in seguito alla vaccinazione contro il rotavirus, non ne consegue che tutte le intussuscezioni nella finestra critica di maggiore suscettibilità siano necessariamente causate da esso. L’incertezza residua a questo massimo livello di associazione causale lo priva di valore nell’affrontare il problema dell’AEFI causato dai vaccini.
Associazione causale incoerente all’immunizzazione
In fondo alla nuova gerarchia di classificazione della causalità c’è la “Inconsistente associazione causale all’immunizzazione”. Questo gruppo può includere reazioni per le quali non esiste una spiegazione alternativa (e che in precedenza sarebbero state classificate nella categoria ‘Probabile’). Essi rientrerebbero nel gruppo ‘Inconsistente associazione causale con la vaccinazione’ solo perché l’associazione causale con l’immunizzazione non è stata documentata in precedenti studi epidemiologici. Nello stesso gruppo sono collocate le reazioni che sarebbero state considerate ‘Improbabile’ da associare, e quelle che sarebbero state classificate come ‘Non correlate’. L’uso della stessa categoria ‘Inconsistente associazione causale all’immunizzazione’ per una così ampia varietà di situazioni cliniche offusca semplicemente i problemi. Nello schema rivisto, questo termine è usato per suggerire che non c’è relazione tra l’AEFI e l’immunizzazione. Non importa quanto spesso si verifichi la reazione classificata come “Inconsistente con l’associazione causale”, essa non verrebbe indagata come un nuovo segnale di un’associazione causale.
Indeterminato
La classificazione nel gruppo “Indeterminato” è riservata alle reazioni che potrebbero essere state causate dall’immunizzazione, ma per le quali l’associazione causale non è stata documentata in precedenza. Si prevede che le informazioni sull’AEFI classificate come indeterminate saranno messe in comune e analizzate per capire se l’AEFI rappresenta un nuovo segnale di un evento non riconosciuto. Lo schema è comunque caricato in modo tale che letteralmente nessuna AEFI sia classificata in questo gruppo. Il modo in cui questo viene realizzato viene discusso in seguito.
Non classificabile
Gli eventi clinici con informazioni insufficienti per consentire la valutazione e l’identificazione della causa sono inseriti nel gruppo “Non classificabili”.
Revisione della classificazione AEFI: il nuovo algoritmo
Così come le categorie finali dell’associazione di causalità sono vaghe, sovrapposte e non chiaramente differenziate, l’algoritmo utilizzato per prendere una decisione sulla causalità12 non sembra essere logico o ben ponderato.
L’algoritmo è mostrato inFigure1.
Algoritmo di valutazione della causalità
Occorre rispondere a quattro serie di domande in sequenza:
- 1. 1. Ci sono prove evidenti di altre cause?
- 2. 3. Esiste un’associazione causale nota con il vaccino o la vaccinazione e, in caso affermativo, se l’evento si è verificato entro la finestra temporale di aumento del rischio?
- 3. 3. Se non è nota alcuna associazione causale o se l’evento non rientra nella finestra temporale di aumento del rischio: Esiste una forte evidenza contro un’associazione causale?
- 4. 4. Se non vi sono forti prove contro l’associazione causale, il passo successivo è quello di esaminare altri fattori qualificanti per la classificazione:a. Potrebbe accadere indipendentemente dalla vaccinazione (background rate)? b. L’evento potrebbe essere la manifestazione di un’altra condizione di salute? Un evento comparabile si è verificato dopo una dose precedente di un vaccino simile? C’è stata un’esposizione a un potenziale fattore di rischio o tossina prima dell’evento? C’è stata una malattia acuta prima dell’evento? L’evento si è verificato in passato, indipendentemente dalla vaccinazione? Il paziente stava assumendo farmaci prima della vaccinazione? Esiste una plausibilità biologica?
Passo 1
Il primo passo dell’algoritmo rivisto è quello di cercare forti prove per altre cause. Se esiste una spiegazione alternativa, l’AEFI è classificato come “Inconsistente con l’associazione causale all’immunizzazione”. John Mackie ha notato che in natura potrebbero esserci molteplici ragioni (cause) per lo stesso risultato, e se due possibili cause esistono contemporaneamente una delle due potrebbe essere il fattore causale8. Va notato che con la classificazione OMS-UMC dell’ADR e la vecchia classificazione OMS/Brighton dell’AEFI, anche se è disponibile una spiegazione alternativa, un’associazione causale con il farmaco o il vaccino è ancora considerata “Possibile”. Inoltre, le due cause potrebbero funzionare in modo sinergico. Un esempio di questo è dove i fattori di suscettibilità genetica e altri fattori di suscettibilità individuale rendono uno suscettibile di sviluppare un AEFI15,16. Nel nuovo algoritmo, se c’è una spiegazione alternativa per l’AEFI, o se è coinvolto un altro fattore, l’associazione causale con il vaccino viene respinta.12,14.
Passo 2
Il rapporto COIMS / OMS sulla farmacovigilanza è utilizzato a questo livello13. Sono state sviluppate definizioni di casi specifici AEFI per alcune reazioni. Nei casi in cui non sono disponibili definizioni di casi specifici e criteri per una particolare AEFI, è consentito improvvisare utilizzando definizioni di casi adottate dalla “letteratura medica standard, o da linee guida nazionali, oppure possono essere adottate a livello locale dai revisori” (pagina 11 del rapporto CIOMS / OMS). Le AEFI che soddisfano le definizioni dei casi e che si verificano entro la finestra temporale di aumento del rischio sono classificate come “associazione causale coerente all’immunizzazione”.
La finestra temporale accettabile per ogni evento avverso è diversa. I pazienti affetti da miofasciite macrofagica sono di solito adulti di mezza età che presentano artromialgie diffuse, stanchezza cronica e marcati deficit cognitivi, affaticamento o depressione dovuti alla persistenza a lungo termine dell’idrossido di alluminio all’interno dei macrofagi nel sito della precedente immunizzazione.17. Tuttavia, la sorveglianza dell’AEFI raramente si estende così a lungo.
Passo 3
Teoricamente, le reazioni che non sono note per avere un’associazione causale o quelle che non si trovano nella finestra temporale di aumento del rischio possono passare alla fase 3. In questa fase, viene fatta un’indagine per verificare se ci sono forti prove contro l’associazione causale. È notoriamente difficile dimostrare l’esistenza di un’associazione negativa, poiché è impossibile affermare che in ogni circostanza un esito irregolare sia impossibile. L’esempio fornito nel manuale si riferisce alla MMR e all’autismo.
È stato riferito che il Global Advisory Committee on Vaccine Safety (GACVS) e il Council for International Organizations of Medical Sciences (comitato dell’OIM) hanno concluso che non esiste alcuna prova di un’associazione causale tra vaccino MMR e disturbi autistici. Tale AEFI deve essere classificato come “incoerente con l’associazione causale all’immunizzazione” secondo il nuovo algoritmo.
Dopo la pubblicazione del presente manuale d’uso dell’AEFI, la conclusione sulla MMR e sull’autismo è stata nuovamente contestata (cfr. riquadro3). Questa prova mutevole mette in discussione l’utilità di introdurre questo passaggio nell’algoritmo dell’AEFI.
Passo 4
Supponendo che non esista una tale “forte evidenza contro un’associazione causale”, le reazioni che non sono note per avere un’associazione causale con il vaccino, possono andare al punto 4. È da qui che le reazioni possono essere classificate come indeterminate permettendo di valutarle in futuro come un nuovo segnale.
La domanda a questo punto è se è “classificabile – cioè se sono stati eseguiti tutti i test necessari per poterlo classificare secondo le definizioni CIOMS / OMS. Questa è la seconda volta che queste definizioni vengono invocate durante la valutazione AEFI.
Se alcune indagini non vengono effettuate o non sono disponibili, l’AEFI è etichettata come ‘Non classificabile’ (o classificata come ‘Inconsistente con l’associazione causale all’immunizzazione’, come la classificazione della paralisi flaccida dopo l’OPV, perché non erano disponibili indagini durante una malattia 1 mese prima della paralisi – vedi Appendice 3, pagina 36 del manuale AEFI12 per questo esempio).
Se tutte le indagini richieste fossero state effettuate e soddisfacessero i criteri di definizione dei casi, sarebbero state classificate come “associazione causale coerente all’immunizzazione” nella fase 2 e non sarebbero arrivate alla fase 4.
La terza possibilità è che tutte le indagini siano state effettuate in modo da essere classificabili, ma non soddisfano le definizioni dei casi. In questo caso si applica il motto del CIOMS / OMS: “se vi sono prove sufficienti che un evento non corrisponde alla definizione di un caso, tale evento deve essere respinto e deve essere riportato come “Non è un caso di [AEFI]” (Cfr. definizioni CIOMS / OMS e applicazione dei termini per la farmacovigilanza dei vaccini, pagina 170).13). Questo elimina ogni possibilità che l’AEFI che non è stato riconosciuto come causa di immunizzazione in precedenti studi epidemiologici venga incluso nel gruppo “Indeterminato” e valutato come un nuovo segnale. Così sembrano esserci solo due opzioni al punto 4: – o la reazione è classificata come ‘Non classificabile’ o è classificata come ‘Inconsistente associazione causale all’immunizzazione’. La categorizzazione come ‘Indeterminato’ o ‘Associazione causale coerente all’immunizzazione’ sono logicamente impossibili, dati i cavalieri menzionati sopra.
L’esercizio non finisce qui. Altri fattori di qualificazione sono anche indagati al punto 4. Si raccomanda di chiedere spiegazioni alternative in termini di background rate, altre condizioni di salute, esposizione a un potenziale fattore di rischio o tossina, malattie acute e altri farmaci. Molti di questi “altri fattori qualificanti”, come la malattia precedente e l’uso simultaneo di farmaci, sarebbero stati presumibilmente eliminati nella Fase 1 quando si cercavano prove per altre cause. IlBox 4 illustra come, nonostante ci siano prove epidemiologiche (lo Studio TOKEN) che il vaccino pentavalente può causare morte improvvisa e inaspettata, i numerosi decessi (come discusso nell’introduzione) non sono riconosciuti come causati dal vaccino, e la relazione dell’OMS nega che i decessi siano mai stati segnalati come AEFI. La valutazione della causalità di 132 casi gravi di AEFI caricati sul sito web del Ministero della Salute e del benessere della famiglia in India illustra le conseguenze dell’applicazione di questa nuova classificazione. 54 di questi bambini sono morti, mentre 78 sono sopravvissuti. La valutazione della causalità ha rilevato che il 50% dei sopravvissuti ha avuto reazioni alla vaccinazione, ma nemmeno un decesso è stato classificato come correlato al vaccino. Quasi tutti i decessi (96%) sono stati semplicemente classificati come non classificabili o coincidenti, presumibilmente perché la morte non è stata precedentemente riconosciuta come evento avverso causato da questo vaccino.18. I bambini ricoverati in ospedale dopo la vaccinazione con convulsioni intrattabili, potrebbero essere classificati come affetti da una reazione legata al prodotto del vaccino, ma se morissero, i decessi sarebbero classificati come “morti accidentali”.
Altri sottili cambiamenti nella definizione dei termini
Ridefinita l’associazione causale
Il termine associazione causale ora significa “un rapporto di causa-effetto tra fattore causale e una malattia senza che nessun fattore intervenga nei processi”. Questo è un importante passo indietro per la sicurezza del paziente. Il vecchio schema riconosceva, ad esempio, che una persona anziana con insufficienza cardiaca cronica può sviluppare sintomi di scompenso cardiaco dopo la vaccinazione antinfluenzale a causa di un aumento della temperatura causato dal vaccino o di stress da una reazione locale nel sito di vaccinazione. Si ritiene pertanto che il vaccino abbia contribuito all’insufficienza cardiaca in questa specifica situazione19. Secondo il nuovo schema, questo risultato non sarebbe considerato come causalmente correlato al vaccino. La questione se la morte si sarebbe verificata in quel momento, se non fosse stata provocata dall’immunizzazione, non sarebbe stata riconosciuta. Senza questo riconoscimento, molte persone anziane potrebbero essere esposte a questo rischio di morte inutilmente quando utilizzano questo vaccino. Se la vaccinazione di un neonato è stata segnalata come seguita da morte improvvisa, ma il bambino era malnutrito o comunque malato, ciò non significa che la valutazione della causalità non dovrebbe concludere alcuna relazione di causa ed effetto tra il vaccino e il decesso. In questa definizione non vi è alcuno spazio per considerare le causalità interagenti14,15. Il Comitato consultivo globale sulla sicurezza dei vaccini ha documentato molti decessi in bambini con malattie cardiache preesistenti dopo la somministrazione del vaccino pentavalente. L’OMS ora consiglia precauzioni durante la vaccinazione di tali bambini e questo ha ridotto il rischio di morte.1. Usando la nuova definizione di associazione causale, questa relazione non verrebbe riconosciuta e le vite sarebbero messe a rischio.
Secondo Collet e colleghi, è possibile che alcuni individui sperimentino una maggiore risposta immunogenica ai vaccini rispetto alla popolazione generale e quindi è importante comprendere le predisposizioni geneticamente determinate allo sviluppo di AEFI.19. Tuttavia, queste considerazioni non saranno prese in considerazione nel nuovo schema di valutazione della causalità CIOMS /WHO. Anche il contributo del vaccino alla precipitazione dell’encefalopatia in pazienti suscettibili a causa di fattori genetici non sarà preso in considerazione.15. Berkovic ha utilizzato analisi genetiche per identificare mutazioninovo nel gene SCNIA del canale del sodio nei pazienti con presunta encefalopatia indotta da vaccino16. In tutti questi casi, in tutti i casi, si ignorerà il contributo del vaccino alla precipitazione dell’encefalopatia.
È un peccato che, dopo tutti questi anni, gli autori si innamorino della fallacia di Hume che la causalità può essere rivendicata solo se X è sufficiente di per sé per Y. Si ignora il fatto che l’immunizzazione avrebbe potuto “contribuire materialmente” agli eventi avversi.
Plausibilità biologica
La plausibilità biologica è uno dei “principi guida” di Bradford Hill che favoriscono l’associazione causale10. Tuttavia, questo è limitato dallo stato delle conoscenze attuali e non dovrebbe essere usato di per sé per negare l’associazione causale. Per esempio, è ormai riconosciuto che il vaccino per il morbillo ad alto contenuto di morbillo è associato ad un eccesso di mortalità femminile.20. Il riconoscimento di questa associazione è stato ritardato a causa dell’assenza di una spiegazione biologicamente plausibile. Gli esperti dell’OMS riconoscono ora che i vaccini hanno effetti non specifici che regolano sia il sistema immunitario innato che quello adattivo e questo può influenzare la sopravvivenza dei bambini.21.
L’associazione dell’intussuscezione con la vaccinazione contro il rotavirus è stata accettata anche in un momento in cui non era disponibile una spiegazione biologicamente plausibile.11 (Vedi Box5). Il vaccino può quindi avere sia effetti benefici non specifici che effetti deleteri inaspettati che non devono essere trascurati semplicemente perché non è disponibile una spiegazione pronta per lo stesso al momento in cui viene notato per la prima volta.
Ridefinita la plausibilità biologica
Il significato del termine plausibilità biologica è stato a sua volta ridefinito nel manuale AEFI riveduto. Il manuale specifica che la plausibilità biologica può essere invocata solo quando i risultati di laboratorio o i sintomi o i segni sono simili o coerenti con la storia naturale e la fisiopatologia dell’infezione o dell’antigene. Altre spiegazioni biologicamente plausibili (dimostrando che esiste un meccanismo e una capacità di condurre dalla causa all’effetto)7non si qualificano. I quattro approcci per l’accertamento della causalità descritti da Brady includono l’individuazione della regolarità neo-umeana, l’esame della manipolazione controfattuale e sperimentale e l’esame dei meccanismi e delle capacità.7. La nuova AEFI riconosce solo l’approccio sperimentale all’esclusione di altri approcci validi e, di conseguenza, può non riuscire a rilevare la causalità in un certo numero di casi con conseguente danno.
La sindrome da affaticamento cronico e la sperimentazione del vaccino contro l’HPV
La discussione di cui sopra ha ipotizzato che gli eventi avversi che sono riportati negli studi di controllo randomizzati di prelicenza originali, sarebbero stati classificati come eventi avversi noti per essere associati al vaccino.
Slate ha studiato studi randomizzati sui vaccini contro il papillomavirus umano (HPV) e ha scoperto che i potenziali effetti collaterali sono stati raccolti solo per due settimane nello studio di un anno. Dopo 2 settimane, i singoli sperimentatori hanno deciso, in base al loro giudizio personale, se segnalare i problemi medici come eventi avversi. Spesso hanno elencato nuovi problemi come “nuova anamnesi”. L’encefalomielite mialgica, altrimenti nota come sindrome da fatica cronica (CFS), è una condizione caratterizzata da fatica a lungo termine che limita la capacità di una persona di svolgere le normali attività quotidiane. I partecipanti allo studio HPV hanno riferito a Slate che questi sintomi debilitanti della loro malattia non sono stati nemmeno registrati come eventi avversi.
Dato che il CFS non è stato registrato come evento avverso, ha permesso ai produttori di affermare che il CFS non è un “evento avverso noto con il vaccino” e quindi di scontare ogni caso che è stato segnalato successivamente.
Prove di vaccino contro il Rotavirus
IlBox 5 descrive come gli eventi avversi, registrati in uno studio clinico randomizzato (RCT) e inviati all’autorità regolatoria per l’approvazione e la licenza del vaccino, non siano resi pubblici. Questo va contro la sentenza della Corte di Giustizia Europea che stabilisce che le relazioni degli studi clinici sono madepubblicamenteaccessibili.
Altri problemi con la registrazione e la segnalazione dell’AEFI
IlBox 6 descrive come i Periodic Safety Update Reports (PSUR) 15 e 16 di Infanrix Hexa e i risultati dei rapporti sono stati aperti al pubblico scrutinio da un tribunale italiano.Il Box 7 descrive come il PSUR 19 è stato ottenuto secondo le regole della Libertà di Informazione e mostra come i decessi riportati nel PSUR 16 sono stati cancellati dal PSUR 19, quando era evidente che i decessi riportati superavano i decessi previsti per caso.22. Nel 1986 il presidente Ronald Reagan ha firmato il National Childhood Vaccine Injury Act (NCVIA) (42 U.S.C. §§ 300aa-1 a 300aa-34) che ha creato un sistema di compensazione delle lesioni legate al vaccino. Questo ha reso difficile citare in giudizio i produttori di vaccini. IlBox 8 descrive i cambiamenti che impediscono ai pazienti di chiedere conto ai produttori per gli eventi avversi causati dai loro prodotti.IlBox 9 mostra come i dati AEFI non siano più facilmente disponibili. Mentre da un lato, la nuova classificazione sconta l’AEFI come “Non è un caso di [AEFI]”, i dati sulla sicurezza vengono manipolati e resi inaccessibili.
Plausibilità biologica: reazioni con vaccini multivalenti
Guardando i dati VAERS dei decessi dopo l’immunizzazione, Goldman e colleghi hanno scoperto che c’è stata più mortalità tra i bambini che hanno ricevuto da cinque a otto vaccini insieme, rispetto a quelli che hanno ricevuto meno vaccini23Nel caso di Boatman contro il Segretario della Salute e dei Servizi Umani, 13-611 (Fed. CI 2017), in cui il neonato di 4 mesi aveva ricevuto 7 antigeni del vaccino in un giorno, il tribunale, dopo aver sentito il parere di un esperto, ha ritenuto che le citochine infiammatorie stimolate dal vaccino possono agire come neuro-modulatori e causare la depressione del sistema serotoninergico a 5-idrossitriptofano (5-HT) nel midollo allungato del neonato e attenuare la normale risposta chemio-sensibile all’eccesso di anidride carbonica e questo può portare alla morte dei neonati vulnerabili durante il sonno. I vaccini multipli provocano un maggiore rilascio di citochine. I criteri di Hill di un gradiente di risposta alla dose (numero di antigeni in questo caso), possono essere soddisfatti qui10.
Vaccini multipli limitati a 5 nell’Esercito Italiano
La relazione finale dell ‘inchiesta dellaCommissione Parlamentare Italiana (Doc. XXII-bis N.23) sui casi di morte e lesioni gravi che colpiscono il personale italiano assegnato a missioni militari all’estero, ha raccomandato che non più di 5 vaccini monodose monovalenti possano essere somministrati contemporaneamente al personale militare, al fine di evitare reazioni avverse. Tutto ciò suggerisce la necessità di cautela nell’utilizzo contemporaneo di più vaccini. Ironia della sorte, mentre è proibito per gli uomini militari adulti sani, l’Hexavac (che combina 6 antigeni) è ancora autorizzato in Italia per l’uso nei neonati.
Revisione della classificazione AEFI e dei principi di precauzione
E’ evidente dalla discussione precedente che lo schema di valutazione AEFI riveduto prodotto dal CIOMS / OMS è stato progettato per negare la possibilità che qualsiasi evento avverso osservato di recente possa essere causalmente correlato all’immunizzazione. Il manuale dell’AEFI afferma che “le accuse che i vaccini / le vaccinazioni causano eventi avversi devono essere affrontate in modo rapido ed efficace. In caso contrario, la fiducia in un vaccino può essere compromessa e, in ultima analisi, avere conseguenze drammatiche per la copertura immunitaria…”.12
Lafigura 2 mostra come tutti i casi di AEFI, ad eccezione di quelli che sono noti effetti avversi del vaccino, siano classificati come non causalmente correlati.
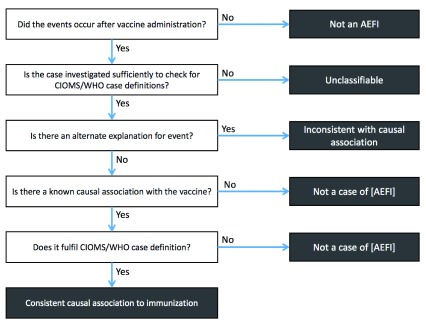
Figura 2.Percorso per raggiungere lo status di “associazione causale coerente con l’immunizzazione”.
Il negazionismo dell’AEFI è una chiara violazione del “principio di precauzione” (diritto dell’Unione Europea), che impone che “quando un’attività solleva minacce di danno all’ambiente o alla salute umana, devono essere prese misure precauzionali anche se alcune relazioni di causa ed effetto non sono pienamente stabilite scientificamente. La società e il governo sono esortati a prendere misure precauzionali fino a quando non saranno disponibili tutte le prove scientifiche, laddove vi siano prove di rischio”. Questo nuovo schema di classificazione AEFI che permette di negare completamente qualsiasi nuova associazione causale con la vaccinazione potrebbe anche essere in contrasto con l’articolo2 della Convenzione europea dei diritti dell’uomo (art. 2 CEDU), che dà mandato ai governi di stabilire un quadro di leggi, precauzioni e mezzi la cui applicazione, nella misura più ampia possibile, proteggerà la vita.
Paradossalmente, si dice che l’algoritmo AEFI sia per la sicurezza dei vaccini. Forse abbiamo bisogno di uno schema per la sicurezza pubblica piuttosto che per la sicurezza dei vaccini.
La storia del vaccino pentavalente è stata introdotta all’inizio di questo articolo ed è riassunta nel riquadro10. Si tratta principalmente di un vaccino utilizzato nei paesi in via di sviluppo dove la sorveglianza dell’AEFI è scarsa, la stampa è meno vigile nel segnalare eventi avversi e dove la regolamentazione dei farmaci è meno rigorosa. (I paesi più ricchi dell’Occidente, dell’Europa e degli USA, non usano il vaccino per la pertosse a cellule intere; quindi questo vaccino non è commercializzato in quei paesi). Casi isolati di decessi inspiegabili continuano ad essere riportati dalla stampa. Con la nuova classificazione AEFI, in assenza di “prove epidemiologiche” che colleghino i decessi al vaccino, questi decessi sono stati spacciati per “coincidenze” di SIDS. Le prove epidemiologiche, tuttavia, sono ora disponibili per collegare i decessi al vaccino.
Per esaminare se i decessi a seguito del vaccino pentavalente sono stati semplicemente coincidenti, è stato condotto uno studio su 45 milioni di neonati sottoposti a vaccinazione con DTP e 25 milioni che hanno ricevuto il vaccino pentavalente. Lo studio ha ipotizzato che tutti i decessi (autodenunciati al sistema di sorveglianza governativo con 72 ore di vaccinazione) associati al DPT potrebbero essere morti accidentali di SIDS, ma qualsiasi aumento del tasso di mortalità dopo il vaccino pentavalente deve essere ipotizzato come causato dal vaccino pentavalente. Le probabilità di morte dopo il vaccino pentavalente sono state raddoppiate (OR 1,98 (95% CI 1,65 a 2,38)) rispetto al DTP. Ci sono stati 4,7 decessi aggiuntivi (95% IC: 3,5-5,9) per milione di persone vaccinate con il vaccino pentavalente invece del DTP (p<0,0001). Al momento in cui questa prova è stata messa insieme, 122 decessi in eccesso (95% IC: 101-145) erano stati segnalati al governo, a causa del passaggio dal DPT al vaccino pentavalente. Il contributo della nuova classificazione AEFI in questo ritardo nel riconoscimento del problema è evidente.24.

Figura 2.Percorso per raggiungere lo stato di “associazione causale coerente all’immunizzazione”.
La necessità di rivedere Brighton
La classificazione riveduta ha eliminato le categorie “probabilmente” e “possibile” dalla classificazione AEFI – proprio come gli esperti che hanno indagato sulle morti in Sri Lanka. Questo sembra essere motivato da un lodevole desiderio di ridurre la titubanza del vaccino e il conseguente rischio di malattia prevenibile. Ilrapporto dello Sri Lanka dice: “I casi sono stati classificati in questa revisione come improbabili laddove, nonostante non ci fossero prove che il vaccino o i vaccini abbiano contribuito all’evento avverso o all’esito della morte, mancavano prove conclusive riguardanti una causa (o cause) alternativa dell’evento e dell’esito. Ciò significa che abbiamo ritenuto che la classificazione dell’AEFI nella categoria “non correlata” non fosse pienamente giustificata (in quanto non poteva essere attribuita in modo conclusivo ad un’altra causa). In tali casi, andiamo oltre per affermare che la conclusione di ‘improbabile’ significa che il vaccino non è la causa principale di morte anche nei casi in cui si discute la possibilità che il/i vaccino/i o la vaccinazione possano aver smascherato una condizione di fondo”.
Sembra che gli esperti dello Sri Lanka fossero riluttanti, anche a classificare i decessi come “improbabili”, poiché potrebbe essere interpretato nel senso di una qualche probabilità di associazione causale. Per citare il rapporto, “Improbabile: Nel definire questa categoria, il panel ha preso nota del fatto che la categoria dell’OMS “improbabile” è spesso interpretata nel senso che c’è (al contrario) una certa probabilità di associazione causale tra l’evento avverso e il/i vaccino/i somministrato/i”.
Si può ipotizzare che lo stesso ragionamento e la motivazione (per allearsi all’ansia pubblica di un’associazione causale tra l’AEFI e la vaccinazione), avrebbero fornito l’impulso per la classificazione riveduta dell’AEFI.
Le conseguenze
Che i vaccini fanno più bene che male è preso come un articolo di fede, un dogma, un principio. Se lo scopo di questo esercizio i AEFI-denalismo è quello di evitare di minare la fiducia nei vaccini, lo schema non sembra funzionare. Infatti, lo scetticismo dell’opinione pubblica sembra aumentare piuttosto che diminuire con questi sforzi di rassicurazione che i vaccini sono sicuri.25,26. Epidemie di malattia prevenibile da vaccino hanno portato a27.
La risposta in alcuni Stati degli Stati Uniti è stata quella di rendere obbligatoria la vaccinazione per l’ammissione nelle scuole pubbliche, mentre inCalifornia, a partire dal 1° luglio 2016, non sonoconsentitederoghe per la vaccinazione per motivipersonali e religiosi. I dibattiti del 2016tra gli aspiranti presidenziali repubblicani statunitensi suggeriscono la mancanza di un ampio sostegno a questa misura. Il Department of Health and Human Services Office for Civil Rights (Ufficio per i diritti civili del Dipartimento della salute e dei servizi umani) ha ora istituito la Conscience and Religious Freedom Division (Divisione per la coscienza e la libertà religiosa), alla quale i singoli individui possonolamentarsi se la loro coscienza o la loro libertà religiosa sono state ridotte. Il modo in cui queste forze interagiranno è un’ipotesi condivisibile, ma lo scenario attuale è di cattivo auspicio per la fiducia dell’opinione pubblica nei vaccini e nelle vaccinazioni volontarie.
Dove andiamo a finire
Il manuale AEFI deve essere urgentemente rivalutato e rivisto. Dobbiamo costruire un sistema migliore che raccolga i problemi e allo stesso tempo non crei una diffidenza nei confronti dei vaccini che sono stati associati a una maggiore riduzione della mortalità infantile.
Le reazioni avverse e i decessi possono non mostrare un aumento significativo nei piccoli studi sulla sicurezza. Tuttavia, le registrazioni di tutti i decessi e dei gravi eventi avversi successivi alle vaccinazioni devono essere mantenute e periodicamente riesaminate per verificare la presenza di segnali di sicurezza. La pratica di scartare queste registrazioni come “associazione causale incoerente all’immunizzazione” deve cambiare. Il confronto degli eventi avversi dei vaccini somministrati alla stessa età, come è stato fatto con il DTP e il vaccino pentavalente, può aiutare a identificare gli eventi avversi relativi ad uno dei vaccini. L’incidenza specifica degli eventi avversi in base al sesso può anche fungere da indicatore. Fino a quando non svilupperemo un sistema migliore, potrebbe essere consigliabile ripiegare sulle categorie di vittime testate dall’OMS-UMC e sulle categorie di Brighton e sbagliare dal punto di vista della sicurezza dei bambini.
References
- Global Advisory Committee on Vaccine Safety, 12–13 June 2013.. Wkly Epidemiol Rec.. 2013; 88(29):301-12. PubMed
- WHO Experts Report. High Court of Delhi at New Delhi WP (C) 13698 of 2009 Dr KB Saxena and others (petitioners) versus Union of India and others (respondents)..
- Puliyel J, Mathew JL, Priya R. Incomplete reporting of research in press releases: et tu, WHO?. Indian J Med Res.. 2010; 131:588-9. PubMed
- Saxena KB, Banerji D, Qadeer I. “Antivaccine lobby” replies to the
BMJ.. BMJ.. 2010; 341DOI | PubMed - WHO. Safety of Quinvaxem (DTwP-HepB-Hib) pentavalent vaccine. 2013. Publisher Full Text
- Hume DA. Treatise of Human Nature. 1739. Publisher Full Text
- Brady HE. Causality and explanation in social research.
- Mackie JL. Causes and conditions.. Am Philos Q.. 1965; 2(4):245-64. Publisher Full Text
- Athey v. Leonati (1996), 140 D.L.R. (4th) 235 at para. 32, [1996] 3 S.C.R. 458, [1997] 1 W.W.R. 97 quoted in David H, McCague WP, Yaniszewski PF
The Advocates’ Quarterly. 2005; 30:216-238. Publisher Full Text - Hill AB. The Environment and Disease: Association or Causation?. Proc R Soc Med.. 1965; 58:295-300. PubMed
- Center for Disease Control and Prevention. Rotavirus Vaccine (RotaShield) and Intussusception.Publisher Full Text
- WHO:. The Causality assessment of an adverse event following immunization (AEFI): User manual for the revised WHO classification.Publisher Full Text
- Definitions and Application of Terms for Vaccine Pharmacovigilance CIOMS/WHO. Definitions and Application of Terms for Vaccine Pharmacovigilance Report of CIOMS/ WHO Working Group on Vaccine Pharmacovigilance.Publisher Full Text
- Legge D, Puliyel J. Enhancing community confidence in vaccines safety.. BMJ.. 2017; 357Publisher Full Text
- Soriano A, Nesher G, Shoenfeld Y. Predicting post-vaccination autoimmunity: who might be at risk?. Pharmacol Res.. 2015; 92:18-22. DOI | PubMed
- Berkovic SF, Harkin L, McMahon JM. De-novo mutations of the sodium channel gene
SCN1A in alleged vaccine encephalopathy: a retrospective study.. Lancet Neurol.. 2006; 5(6):488-92. DOI | PubMed - Rigolet M, Aouizerate J, Couette M. Clinical features in patients with long-lasting macrophagic myofasciitis.. Front Neurol.. 2014; 5:230. DOI | PubMed
- Puliyel J, Phadke A. Deaths following pentavalent vaccine and the revised AEFI classification.. Ind J Med Ethics.. 2017; 2(4):300-301. DOI | PubMed
- Collet JP, MacDonald N, Cashman N. Monitoring signals for vaccine safety: the assessment of individual adverse event reports by an expert advisory committee. Advisory Committee on Causality Assessment.. Bull World Health Organ.. 2000; 78(2):178-85. PubMed
- Aaby P, Jensen H, Samb B. Differences in female-male mortality after high-titre measles vaccine and association with subsequent vaccination with diphtheria-tetanus-pertussis and inactivated poliovirus: reanalysis of West African studies.. Lancet.. 2003; 361(9376):2183-8. DOI | PubMed
- Higgins JP, Soares-Weiser K, López-López JA. Association of BCG, DTP, and measles containing vaccines with childhood mortality: systematic review.. BMJ.. 2016; 355:i5170. DOI | PubMed
- Puliyel J, Sathyamala C. Infanrix hexa and sudden death: a review of the periodic safety update reports submitted to the European Medicines Agency.. Indian J Med Ethics.. 2018; 1(1):43-47. DOI | PubMed
- Goldman GS, Miller NZ. Relative trends in hospitalizations and mortality among infants by the number of vaccine doses and age, based on the Vaccine Adverse Event Reporting System (VAERS), 1990-2010.. Hum Exp Toxicol.. 2012; 31(10):1012-21. DOI | PubMed
- Puliyel J, Kaur J, Puliyel A. Deaths reported after Pentavalent vaccine compared with death reported after diphtheria-tetanus-pertussis vaccine – an exploratory analysis.Publisher Full Text
- MacDonald NE, SAGE Working Group on Vaccine Hesitancy. Vaccine hesitancy: Definition, scope and determinants.. Vaccine.. 33(34):4161-4164. DOI | PubMed
- Sci Dev Net:. Parental doubt drives drop in vaccination.Publisher Full Text
- Clemmons NS, Gastanaduy PA, Fiebelkorn AP. Measles – United States, January 4-April 2, 2015.. MMWR Morb Mortal Wkly Rep.. 2015; 64(14):373-376. PubMed
Fonte
Puliyel J, Naik P (2018) Revised World Health Organization (WHO)’s causality assessment of adverse events following immunization—a critique. F1000Research 7243. https://doi.org/10.12688/f1000research.13694.2





