Abstract
Introduzione
La fibrillazione atriale è la più comune aritmia cardiaca sostenuta ed è associata ad un aumento di cinque volte del rischio di ictus.123 Il trattamento con anticoagulanti riduce il rischio di circa due terzi.4
5
6
La fibrillazione atriale non valvolare è classificata in tre sottotipi: parossistica se il ritmo normale viene ripristinato spontaneamente; persistente se l’episodio dura più di sette giorni o viene terminato prima utilizzando farmaci o la cardioversione a corrente continua; e permanente se la cardioversione non riesce a ripristinare il normale ritmo cardiaco.78 Il catetere o l’ablazione chirurgica possono essere usati quando la cardioversione non riesce o se vi sono prove di un disturbo elettrofisiologico sottostante.9
10
La fibrillazione atriale può essere definita come risolta una volta ripristinato il ritmo normale, ma è possibile una successiva ricorrenza dopo la risoluzione spontanea o la cardioversione. Allo stesso modo, il tasso di successo a lungo termine dell’ablazione può arrivare al 20%.111213I pazienti in cui la fibrillazione atriale è considerata risolta potrebbero infatti avere sottotipi parossistici o persistenti, oppure una fibrillazione atriale che potrebbe ripresentarsi. Tali pazienti potrebbero rimanere a rischio di ictus e continuare a beneficiare della profilassi anticoagulante.11
Nel Regno Unito non esiste una guida chiara su come trattare i pazienti con fibrillazione atriale risolta. Nelle linee guida cliniche commissionate dal National Institute for Health and Care Excellence, i pazienti con fibrillazione atriale risolta non sono esplicitamente menzionati, anche se per i pazienti che hanno subito un’ablazione, le linee guida affermano brevemente che gli autori “ritengono che la pratica clinica comune sia quella di continuare a trattare i pazienti secondo il loro punteggio di rischio di ictus preablazione”.”2 In Inghilterra, tuttavia, i pazienti con un record di fibrillazione atriale risolta sono esclusi dal registro della fibrillazione atriale Quality and Outcomes Framework, uno schema che incentiva una gestione appropriata dei pazienti con fibrillazione atriale in cure primarie; le linee guida emesse dall’NHS Inghilterra affermano che i pazienti con fibrillazione atriale risolta dovrebbero essere “rimossi dal registro” 14 – con l’implicazione che questi pazienti non richiedono un ulteriore monitoraggio o un trattamento anticoagulante. Le linee guida europee, canadesi e statunitensi non fanno alcun riferimento ai pazienti con fibrillazione atriale risolta; tuttavia, pur rilevando una mancanza di prove, raccomandano di continuare il trattamento anticoagulante dopo la cardioversione o dopo l’ablazione nei pazienti ad alto rischio di ictus.15
16
17
18
Ad oggi, c’è una carenza di prove relative alla prognosi dei pazienti in cui la fibrillazione atriale è codificata come risolta. Abbiamo confrontato i tassi di ictus o di attacco ischemico transitorio (TIA) in pazienti con una precedente diagnosi di fibrillazione atriale che sono stati successivamente codificati come “fibrillazione atriale risolta” rispetto ai tassi in pazienti con fibrillazione atriale non risolta e quelli senza storia di fibrillazione atriale. Abbiamo anche confrontato tutte le cause di mortalità nei pazienti con fibrillazione atriale risolta rispetto a quelli con e senza fibrillazione atriale. Per fornire un certo contesto, riportiamo anche la frequenza delle registrazioni che indicano la fibrillazione atriale risolta nei pazienti con fibrillazione atriale dal 2000 ad oggi, e i tassi di trattamento anticoagulante nei pazienti con fibrillazione atriale e fibrillazione atriale risolta.
Metodi
Fonte dei dati
Abbiamo estratto dei set di dati da The Health Improvement Network (THIN), un database di cartelle cliniche elettroniche di medicina generale del Regno Unito che utilizza un software Vision. Esso include i dati di circa 14 milioni di pazienti registrati con più di 640 studi medici. THIN comprende dati codificati sulle caratteristiche dei pazienti, diagnosi, prescrizioni, consulti e indagini. Abbiamo considerato gli ambulatori come idonei alla partecipazione a partire dalla data di registrazione della mortalità accettabile più tardiva dello studio, dalla data di installazione di Vision più un anno e dalla data di inizio dello studio (un anno prima della data del primo indice o del censimento).
Progettazione dello studio
Prevalenza della fibrillazione atriale risolta
Per determinare la percentuale di pazienti con un codice per la “fibrillazione atriale risolta” in ogni anno di studio, abbiamo eseguito 17 analisi sequenziali in sezione trasversale, con date di censimento al 1° dicembre di ogni anno dal 2000 al 2016. Gli adulti di 18 anni o più e registrati per almeno 365 giorni prima della data del censimento potevano essere inclusi.
Incidenza di ictus o TIA e mortalità
Abbiamo condotto due studi di coorte retrospettivi per determinare i tassi di incidenza dell’ictus o TIA (outcome primario) e tutti causano la mortalità (outcome secondario) in pazienti con un codice per la fibrillazione atriale risolta rispetto ai controlli abbinati selezionati in modo casuale con fibrillazione atriale diagnosticata (non risolta) o senza storia di fibrillazione atriale. Il periodo di studio va dal 1° gennaio 2000 al 15 maggio 2016.
Gli adulti di età pari o superiore ai 18 anni e registrati per almeno 365 giorni prima dell’ingresso nello studio erano idonei all’inclusione. Abbiamo escluso i pazienti con una storia di ictus o TIA alla data dell’indice. L’esclusione dei pazienti affetti da ictus o TIA aumenta il rischio di ulteriori eventi di questo tipo; l’esclusione dei pazienti affetti elimina questo rischio aggiuntivo e minimizza la distorsione della sorveglianza. Per i controlli abbinati senza fibrillazione atriale, abbiamo escluso i pazienti con una diagnosi di fibrillazione atriale.
L’esposizione era un codice clinico di “fibrillazione atriale risolta”. La data indice era la data di codifica della fibrillazione atriale risolta più 180 giorni (sei mesi), per consentire un tempo sufficiente per il ritiro dei farmaci anticoagulanti e quindi qualsiasi effetto residuo del trattamento. Nell’analisi di sensibilità abbiamo usato la data di codifica per la fibrillazione atriale risolta come data indice. Abbiamo confrontato ogni paziente esposto con un massimo di due controlli della stessa età (entro un anno), sesso e pratica generale alla data indice, con la fibrillazione atriale diagnosticata e senza codice di fibrillazione atriale risolta, o senza registrazione di una diagnosi di fibrillazione atriale.
Per selezionare in modo casuale i controlli abbinati, abbiamo identificato i pazienti nel gruppo di esposizione (fibrillazione atriale risolta) e abbiamo rimescolato il loro ordine, permutando casualmente la lista dei pazienti (seguendo l’algoritmo di Fisher Yates) e utilizzando un generatore congruenziale lineare come fonte di casualità. Tutte le permutazioni si verificano con uguale probabilità. Abbiamo quindi selezionato i controlli. Lo shuffling assicura che tutti i pazienti del gruppo di esposizione abbiano la stessa probabilità di essere abbinati ad un controllo nei casi in cui tale controllo potrebbe potenzialmente essere abbinato a più di un paziente esposto. Quando il numero di controlli possibili per un particolare paziente esposto ha superato il numero richiesto (qui 2), abbiamo usato un generatore congruenziale lineare per generare un numero casuale tra 1 e il numero di controlli potenziali; abbiamo quindi selezionato il controllo potenziale nella posizione di questo numero casuale e abbiamo ripetuto il processo per il secondo controllo.
I pazienti ammissibili sono stati seguiti dalla data dell’indice fino al primo di qualsiasi evento di censura (il paziente ha lasciato il set di dati o è stato trasferito, il decesso, la data di fine studio, l’upload dei dati più recenti dalla pratica) o un evento di esito (esito primario: ictus o TIA; esito secondario: decesso).
Analisi
Tutte le analisi sono state eseguite in Stata IC versione 14.2.
Frequenza della fibrillazione atriale risolta
Ad ogni data di censimento abbiamo calcolato la percentuale di pazienti con fibrillazione atriale che hanno avuto una qualsiasi registrazione di un codice di fibrillazione atriale risolta e che hanno avuto una diagnosi corrente di fibrillazione atriale risolta, con intervalli di confidenza del 95% per le proporzioni. Ad ogni data di censimento abbiamo calcolato le percentuali di trattamento anticoagulante nei pazienti con fibrillazione atriale e fibrillazione atriale risolta con un rischio di ictus da moderato ad alto (punteggio CHA2DS2-VASc ≥1). La diagnosi corrente è stata definita utilizzando il codice clinico più recente prima della data del censimento; il trattamento anticoagulante corrente è stato definito come una prescrizione di qualsiasi anticoagulante fino a 90 giorni prima della data del censimento. Abbiamo usato un test χ 2 per calcolare i valori P per le tendenze nel tempo.
Incidenza di ictus o TIA e mortalità
Abbiamo valutato le differenze di base tra i gruppi di esposizione e di controllo utilizzando i test χ 2 per le variabili categoriali e i test t per le variabili continue. I tassi di incidenza grezzi di ictus o TIA (outcome primario) e la mortalità grezza di tutte le cause (outcome secondario) sono stati calcolati in pazienti con fibrillazione atriale risolta, fibrillazione atriale e nessuna fibrillazione atriale. Abbiamo calcolato i tassi di incidenza grezzi e corretti confrontando l’incidenza di ictus o TIA e la mortalità nei pazienti con fibrillazione atriale risolta rispetto a quelli con e senza fibrillazione atriale.
Regressione di Poisson è stato utilizzato per calcolare i rapporti di tasso di incidenza corretti, regolando per l’età di base covariates covariates, sesso, Townsend privazione quinto, indice di massa corporea (BMI), lo stato di fumo (fumatore attuale), il consumo di alcol (non bevitore, bevitore, bevitore eccessivo), Charlson categoria indice di comorbidità, prescrizione di statina corrente, e la prescrizione anticoagulante corrente. È stata effettuata un’analisi di sensibilità in cui abbiamo sostituito la covariata dell’indice di comorbidità di Charlson con le singole comorbidità associate alla fibrillazione atriale: storia di insufficienza cardiaca, cardiopatia ischemica, diabete (tipo 1 o tipo 2), e ipertensione (variabili binarie), e la categoria del tasso di filtrazione glomerulare stimato (eGFR). In un’ulteriore analisi di sensibilità, il modello di regressione ha incluso qualsiasi uso di statina o anticoagulante. Abbiamo controllato l’ipotesi di pericolo proporzionale utilizzando i diagrammi log-log e il test dei residui di Schoenfeld.
Nell’analisi primaria, la data dell’indice era la data della fibrillazione atriale risolta più 180 giorni. In un’analisi di sensibilità, abbiamo usato la data della fibrillazione atriale risolta come data indice.
La funzione di rischio cumulativo Nelson-Aalen è stata utilizzata per tracciare il rischio cumulativo di ictus o TIA e mortalità.
Abbiamo calcolato la proporzione (con intervalli di confidenza del 95%) dei pazienti con fibrillazione atriale risolta e con fibrillazione atriale ricorrente diagnosticata dopo la data di risoluzione della fibrillazione atriale insieme al tasso di incidenza della fibrillazione atriale ricorrente in questi pazienti. È stata eseguita un’analisi di sottogruppo che ha confrontato l’incidenza di ictus o TIA in pazienti con fibrillazione atriale risolta con e senza una registrazione di fibrillazione atriale ricorrente rispetto a pazienti senza fibrillazione atriale.
Abbiamo effettuato tre ulteriori analisi di sottogruppo: abbiamo calcolato i tassi di incidenza corretti di ictus o TIA nei pazienti con fibrillazione atriale risolta il cui codice più recente prima della risoluzione della fibrillazione atriale era per la fibrillazione atriale parossistica rispetto a quelli il cui codice più recente era per altri tipi di fibrillazione atriale; pazienti con fibrillazione atriale risolta e una recente registrazione di ablazione (<180 giorni prima del codice risolto) rispetto a quelli senza una recente registrazione di ablazione; e pazienti con fibrillazione atriale risolta con una registrazione attuale di una prescrizione di anticoagulante rispetto a quelli senza una registrazione attuale.
Abbiamo calcolato la proporzione (con intervalli di confidenza del 95%) dei pazienti con fibrillazione atriale risolta usando il trattamento anticoagulante corrente (<90 giorni prima della data di risoluzione della fibrillazione atriale) al momento della registrazione del codice risolto, insieme alle proporzioni usando il trattamento 1-90 giorni e 91-180 giorni dopo la data di risoluzione della fibrillazione atriale. Abbiamo anche calcolato la proporzione di pazienti con fibrillazione atriale risolta utilizzando gli anticoagulanti attuali che hanno continuato il trattamento fino a 90 e 180 giorni dopo la data di risoluzione della fibrillazione atriale.
È stata effettuata un’analisi temporale dividendo i set di dati corrispondenti in quattro gruppi di pari dimensioni per data indice (date di inizio nel 2000, 2007, 2010 e 2013). Abbiamo calcolato l’incidenza grezza dell’ictus o TIA nei pazienti con fibrillazione atriale risolta, con fibrillazione atriale e senza fibrillazione atriale, insieme a rapporti di tasso di incidenza corretti per la fibrillazione atriale risolta rispetto ai pazienti con e senza fibrillazione atriale.
Definizioni delle variabili
La presenza di un codice clinico è stata utilizzata per definire la fibrillazione atriale, la fibrillazione atriale parossistica, la fibrillazione atriale risolta e l’ictus o TIA; l’assenza di un codice è stata presa per indicare l’assenza di una diagnosi o di un evento di esito. Gli elenchi di codici clinici utilizzati sono stati utilizzati da diversi studi sulla fibrillazione atriale202122 e includono tutti i codici utilizzati nel Quality and Outcomes Framework.23 La definizione di ictus o TIA comprendeva l’ictus ischemico, l’ictus emorragico (compresa l’emorragia intracerebrale e l’emorragia subaracnoidea) e l’ischemia cerebrale transitoria, l’attacco ischemico transitorio o l’insufficienza vertebrobasilare.
Abbiamo utilizzato i dati più recenti sull’IMC e sullo stato del fumo prima della data di riferimento. Il consumo di alcol è stato classificato come non bevitore, bevitore e bevitore eccessivo; abbiamo identificato i bevitori dai dati del file demografico THIN (record più recente prima della data di riferimento); il bevitore eccessivo è stato definito da un record di un codice clinico (mai). Il livello di creatinina più recente prima della data di riferimento è stato utilizzato per calcolare l’eGFR con la formula: eGFR=186×(creatinina/88,4)-1,154×età-0,203×(0,742 se di sesso femminile); il fattore di correzione aggiuntivo per l’etnia nera (×1,210 se di sesso nero) non è stato incluso a causa della registrazione incompleta dell’etnia. L’insufficienza cardiaca, la cardiopatia ischemica, il diabete (tipo 1 o tipo 2) e l’ipertensione sono stati definiti da una registrazione di un codice clinico pertinente (mai); non abbiamo utilizzato farmaci, misure fisiologiche o esami di laboratorio per definire la presenza di queste malattie.
L’ablazione recente è stata definita come una registrazione di un codice di procedura per l’ablazione del cuore fino a 180 giorni prima della data di risoluzione della fibrillazione atriale.
Abbiamo calcolato il punteggio dell’indice di comorbidità di Charlson aggiungendo 1 punto ciascuno per le malattie vascolari periferiche, ulcere, malattie polmonari ostruttive croniche ostruttive o respiratorie, malattie del tessuto connettivo, demenza, insufficienza cardiaca o malattie coronariche, diabete, malattie epatiche lievi e infarto del miocardio; 2 punti ciascuno per il cancro del tratto digestivo, respiratorio o genitourinario, la leucemia, il linfoma, il cancro del labbro, delle ossa o della pelle, l’emiplegia e le malattie renali o le malattie renali croniche; 3 punti ciascuno per le malattie epatiche da moderate a gravi; e 6 punti ciascuno per il cancro metastatico e l’HIV/AIDS, ciascuno definito da un codice clinico registrato prima della data di riferimento. Poiché i pazienti con una storia di ictus o TIA sono stati esclusi, non è stato aggiunto 1 punto per questi eventi.
I punteggi CHA2DS2-VASc sono stati calcolati aggiungendo 1 punto ciascuno per un’anamnesi di insufficienza cardiaca congestizia, ipertensione, diabete, malattie vascolari, età 65-74 anni e sesso femminile (se era presente un altro fattore di rischio, altrimenti 0), e 2 punti per l’età ≥75. Poiché abbiamo escluso i pazienti con una storia di ictus o TIA, non sono stati aggiunti 2 punti per questi eventi.
L’uso attuale di statina o di anticoagulante è stato definito come la registrazione di una prescrizione rilevante entro 90 giorni prima della data dell’indice; qualsiasi uso è stato definito come la registrazione di una prescrizione prima della data dell’indice. Gli anticoagulanti comprendevano warfarin, anticoagulanti parenterali, altri antagonisti della vitamina K e nuovi anticoagulanti orali.
L’assenza di un codice diagnostico o di prescrizione è stata presa per indicare l’assenza di una malattia o di un farmaco, rispettivamente.
Dati mancanti
Le variabili erano complete, tranne il punteggio di Townsend, lo stato del fumo, lo stato del bere, l’IMC e l’eGFR. L’assenza di una registrazione dello stato del fumo è stata presa per indicare che il paziente non era un fumatore attuale. Ciò è coerente con i risultati di precedenti ricerche sulle registrazioni dello stato del fumo nei registri di assistenza primaria.24 Per il punteggio di Townsend, lo stato di ebbrezza, l’IMC e l’eGFR, nelle analisi corrette abbiamo utilizzato le categorie di indicatori mancanti; questa presunta mancanza non è stata associata al risultato. Abbiamo effettuato un’analisi di sensibilità utilizzando imputazioni multiple (10 imputazioni, equazioni concatenate) per sostituire i dati mancanti; ciò non ha fatto alcuna differenza per i risultati.
Coinvolgimento del paziente
Nessun paziente è stato coinvolto nella definizione della domanda di ricerca o delle misure di esito, né è stato coinvolto nello sviluppo di piani per la progettazione o la realizzazione dello studio. A nessun paziente è stato chiesto di dare consigli sull’interpretazione o di scrivere i risultati. Non ci sono piani per divulgare i risultati della ricerca ai partecipanti allo studio o alla comunità di pazienti interessata.
Risultati
Prevalenza e trattamento della fibrillazione atriale risolta
Un totale di 1-105-383 record per 222-269 pazienti unici con fibrillazione atriale sono stati inclusi nell’analisi nelle 17 date di censimento, con una mediana di 70 096 pazienti (intervallo interquartile 52 857-82 242) ogni anno. Il numero mediano di pazienti con fibrillazione atriale il cui codice diagnostico più recente alla data del censimento era “fibrillazione atriale risolta” era di 4627 (intervallo interquartile 970-6534) all’anno. In tutti gli anni, l’età media dei pazienti con fibrillazione atriale risolta era 67,8 (SD 14,8), il 60,2% (42-336/70-340) erano uomini e il punteggio medio CHA2DS2-VASc era 2.5 (SD 1,9); nei pazienti con fibrillazione atriale non risolta alla data del censimento, i valori corrispondenti erano 75,3 (11,4), 54,7% (566-513/1-35043) e 3,7 (1,7).
Tra i pazienti con fibrillazione atriale, la percentuale con qualsiasi codice clinico registrato di fibrillazione atriale risolta è stata del 7,8% (95% intervallo di confidenza dal 7,8% al 7.9%; 86-615/1105-383), passando dallo 0,9% (0,8% all’1,0%; 197/22-008) nel 2000 al 10,5% (10,3% al 10,8%; 6540/62-040) nel 2016 (P<0,001 per l’andamento nel tempo, fig. 1). La percentuale di pazienti con fibrillazione atriale la cui diagnosi più recente è stata risolta è aumentata dallo 0,8% (0,7% a 0,9%; 178/22/2008) nel 2000 al 7,5% (7,3% a 7,7%; 4627/62-040) nel 2016 (fig 1). Complessivamente, il 78,7% (dal 78,4% al 79,0%; 55-357/70-340) di questi pazienti sono stati classificati come a rischio da moderato ad elevato di ictus (punteggio CHA2DS2-VASc ≥1), passando dal 54,5% (46,9% al 62,0%; 97/178) nel 2000 all’84,1% (83,0% all’85,2%; 3892/4627) nel 2016 (P<0,001). Tra i pazienti con fibrillazione atriale risolta e con un punteggio CHA2DS2-VASc ≥1 alla data del censimento, la percentuale di pazienti che ricevono un trattamento anticoagulante in corso è aumentata dal 6,2% (2,3% al 13,0%; 6/97) nel 2000 al 14,3% (13,2% a 15.5%; 557/3892) nel 2016 (P<0,001 per variazione nel tempo); nei pazienti con fibrillazione atriale non risolta le percentuali di trattamento sono state rispettivamente del 34,3% (33,7% al 35,0%; 7026/20-479) e del 71,8% (71,5% al 72,2%; 39-746/55-335) (P<0,001).
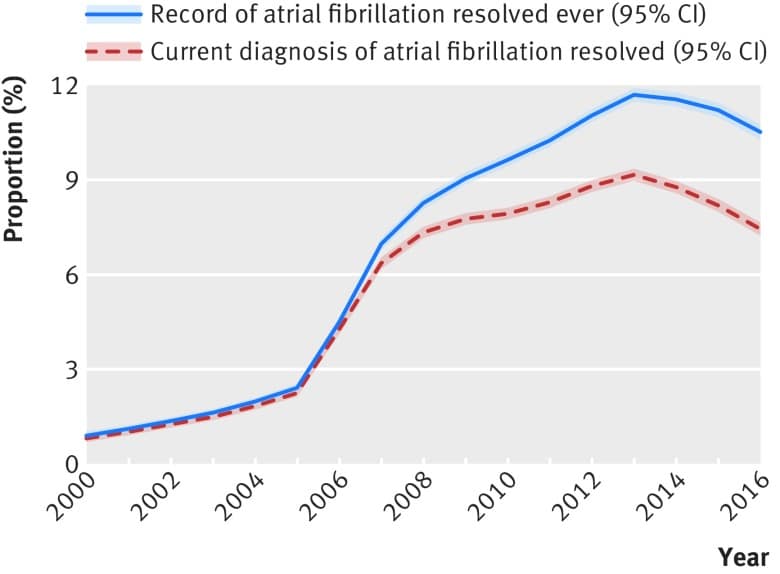
Fig. 1.Percentuale di pazienti con fibrillazione atriale con un record di fibrillazione atriale risolto dal 2000 al 2016

Fig. 1.Percentuale di pazienti con fibrillazione atriale con un record di fibrillazione atriale risolto dal 2000 al 2016
Incidenza di ictus o TIA e mortalità
Fibrillazione atriale risolta contro la fibrillazione atriale
In totale sono stati inclusi nell’analisi 26 218 pazienti, 11159 pazienti con fibrillazione atriale risolta e 15059 controlli con fibrillazione atriale. Le caratteristiche demografiche e lo stile di vita sono stati sostanzialmente simili tra i due gruppi, ad eccezione dell’età: in media, i pazienti con fibrillazione atriale risolta erano più giovani, con un’età mediana di 69,7 anni (intervallo interquartile 58,5-79,0) rispetto a 74,2 (66,2-81,0) anni(tabella 1); questa differenza è dovuta alla minore disponibilità di pazienti con fibrillazione atriale non esposta e con fibrillazione atriale abbinata in età più giovane. I pazienti con fibrillazione atriale risolta avevano meno comorbidità, meno prescrizioni attuali per le statine e sostanzialmente meno prescrizioni attuali per gli anticoagulanti.
| Caratteristiche | AF risolto (esposto) (n=11-159) | AF (controllo) (n=15-059) | No AF (controllo) (n=22-266) |
|---|---|---|---|
| Età media (fascia interquartile) (anni) | 69.7 (58.5-79.0) | 74.2 (66.2-81.0) | 69.6 (58.5-78.9) |
| Uomini | 6561 (58.8) | 8734 (58.0) | 13 096 (58.8) |
| Townsend privazione quinto: | |||
| 1ª (meno deprivato) | 3210 (28.8) | 4291 (28.5) | 6367 (28.6) |
| 2a | 2732 (24.5) | 3565 (23.7) | 5247 (23.6) |
| Terzo | 2248 (20.2) | 2969 (19.7) | 4347 (19.5) |
| 4° posto | 1642 (14.7) | 2396 (15.9) | 3498 (15.7) |
| 5° (i più indigenti) | 1023 (9.2) | 1466 (9.7) | 2217 (10.0) |
| Mancanza | 304 (2.7) | 372 (2.5) | 590 (2.7) |
| Fumatore corrente* | 1070 (9.6) | 1279 (8.5) | 3244 (14.6) |
| Stato del bere: | |||
| Non bevitore | 2160 (19.4) | 3287 (21.8) | 4177 (18.8) |
| Bevitore | 7541 (67.6) | 10123 (67.2) | 14711 (66.1) |
| Bevitore eccessivo | 511 (4.6) | 597 (4.0) | 609 (2.7) |
| Mancanza | 947 (8.5) | 1052 (7.0) | 2769 (12.4) |
| IMC (kg/m2): | |||
| <25 | 3459 (31.0) | 4316 (28.7) | 7498 (33.7) |
| 25-30 | 3855 (34.6) | 5294 (35.2) | 7572 (34.0) |
| >30 | 2874 (25.8) | 4414 (29.3) | 4349 (19.5) |
| Mancanza | 971 (8.7) | 1035 (6.9) | 2847 (12.8) |
| Indice di comorbilità di Charlson: | |||
| 0 | 5052 (45.3) | 5173 (34.4) | 12446 (55.9) |
| 1 | 2606 (23.4) | 3757 (25.0) | 4782 (21.5) |
| 2 | 1767 (15.8) | 2887 (19.2) | 2860 (12.8) |
| 3 | 909 (8.2) | 1655 (11.0) | 1196 (5.4) |
| ≥4 | 825 (7.4) | 1587 (10.5) | 982 (4.4) |
| Ipertensione | 5392 (48.3) | 8535 (56.7) | 8155 (36.6) |
| Diabete | 1374 (12.3) | 2740 (18.2) | 2315 (10.4) |
| Insufficienza cardiaca | 1016 (9.1) | 2877 (19.1) | 437 (2.0) |
| Malattia cardiaca ischemica | 2199 (19.7) | 4346 (28.9) | 2559 (11.5) |
| categoria eGFR (ml/min/1,73m2): | |||
| >90 | 1831 (16.4) | 1902 (12.6) | 3077 (13.8) |
| 60-90 | 5707 (51.1) | 7874 (52.3) | 10 323 (46.4) |
| 30-59 | 2315 (20.8) | 4245 (28.2) | 3323 (14.9) |
| <30 | 175 (1.6) | 341 (2.3) | 205 (0.9) |
| Mancanza | 1131 (10.1) | 697 (4.6) | 5338 (24.0) |
| Prescrizione statinica attuale | 3933 (35.3) | 7066 (46.9) | 5896 (26.5) |
| Attuale prescrizione di anticoagulanti | 926 (8.3) | 8090 (53.7) | 248 (1.1) |
Il tasso di incidenza dell’ictus grezzo o TIA era di 12,1 e 16,7 per 1000 anni a persona in pazienti con fibrillazione atriale risolta e non risolta, rispettivamente; il periodo di follow-up mediano era di 2,9 (intervallo interquartile 1,4-5,7) anni (3,5 (1,7-6).5) anni nei pazienti con fibrillazione atriale risolta e 2,7 (1,2-5,1) anni nei pazienti con fibrillazione atriale; il follow-up leggermente più breve in questi ultimi pazienti potrebbe essere spiegato dalla maggiore mortalità e da altri tassi di eventi censuranti (es. ictus o TIA) in questi pazienti). Il rapporto del tasso di incidenza grezzo è stato di 0,73 (intervallo di confidenza del 95% da 0,65 a 0,81, P<0,001). L’adeguamento per i potenziali confonditori (età, sesso, privazione Townsend quinto, IMC, stato del fumo, consumo di alcol, categoria indice di comorbidità Charlson, prescrizione di statina corrente, prescrizione di anticoagulanti corrente) ha fatto poca differenza per il rapporto del tasso di incidenza: 0,76 (intervallo di confidenza del 95% da 0,67 a 0,85, P<0,001). La figura 2 mostra il pericolo cumulativo. Nell’analisi di sensibilità, le covariate nel modello adattato sono state leggermente modificate; ciò ha fatto poca differenza per i risultati(tabella 2).
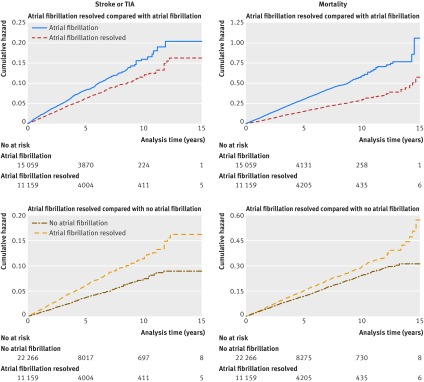
Fig. 2.Stime di rischio cumulativo non corrette di Nelson-Aalen per ictus o attacco ischemico transitorio (TIA) in pazienti con fibrillazione atriale risolta rispetto alla fibrillazione atriale non risolta; mortalità in pazienti con fibrillazione atriale risolta rispetto alla fibrillazione atriale non risolta; ictus o TIA in pazienti con fibrillazione atriale risolta rispetto alla fibrillazione atriale non risolta; mortalità in pazienti con fibrillazione atriale risolta rispetto alla fibrillazione atriale non risolta (vedere la figura 1 supplementare per le stime di rischio cumulativo corretto).
| Variabili | AF risolta contro AF | AF risolta contro AF non risolta | |||
|---|---|---|---|---|---|
| Esposto (n=11-159) | Controllo (n=15-059) | Esposto (n=11-159) | Controllo (n=22-266) | ||
| Ictus o TIA (esito primario) | |||||
| Risultati | 568 (5.1) | 852 (5.7) | 568 (5.1) | 683 (3.1) | |
| Anni persona | 46 823.02 | 51 113.68 | 46 823.02 | 92 774.54 | |
| Tasso di incidenza del greggio* | 12.1 | 16.7 | 12.1 | 7.4 | |
| IRR (95% CI), valore P: | |||||
| Crude | 0,73 (da 0,65 a 0,81), <0,001 | 1,65 (da 1,47 a 1,84), <0,001 | |||
| Adattato: modello 1 | 0,76 (da 0,67 a 0,85), <0,001 | 1,63 (da 1,46 a 1,83), <0,001 | |||
| Adattato: modello 2 | 0,76 (da 0,67 a 0,86), <0,001 | 1,60 (da 1,43 a 1,80), <0,001 | |||
| Adattato: modello 3 | 0,83 (da 0,74 a 0,93), 0,001 | 1,59 (da 1,41 a 1,80), <0,001 | |||
| Mortalità (esito secondario) | |||||
| Risultati | 1448 (13.0) | 3207 (21.3) | 1448 (13.0) | 2309 (10.4) | |
| Anni della persona | 48 214.51 | 53 203.11 | 48 214.51 | 94 561.84 | |
| Tasso di incidenza del greggio* | 30.0 | 60.3 | 30.0 | 24.4 | |
| IRR (95% CI), valore P†: | |||||
| ■Crude | 0,50 (da 0,47 a 0,53), <0,001 | 1,23 (1,15 a 1,31), <0,001 | |||
| Adattato: modello 1 | 0,60 (da 0,56 a 0,65), <0,001 | 1,13 (1,06 a 1,21), <0,001 | |||
| Adattato: modello 2 | 0,62 (da 0,58 a 0,67), <0,001 | 1,11 (1,03 a 1,19), 0,004 | |||
| Adattato: modello 3 | 0,64 (da 0,60 a 0,68), <0,001 | 1,09 (da 1,01 a 1,17), 0,019 | |||
Il tasso di mortalità grezza è stato di 30,0 per 1000 anni a persona nei pazienti con fibrillazione atriale risolta e di 60,3 per 1000 anni a persona nei pazienti con fibrillazione atriale non risolta; il follow-up mediano è stato di 3,1 (1,5-5,9) anni (3,7 (1,8-6,6) nei pazienti con fibrillazione atriale risolta e di 2,8 (1,3-5,4) anni nei pazienti con fibrillazione atriale). I tassi di incidenza grezzi e corretti sono stati rispettivamente di 0,50 (intervallo di confidenza del 95% da 0,47 a 0,53, P<0,001) e 0,60 (da 0,56 a 0,65, P<0,001) (tabella2, fig. 2) .
In un’ulteriore analisi di sensibilità, come data indice è stata utilizzata la data della fibrillazione atriale risolta (piuttosto che la data della fibrillazione atriale risolta più 180 giorni); ciò ha fatto poca differenza rispetto ai rapporti di incidenza: ictus o TIA grezzo stima 0.75 (intervallo di confidenza del 95% da 0,68 a 0,83, P<0,001), stima corretta 0,80 (0,72 a 0,89, P<0,001); stima grezza della mortalità 0,50 (0,47 a 0,53, P<0,001), stima corretta 0,61 (0,58 a 0,65, P<0,001) (vedi tabella supplementare 1).

Fig. 2.Stime di rischio cumulative non corrette di Nelson-Aalen per ictus o attacco ischemico transitorio (TIA) in pazienti con fibrillazione atriale risolta rispetto alla fibrillazione atriale non risolta; mortalità in pazienti con fibrillazione atriale risolta rispetto alla fibrillazione atriale non risolta; ictus o TIA in pazienti con fibrillazione atriale risolta rispetto a nessuna fibrillazione atriale; mortalità in pazienti con fibrillazione atriale risolta rispetto a nessuna fibrillazione atriale (vedere la figura 1 supplementare per le stime di rischio cumulative corrette)
Fibrillazione atriale risolta rispetto a nessuna fibrillazione atriale
In totale sono stati inclusi nell’analisi 33-425 pazienti: 11-159 pazienti con fibrillazione atriale risolta e 22-26 controlli senza alcuna registrazione di fibrillazione atriale. Le caratteristiche demografiche e lo stile di vita erano simili tra i due gruppi, anche se i fumatori erano meno numerosi tra i pazienti con fibrillazione atriale risolta: 9,6% (1070/11159) rispetto al 14,6% (3244/22266) del gruppo di controllo. I pazienti con fibrillazione atriale risolta avevano più comorbidità, e più aveva una prescrizione corrente per una statina o anticoagulante.
Il tasso di incidenza del colpo grezzo o TIA era 12,1 e 7,4 per 1000 anni di persona in pazienti con fibrillazione atriale risolta e nessuna fibrillazione atriale, rispettivamente; il follow-up mediano era 3,5 (intervallo interquartile 1,7-6,5) anni (intervallo mediano e interquartile erano gli stessi in entrambi i gruppi di pazienti). Il rapporto del tasso di incidenza grezzo era 1,65 (intervallo di confidenza del 95% 1,47 a 1,84, P<0,001) e il rapporto del tasso di incidenza corretto era 1,63 (1,46 a 1,83, P<0,001). La figura 2 mostra il pericolo cumulativo. La modifica delle covariate nel modello rettificato nell’analisi di sensibilità ha fatto poca differenza nei risultati(tabella 2).
Il tasso di mortalità grezza è stato di 30,0 per 1000 anni per persona in pazienti con fibrillazione atriale risolta e di 24,4 per 1000 anni per persona in pazienti senza fibrillazione atriale; il follow-up mediano è stato di 3,6 (intervallo interquartile 1,7-6,6) anni (3,7 (1,8-6,6) anni in pazienti con fibrillazione atriale risolta e 3,6 (1,7-6,6) anni in pazienti senza fibrillazione atriale). I rapporti di incidenza grezzi e corretti sono stati rispettivamente 1,23 (intervallo di confidenza del 95% da 1,15 a 1,31, P<0,001) e 1,13 (da 1,06 a 1,21, P<0,001) (tabella2, fig. 2) .
L’utilizzo della data per la fibrillazione atriale risolta come data indice nell’analisi di sensibilità ha fatto poca differenza rispetto al rapporto del tasso di incidenza della mortalità, ma il rapporto del tasso di incidenza per l’ictus o il TIA è aumentato: il rapporto del tasso di incidenza del greggio 1,82 (intervallo di confidenza 1 di 95%.64 a 2,02, P<0,001) e rapporto di tasso di incidenza aggiustato 1,82 (1,62 a 2,03, P<0,001); rapporto di tasso di incidenza del tasso di mortalità grezzo 1,22 (1,15 a 1,30, P<0,001) e rapporto di tasso di incidenza aggiustato 1,14 (1,07 a 1,22, P<0,001) (vedi tabella supplementare 1).
Analisi dei sottogruppi
Complessivamente, il 22,8% (2539/11-159) dei pazienti con fibrillazione atriale risolta ha avuto un successivo record di fibrillazione atriale ricorrente. L’incidenza della fibrillazione atriale ricorrente è stata di 63,6 per 1000 anni a persona.
L’incidenza di ictus o TIA in pazienti con fibrillazione atriale risolta con un record di fibrillazione atriale ricorrente era 16,0 per 1000 anni a persona rispetto a 10,5 per 1000 anni a persona in pazienti senza record di fibrillazione atriale ricorrente. Rispetto ai pazienti senza fibrillazione atriale, i rapporti di incidenza grezzi e corretti per l’ictus o il TIA sono stati 2,04 (intervallo di confidenza del 95% da 1,69 a 2,47, P<0,001) e 2,05 (da 1,69 a 2,50, P<0.001), rispettivamente per i pazienti con fibrillazione atriale risolta e un record di fibrillazione atriale ricorrente, e 1,46 (1,27 a 1,68, P<0,001) e 1,45 (1,26 a 1,67, P<0,001), rispettivamente, per i pazienti con fibrillazione atriale risolta e nessun record di fibrillazione atriale ricorrente (tabella3).
| Variabili | AF risolto con AF ricorrente contro AF non risolto | AF risolto senza AF ricorrente contro nessun AF | |||
|---|---|---|---|---|---|
| Esposto (n=2539) | Controllo (n=5068) | Esposto (n=8620) | Controllo (n=17-198) | ||
| Ictus o TIA (esito primario) | |||||
| Risultati | 225 (8.9) | 205 (4.0) | 343 (4.0) | 478 (2.8) | |
| Anni persona | 14 043.82 | 26 130.03 | 32 779.21 | 66 644.51 | |
| Tasso di incidenza del greggio* | 16.0 | 7.8 | 10.5 | 7.2 | |
| IRR (95% CI), valore P: | |||||
| Crude | 2,04 (da 1,69 a 2,47), <0,001 | 1,46 (1,27 a 1,68), <0,001 | |||
| Adattato: modello 1 | 2,05 (da 1,69 a 2,50), <0,001 | 1,45 (da 1,26 a 1,67), <0,001 | |||
| Adattato: modello 2 | 2,01 (da 1,64 a 2,45), <0,001 | 1,42 (da 1,23 a 1,64), <0,001 | |||
| Adattato: modello 3 | 2,01 (da 1,62 a 2,50), <0,001 | 1,43 (1,23 a 1,66), <0,001 | |||
| Mortalità (esito secondario) | |||||
| Risultati | 277 (10.9) | 591 (11.7) | 1171 (13.6) | 1718 (10.0) | |
| Anni persona | 14 684.55 | 26 740.34 | 33 529.96 | 67 821.5 | |
| Tasso di incidenza del greggio* | 18.8 | 22.1 | 34.9 | 25.3 | |
| IRR (95% CI), valore P†: | |||||
| ■Crude | 0,85 (0,74 a 0,98), 0,03 | 1,38 (da 1,28 a 1,48), <0,001 | |||
| Adattato: modello 1 | 0,77 (da 0,67 a 0,90), 0,001 | 1,26 (da 1,17 a 1,36), <0,001 | |||
| Adattato: modello 2 | 0,76 (da 0,65 a 0,89), <0,001 | 1,23 (1,14 a 1,33), <0,001 | |||
| Adattato: modello 3 | 0,75 (da 0,63 a 0,88), 0,001 | 1,21 (1,11 a 1,31), <0,001 | |||
Tra i pazienti codificati come affetti da fibrillazione atriale risolta, il 18,8% (2095/11-159) aveva ricevuto una diagnosi di fibrillazione atriale parossistica prima della risoluzione della fibrillazione atriale (il più recente codice diagnostico della fibrillazione atriale prima della risoluzione della fibrillazione atriale). L’incidenza di ictus o TIA dopo che la fibrillazione atriale codificata risolta non era statisticamente significativamente diversa tra i pazienti precedentemente codificati come affetti da fibrillazione atriale parossistica e quelli codificati come affetti da altri tipi di fibrillazione atriale prima della diagnosi di fibrillazione atriale risolta: rapporto di incidenza corretto 1,17 (intervallo di confidenza del 95% da 0,95 a 1,45). Il gruppo di riferimento comprendeva tutti i pazienti con fibrillazione atriale risolta senza un precedente codice di fibrillazione atriale parossistica.
Un record recente di ablazione è stato documentato nell’1,2% (131/11-159) dei pazienti con fibrillazione atriale risolta. L’incidenza di ictus o TIA dopo una fibrillazione atriale codificata risolta non era statisticamente significativamente diversa nei pazienti con un recente record di ablazione rispetto a quelli senza: rapporto di incidenza regolato 0,68 (intervallo di confidenza del 95% da 0,22 a 2,14). Il numero di eventi di esito in coloro che hanno avuto un record di ablazione era, tuttavia, piccolo (n = 3). Il gruppo di riferimento comprendeva tutti i pazienti con fibrillazione atriale codificata risolta senza una recente registrazione di ablazione.
Trattamento anticoagulante
In totale, il 17,4% (intervallo di confidenza del 95% dal 16,7% al 18,1%; 1943/11-159) dei pazienti con fibrillazione atriale codificata risolta aveva una prescrizione attuale di anticoagulante al momento della diagnosi di fibrillazione atriale risolta. Complessivamente, al 9,6% (9,1%-10,2%; 1071/11-159) sono stati prescritti anticoagulanti fino a 90 giorni dopo la data di risoluzione della fibrillazione atriale, e l’8,2% (7,7%-8,8%; 950/11-159) ha avuto una prescrizione da 91 a 180 giorni dopo la data di risoluzione della fibrillazione atriale. Dei 1943 (17,4%) pazienti con prescrizione attuale di anticoagulante al momento della diagnosi di fibrillazione atriale risolta, il 44,9% (42,7% a 47,1%; 872/1943) riceveva ancora un trattamento anticoagulante fino a 90 giorni dopo, e il 32,9% (30,8% a 35,0%; 639/1943) riceveva ancora un trattamento fino a 180 giorni dopo.
La percentuale di pazienti codificati come fibrillazione atriale risolta con un record attuale di prescrizione di un anticoagulante alla data dell’indice (fino a 90 giorni prima dell’indice, equivalente a 90-180 giorni dopo il record di fibrillazione atriale risolta) era dell’8,3% (926/11-159). L’incidenza grezza di ictus o TIA nei pazienti con fibrillazione atriale risolta e una prescrizione attuale per un anticoagulante era di 11,4 per 1000 anni a persona, rispetto a 12,2 per 1000 anni a persona nei pazienti senza. L’incidenza corretta dell’ictus o del TIA era del 14% più bassa nei pazienti con una prescrizione attuale per un anticoagulante rispetto a quelli senza, ma questo risultato non era statisticamente significativo: il rapporto del tasso di incidenza corretto è stato di 0,86 (intervallo di confidenza del 95% da 0,62 a 1,18).
Tendenze temporali
È stata effettuata un’analisi temporale dividendo i set di dati in quattro gruppi di pari dimensioni per data dell’indice (date di inizio nel 2000, 2007, 2010 e 2013). L’incidenza grezza dell’ictus o TIA nei pazienti con fibrillazione atriale risolta è aumentata nei quattro dataset temporali: 10,2, 12,3, 13,8 e 18,5 per 1000 anni a persona nel 2000, 2007, 2010 e 2013, rispettivamente. Nei pazienti con e senza fibrillazione atriale, l’incidenza dell’ictus o TIA è stata più costante: tasso di incidenza per i pazienti con fibrillazione atriale 17,9, 15,4, 16,5 e 16,6 per 1000 anni a persona nel 2000, 2007, 2010 e 2013, rispettivamente; tasso di incidenza per i pazienti senza fibrillazione atriale 7,3, 7,2, 6,8 e 9,4 per 1000 anni a persona nel 2000, 2007, 2010 e 2013, rispettivamente. I tassi di incidenza corretti per i pazienti con fibrillazione atriale risolta rispetto a quelli con fibrillazione atriale in questi quattro gruppi temporali sono stati di 0,67 (intervallo di confidenza del 95% da 0,55 a 0,81), 0,81 (0,65 a 1,00), 0,79 (0,61 a 1,02) e 0,96 (0,67 a 1,39). I tassi di incidenza corretti per la fibrillazione atriale risolta rispetto all’assenza di fibrillazione atriale in questi quattro gruppi sono stati rispettivamente 1,32 (1,09 a 1,60), 1,75 (1,43 a 2,15), 1,94 (1,50 a 2,50) e 1,98 (1,43 a 2,74).
Esclusione di pazienti ineguagliati con fibrillazione atriale risolta
Dove disponibile, ogni paziente con fibrillazione atriale risolta è stato abbinato a due controlli della stessa età, sesso e medicina generale. Tuttavia, i controlli abbinati non erano disponibili per ogni paziente. Questo non era un problema importante nel dataset dei pazienti con fibrillazione atriale risolta rispetto a quelli senza fibrillazione atriale, in cui 13 (su 11-159) pazienti con fibrillazione atriale risolta erano ineguagliati. L’indisponibilità di una corrispondenza potrebbe essere correlata all’età più avanzata di questi 13 pazienti (91-104 anni).
Nel set di dati dei pazienti con fibrillazione atriale risolta rispetto a quelli con fibrillazione atriale risolta, tuttavia, 2743 pazienti con fibrillazione atriale risolta erano ineguagliati. Ciò è dovuto al pool relativamente più piccolo di pazienti con fibrillazione atriale da cui è stato possibile selezionare i controlli, soprattutto negli studi più piccoli. L’età mediana dei pazienti senza un match era di 52,4 (range interquartile 43,8-62,1) anni, mentre l’età mediana dei pazienti con uno o due match era di 74,0 (65,8-80,8) anni, il che spiega la differenza di età osservata nelle caratteristiche di base. L’età è stata inclusa come covariata nelle analisi corrette.
È stata effettuata un’analisi di sensibilità escludendo i pazienti con fibrillazione atriale risolta senza controlli adeguati. Ciò non ha fatto alcuna differenza per i risultati: nei pazienti con fibrillazione atriale risolta rispetto a quelli con fibrillazione atriale, i rapporti del tasso di incidenza rettificato per ictus o TIA e morte erano rispettivamente 0,80 (intervallo di confidenza del 95% da 0,71 a 0,91) e 0,60 (da 0,56 a 0,65); nei pazienti con fibrillazione atriale risolta rispetto a quelli senza fibrillazione atriale, i valori corrispondenti erano 1,64 (da 1,46 a 1,83) e 1,13 (da 1,06 a 1,21).
Discussione
Il codice clinico “Fibrillazione atriale risolta” è ampiamente utilizzato nella medicina generale, con oltre il 10% dei pazienti con fibrillazione atriale nel Regno Unito che attualmente hanno una qualsiasi registrazione del codice. Tra il 2000 e il 2013, l’uso del codice è aumentato considerevolmente; la prevalenza di un record di fibrillazione atriale risolta è aumentata insieme all’aumento della prevalenza della fibrillazione atriale registrata nel Regno Unito nello stesso periodo.2526Si è verificato un forte aumento della percentuale di pazienti codificati come fibrillazione atriale risolta nel 2006/07. Ciò coincide con l’introduzione della fibrillazione atriale nel Quality and Outcomes Framework (2006), quando sarà stato nell’interesse delle pratiche generali rivedere la diagnosi nei pazienti iscritti nel registro della fibrillazione atriale, in particolare quelli che non stavano ricevendo un trattamento antitrombotico, ad esempio ricodificando tali pazienti come se la fibrillazione atriale si fosse risolta laddove ritenuto opportuno. Negli ultimi anni si è verificato un leggero calo, ma una parte sostanziale dei pazienti con fibrillazione atriale continua ad essere classificata come affetta da fibrillazione atriale.
Nei pazienti con diagnosi di fibrillazione atriale risolta i tassi di ictus o TIA sono inferiori rispetto ai pazienti con fibrillazione atriale non risolta, ma sono superiori del 60% rispetto ai pazienti senza storia di fibrillazione atriale. Anche quando i pazienti con una successiva registrazione di fibrillazione atriale ricorrente sono stati esclusi dall’analisi, i tassi di ictus o TIA sono stati superiori del 45% nei pazienti con fibrillazione atriale risolta rispetto a quelli senza storia di fibrillazione atriale. I tassi di mortalità erano circa il 10% in più nei pazienti con fibrillazione atriale risolta rispetto a quelli senza fibrillazione atriale.
Tassi di incidenza più bassi di ictus o TIA nei pazienti con un codice risolto di fibrillazione atriale rispetto ai pazienti con fibrillazione atriale potrebbero riflettere la natura eterogenea di questo gruppo. Alcuni possono non avere più fibrillazione atriale e sono tornati permanentemente al ritmo sinusale, altri possono essere stati erroneamente diagnosticati come affetti da fibrillazione atriale e successivamente trovati non affetti da fibrillazione atriale, e alcuni possono avere una fibrillazione atriale più intermittente o episodica come il sottotipo parossistico. Alcune evidenze suggeriscono che il rischio di ictus è più basso nei pazienti con fibrillazione atriale parossistica rispetto a quelli con fibrillazione atriale persistente o permanente,2728sebbene il rischio rimanga aumentato rispetto ai pazienti senza fibrillazione atriale. Tuttavia, è evidente che, come gruppo, i pazienti codificati come aventi risolto la fibrillazione atriale rimangono ad un rischio statisticamente significativamente aumentato di ictus o TIA.
Inoltre, i tassi di ictus o TIA nei pazienti con fibrillazione atriale risolta sono aumentati nel tempo. Questo potrebbe essere collegato alla crescente prevalenza di questo codice nelle cartelle cliniche dei pazienti, indicando forse che il suo uso è stato esteso nel tempo per includere un numero maggiore di pazienti con fibrillazione atriale silenziosa, intermittente o ricorrente. Dal 2007, non c’è stata alcuna differenza statisticamente significativa tra i tassi di ictus o TIA nei pazienti codificati come fibrillazione atriale risolta e quelli con fibrillazione atriale. Dal 2010, i tassi di ictus o TIA nei pazienti con fibrillazione atriale risolta sono stati il doppio di quelli dei pazienti senza storia di fibrillazione atriale.
È quindi probabile che i pazienti con fibrillazione atriale risolta beneficino di una profilassi anticoagulante continua. Questa analisi, tuttavia, mostra che solo una percentuale relativamente piccola di tali pazienti continua il trattamento anticoagulante dopo la diagnosi: nel 2016, le percentuali di trattamento erano inferiori dell’80% nei pazienti con diagnosi di fibrillazione atriale risolta rispetto ai pazienti con fibrillazione atriale non risolta.
Confronto con la letteratura esistente e raccomandazioni
Il rapporto del tasso di incidenza grezzo osservato per l’ictus o TIA nei pazienti con fibrillazione atriale rispetto a quelli senza fibrillazione atriale è stato di 2,3 (intervallo di confidenza del 95% da 2,0 a 2,5) (anche se va notato che entrambi i gruppi sono stati abbinati al gruppo di esposizione, la fibrillazione atriale risolta, piuttosto che l’uno all’altro). Questo è simile ai tassi relativi osservati in altri set di dati di assistenza primaria raccolti di routine, in cui a molti pazienti affetti da fibrillazione atriale vengono prescritti farmaci anticoagulanti in conformità alle linee guida cliniche.29
30
Mentre un’ablazione riuscita in pazienti con fibrillazione atriale potrebbe portare al ripristino del normale ritmo cardiaco a breve termine, le evidenze di studi con follow-up a lungo termine suggeriscono che la fibrillazione atriale può ripresentarsi in un massimo dell’80% dei pazienti.111213Diversi studi hanno studiato i risultati a lungo termine in pazienti che hanno subito un’ablazione, con risultati che indicano una riduzione del rischio di ictus nei pazienti con fibrillazione atriale che hanno subito un’ablazione rispetto a quelli che non l’hannosubita31 e rispetto a quelli che hanno subito una cardioversione.32 Pochi, tuttavia, hanno confrontato i tassi di ictus con quelli dei pazienti senza anamnesi di fibrillazione atriale; un’eccezione è costituita da uno studio di coorte negli Stati Uniti, che ha rilevato che i tassi di ictus nei pazienti con fibrillazione atriale sottoposti ad ablazione erano simili a quelli dei pazienti senza anamnesi di fibrillazione atriale, sebbene non fossero disponibili dati che indicassero se ai pazienti fossero stati prescritti o meno anticoagulanti.33 Uno studio che utilizzava dati internazionali, che includeva pazienti con fibrillazione atriale e con un rischio da moderato ad alto di ictus e che assumevano warfarin o rivaroxaban, non ha trovato alcuna differenza tra i tassi di ictus prima e dopo la cardioversione o l’ablazione; tuttavia, la popolazione dello studio e il numero di eventi di esito erano piccoli.34
L’ablazione può essere uno dei vari motivi per classificare la fibrillazione atriale come risolta; nel nostro set di dati, solo l’1,2% dei pazienti con fibrillazione atriale risolta ha avuto un record recente di ablazione. Non sono stati identificati studi che indagano la prognosi dei pazienti con fibrillazione atriale risolta in modo più ampio.
Questa mancanza di prove potrebbe spiegare la limitata guida offerta nel Regno Unito e le linee guida internazionali riguardanti il trattamento dei pazienti con fibrillazione atriale risolta, essendo questa limitata a brevi note sui pazienti che hanno subito un’ablazione; le osservazioni che generalmente sono in conflitto con il fatto che i pazienti codificati come “fibrillazione atriale risolta” sono esplicitamente esclusi dai registri della fibrillazione atriale in Inghilterra.2141516Alla luce delle evidenze prodotte da questo studio, si raccomanda di aggiornare le linee guida cliniche e gli schemi progettati per incentivare una gestione appropriata dei pazienti con fibrillazione atriale per promuovere la continuazione della profilassi anticoagulante nei pazienti con fibrillazione atriale risolta, o, in alternativa, di deprecare l’uso continuato di questa speciosa categorizzazione.
Punti di forza e limiti di questo studio
L’analisi ha utilizzato un ampio database di medicina generale che è generalizzabile per la popolazione del Regno Unito e comprende dati clinici di routine utilizzati nel processo decisionale dei medici di medicina generale.
L’uso e l’interpretazione del codice clinico della fibrillazione atriale risolta variano probabilmente a seconda dei medici e degli studi medici; il gruppo di pazienti con fibrillazione atriale risolta che ne risulta sarà quindi eterogeneo. Tuttavia, il codice ha un’importante rilevanza clinica in quanto elimina la necessità di includere questi pazienti nel registro dei pazienti con fibrillazione atriale, e quindi elimina l’obbligo di garantire sistematicamente la prescrizione di anticoagulanti. La registrazione codificata delle condizioni mediche può essere incompleta; tuttavia, la fibrillazione atriale e l’ictus, insieme a comorbidità come il diabete e l’ipertensione, che fanno parte del Quality and Outcomes Framework, sono probabilmente ben registrati nei periodi in cui questo è stato incentivato. L’etnia è scarsamente registrata nella pratica generale, sebbene sia migliorata negli ultimi anni, e quindi non è stato possibile includere il gruppo etnico come covariata. I punteggi di Townsend si basano sul codice postale e possono non rappresentare accuratamente le privazioni a livello individuale, ma dovrebbero essere ampiamente rappresentativi tra le popolazioni studiate.
Alcuni pazienti che ricevono anticoagulanti potrebbero non essere stati identificati se il trattamento è stato gestito interamente in cure secondarie, portando alla possibilità di sottostimare i tassi di trattamento; tuttavia, la maggior parte degli anticoagulanti sono prescritti in cure primarie e qualsiasi sottostima è quindi probabilmente piccola. La banca dati fornisce informazioni solo sulle prescrizioni emesse; non è possibile accertare se le prescrizioni sono state raccolte, né il grado di conformità dei farmaci.
Il divario di età tra i pazienti con fibrillazione atriale risolta e i controlli abbinati alla fibrillazione atriale era di 4,5 anni. Ciò è dovuto al numero relativamente piccolo di pazienti con fibrillazione atriale da cui è stato possibile selezionare i controlli, in particolare nelle piccole pratiche. L’età è stata, tuttavia, regolata per l’analisi. Inoltre, i risultati sono stati robusti per le analisi di sensibilità in cui sono stati esclusi i pazienti ineguagliati.
Nell’analisi dell’ictus o TIA, i pazienti deceduti sono stati censurati alla data del decesso; la morte è quindi un rischio concorrente. Questo potrebbe portare a tassi grezzi leggermente gonfiati per l’ictus o il TIA. La regressione di Poisson presuppone un rischio di base costante; tuttavia, i risultati non sono stati diversi quando abbiamo effettuato un’analisi di sensibilità utilizzando la regressione di Cox, che non fa questa supposizione.
Conclusioni
I pazienti con diagnosi di fibrillazione atriale risolta sono aumentati in proporzione ai pazienti con fibrillazione atriale. Essi rimangono ad un rischio maggiore del 60% di ictus o TIA rispetto ai pazienti senza fibrillazione atriale. Questi pazienti trarrebbero beneficio da una continua profilassi anticoagulante, ma le percentuali di trattamento in questo gruppo sono estremamente basse. Si raccomanda di aggiornare le linee guida nazionali e internazionali per sostenere l’uso continuo del trattamento anticoagulante nei pazienti con fibrillazione atriale risolta.
Ciò che è già noto su questo argomento
- La fibrillazione atriale può ripresentarsi dopo una risoluzione apparente, e i pazienti con fibrillazione atriale “risolta” potrebbero quindi continuare ad essere a maggior rischio di ictus o di attacco ischemico transitorio (TIA)
- Il rischio di ictus in corso nei pazienti con fibrillazione atriale risolta non è noto, tuttavia, e non esiste una chiara guida clinica su come tali pazienti debbano essere trattati
Cosa aggiunge questo studio
- Nel Regno Unito, nel 2016, il 10,5% dei pazienti con fibrillazione atriale ha successivamente registrato un record di fibrillazione atriale risolta.
- Nel 2013-16, i pazienti con una diagnosi di fibrillazione atriale risolta erano a rischio di ictus o TIA simile ai pazienti con fibrillazione atriale in corso
- I pazienti con fibrillazione atriale risolta hanno un quinto di probabilità di ricevere anticoagulanti come quelli con fibrillazione atriale in corso
References
- The National Collaborating Centre for Chronic Conditions. Atrial Fibrillation. National clinical guideline for management in primary and secondary care.. Royal College of Physicians; 2006.
- National Clinical Guideline Centre. Atrial fibrillation: the management of atrial fibrillation. Clinical guideline: Methods, evidence and recommendations. London.. National Institute for Health and Care Excellence; 2014.
- Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke. 1991; 22:983-8. DOI | PubMed
- Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002; 324:71-86. DOI | PubMed
- Aguilar MI, Hart R. Oral anticoagulants for preventing stroke in patients with non-valvular atrial fibrillation and no previous history of stroke or transient ischemic attacks. Cochrane Database Syst Rev. 2005; 3:CD001927. DOI | PubMed
- Aguilar MI, Hart R, Pearce LA. Oral anticoagulants versus antiplatelet therapy for preventing stroke in patients with non-valvular atrial fibrillation and no history of stroke or transient ischemic attacks. Cochrane Database Syst Rev. 2007; 3:CD006186. DOI | PubMed
- Fuster V, Rydén LE, Cannom DS, American College of Cardiology Foundation/American Heart Association Task Force. 2011 ACCF/AHA/HRS focused updates incorporated into the ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation. 2011; 123:e269-367. DOI | PubMed
- Zimetbaum P. Antiarrhythmic drug therapy for atrial fibrillation. Circulation. 2012; 125:381-9. DOI | PubMed
- National Institute for Health and Clinical Excellence. Atrial fibrillation. The management of atrial fibrillation. NICE Clinical Guideline 36.. National Institute for Health and Clinical Excellence; 2006.
- National Institute for Health and Care Excellence. Atrial fibrillation: the management of atrial fibrillation. NICE clinical guideline 180.. National Institute for Health and Care Excellence; 2014.
- Chao TF, Lin YJ, Chang SL. Can oral anticoagulants be stopped safely after a successful atrial fibrillation ablation?. J Thorac Dis. 2015; 7:172-7. DOI | PubMed
- Chao TF, Tsao HM, Lin YJ. Clinical outcome of catheter ablation in patients with nonparoxysmal atrial fibrillation: results of 3-year follow-up. Circ Arrhythm Electrophysiol. 2012; 5:514-20. DOI | PubMed
- Tilz RR, Rillig A, Thum AM. Catheter ablation of long-standing persistent atrial fibrillation: 5-year outcomes of the Hamburg Sequential Ablation Strategy. J Am Coll Cardiol. 2012; 60:1921-9. DOI | PubMed
- General Practitioners Committee, NHS Employers and NHS England. 2016/17 General Medical Services (GMS) contract Quality and Outcomes Framework (QOF) Guidance for GMS contract 2016/17 London: NHS Employers 2016.
- Camm AJ, Lip GYH, De Caterina R, ESC Committee for Practice Guidelines (CPG). 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J. 2012; 33:2719-47. DOI | PubMed
- Kirchhof P, Benussi S, Kotecha D, ESC Scientific Document Group. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016; 37:2893-962. DOI | PubMed
- Verma A, Cairns JA, Mitchell LB, CCS Atrial Fibrillation Guidelines Committee. 2014 focused update of the Canadian Cardiovascular Society Guidelines for the management of atrial fibrillation. Can J Cardiol. 2014; 30:1114-30. PubMed
- January CT, Wann LS, Alpert JS, American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2014; 64:e1-76. DOI | PubMed
- Maguire A, Blak BT, Thompson M. The importance of defining periods of complete mortality reporting for research using automated data from primary care. Pharmacoepidemiol Drug Saf. 2009; 18:76-83. PubMed
- Cowan C, Healicon R, Robson I. The use of anticoagulants in the management of atrial fibrillation among general practices in England. Heart. 2013; 99:1166-72. DOI | PubMed
- Adderley N, Ryan R, Marshall T. The role of contraindications in prescribing anticoagulants to patients with atrial fibrillation: a cross-sectional analysis of primary care data in the UK. Br J Gen Pract. 2017; 67:e588-97. PubMed
- Isaew A, Adderley NJ, Ryan R, Fitzmaurice D, Marshall T. The treatment of paroxysmal atrial fibrillation in UK primary care. Heart. 2017; 103:1502-7. DOI | PubMed
- NHS England. New GMS Contract QOF Implementation. Dataset and Business Rules. Atrial Fibrillation Indicator Set.. Health and Social Care Information Centre; 2016.
- Marston L, Carpenter JR, Walters KR. Smoker, ex-smoker or non-smoker? The validity of routinely recorded smoking status in UK primary care: a cross-sectional study. BMJ Open. 2014; 4:e004958. DOI | PubMed
- DeWilde S, Carey IM, Emmas C, Richards N, Cook DG. Trends in the prevalence of diagnosed atrial fibrillation, its treatment with anticoagulation and predictors of such treatment in UK primary care. Heart. 2006; 92:1064-70. DOI | PubMed
- Lane DA, Skjøth F, Lip GYH, Larsen TB, Kotecha D. Temporal Trends in Incidence, Prevalence, and Mortality of Atrial Fibrillation in Primary Care. J Am Heart Assoc. 2017; 6:e005155. DOI | PubMed
- Vanassche T, Lauw MN, Eikelboom JW. Risk of ischaemic stroke according to pattern of atrial fibrillation: analysis of 6563 aspirin-treated patients in ACTIVE-A and AVERROES. Eur Heart J. 2015; 36:281-7a. DOI | PubMed
- Link MS, Giugliano RP, Ruff CT, ENGAGE AF-TIMI 48 Investigators. Stroke and Mortality Risk in Patients With Various Patterns of Atrial Fibrillation: Results From the ENGAGE AF-TIMI 48 Trial (Effective Anticoagulation With Factor Xa Next Generation in Atrial Fibrillation-Thrombolysis in Myocardial Infarction 48). Circ Arrhythm Electrophysiol. 2017; 10:e004267. DOI | PubMed
- Björck S, Palaszewski B, Friberg L, Bergfeldt L. Atrial fibrillation, stroke risk, and warfarin therapy revisited: a population-based study. Stroke. 2013; 44:3103-8. PubMed
- Christiansen CB, Gerds TA, Olesen JB. Atrial fibrillation and risk of stroke: a nationwide cohort study. Europace. 2016; 18:1689-97. PubMed
- Friberg L, Tabrizi F, Englund A. Catheter ablation for atrial fibrillation is associated with lower incidence of stroke and death: data from Swedish health registries. Eur Heart J. 2016; 37:2478-87. DOI | PubMed
- Noseworthy PA, Kapa S, Deshmukh AJ. Risk of stroke after catheter ablation versus cardioversion for atrial fibrillation: A propensity-matched study of 24,244 patients. Heart Rhythm. 2015; 12:1154-61. DOI | PubMed
- Bunch TJ, May HT, Bair TL. Atrial fibrillation ablation patients have long-term stroke rates similar to patients without atrial fibrillation regardless of CHADS2 score. Heart Rhythm. 2013; 10:1272-7. DOI | PubMed
- Piccini JP, Stevens SR, Lokhnygina Y, ROCKET AF Steering Committee & Investigators. Outcomes after cardioversion and atrial fibrillation ablation in patients treated with rivaroxaban and warfarin in the ROCKET AF trial. J Am Coll Cardiol. 2013; 61:1998-2006. DOI | PubMed
Fonte
Adderley NJ, Nirantharakumar K, Marshall T (2018) Risk of stroke and transient ischaemic attack in patients with a diagnosis of resolved atrial fibrillation: retrospective cohort studies. The BMJ 361k1717. https://doi.org/10.1136/bmj.k1717





