Abstract
Dichiarazione di importanza
È generalmente accettato che la memoria a lungo termine (LTM) sia codificata come alterazioni della forza sinaptica. Un modello alternativo, tuttavia, propone che l’LTM sia codificato da alterazioni epigenetiche. Gli RNA non codificati (ncRNA) possono mediare le modifiche epigenetiche. Pertanto, RNA da un animale addestrato potrebbe essere in grado di produrre cambiamenti comportamentali simili all’apprendimento in un animale non addestrato. Qui, è dimostrato che la memoria per la sensibilizzazione a lungo termine (LTS) nel mollusco marino Aplysia può essere trasferito con successo iniettando RNA da sensibilizzati in animali ingenui. Inoltre, una specifica alterazione cellulare che è alla base della sensibilizzazione in Aplysia, ipereccitabilità dei neuroni sensoriali, può essere riprodotto esponendo i neuroni sensoriali in vitro a RNA da animali addestrati. I risultati forniscono il supporto per un modello non sinaptico ed epigenetico di memorizzazione della memoria in Aplysia.
Introduzione
Uno dei principali obiettivi delle moderne neuroscienze è quello di determinare l’identità dell’engram, la traccia fisica della memoria(Semon, 1921). Attualmente, è ampiamente accettato che la memoria a lungo termine (LTM) sia memorizzata mediante modifiche indotte dall’apprendimento delle connessioni sinaptiche(Mayford et al., 2012; Takeuchi et al., 2014). Ma considerazioni teoriche(Holliday, 1999; Gallistel e Balsam, 2014) e recenti prove sperimentali(Chen et al., 2014; Johansson et al., 2014; Ryan et al., 2015) sostengono l’idea che l’LTM sia immagazzinata all’interno dei corpi cellulari dei neuroni. In precedenza, è stato riportato che la memoria per la sensibilizzazione a lungo termine (LTS) in Aplysia(Pinsker et al., 1973) comporta una componente di priming precoce, dipendente dalla sintesi proteica, che può persistere indipendentemente dalle alterazioni comportamentali e sinaptiche correlate alla memoria; la componente di priming permette di ripristinare l’LTM in seguito alla sua interruzione mediante blocco di riconsolidamento, o di essere indotta da un addestramento parziale dopo il deterioramento del consolidamento della memoria mediante amnesia retrograda(Chen et al., 2014; Pearce et al., 2017). L’identità molecolare della componente di adescamento della memoria è sconosciuta, ma sembra comportare modifiche epigenetiche(Zovkic et al., 2013). Gli RNA non codificanti (ncRNA), che svolgono un ruolo importante nella formazione della memoria(Rajasethupathy et al., 2009, 2012; Fiumara et al., 2015; Guven-Ozkan et al., 2016; Tan et al., 2017), rappresentano un meccanismo importante per le alterazioni epigenetiche(Peschansky e Wahlestedt, 2014; Savell et al., 2016). Ciò solleva l’intrigante possibilità che i costituenti di LTM possano essere trasferiti da un animale addestrato ad un animale non addestrato dall’RNA. Qui, abbiamo testato questa possibilità nel caso di LTS in Aplysia.
Materiali e metodi
Formazione e test comportamentali
L’Aplysia californica adulta (80-120 g) è stata ottenuta da Alacrity Marine Biological Services e inizialmente ospitata in un acquario da 50 galloni riempito con acqua di mare raffreddata (12-14°C) e aerata. Per gli esperimenti, gli animali sono stati collocati singolarmente in camere di plexiglas costruite su misura che sono state continuamente perfuse con acqua di mare raffreddata (14°C). Un giorno prima dell’addestramento, ogni animale è stato impiantato bilateralmente con fili di platino rivestiti di teflon (0,008 pollici di diametro rivestito, A-M Systems). Per questa procedura, l’animale è stato anestetizzato mediante raffreddamento in acqua di mare fredda (4°C) per 13 min. I fili, preparati rimuovendo il teflon dalle estremità con pinze, sono stati infilati attraverso un ago di calibro 20, che è stato utilizzato per inserire il filo nella coda dell’animale. A seguito di questa procedura, l’animale è stato posto nella camera sperimentale, dove è stato dato 24 h per recuperare e acclimatarsi alla camera. Il sifono-reflesso di prelievo (SWR) è stato testato come segue: Il sifone è stato leggermente stimolato con una sonda morbida e flessibile e la durata del SWR risultante è stata cronometrata. La temporizzazione dell’SWR è iniziata una volta che il sifone si è completamente ritirato sotto i parapodi ed è terminata non appena il sifone è riapparso. Alle risposte è stato dato un punteggio di 1,0 s se il sifone non si ritirava completamente nei parapodi. Tre pretest sono stati consegnati una volta ogni 10 minuti, iniziando 25 minuti prima dell’inizio dell’allenamento(figg. 1A, 2A). L’addestramento di sensibilizzazione comprendeva due turni di addestramento separati da 24 ore. Ogni turno di addestramento consisteva in cinque attacchi di shock di coda consegnati ad intervalli di 20 minuti. Durante ogni incontro di addestramento, l’animale riceveva tre treni; l’intervallo inter-treno era di 2 s. Ogni treno aveva una durata di 1 s e consisteva di shock (durata dell’impulso di 10 ms, 40 Hz, 120 V) consegnati alla coda dell’animale tramite uno stimolatore d’erba (S88, Astro-Med) collegato ai fili di platino. Un singolo posttest del SWR, eseguito esattamente come i pretest, è stato effettuato a 48 h dopo l’inizio dell’addestramento. I test e la formazione sono stati condotti da diversi sperimentatori, e il tester era cieco al trattamento sperimentale dell’animale.
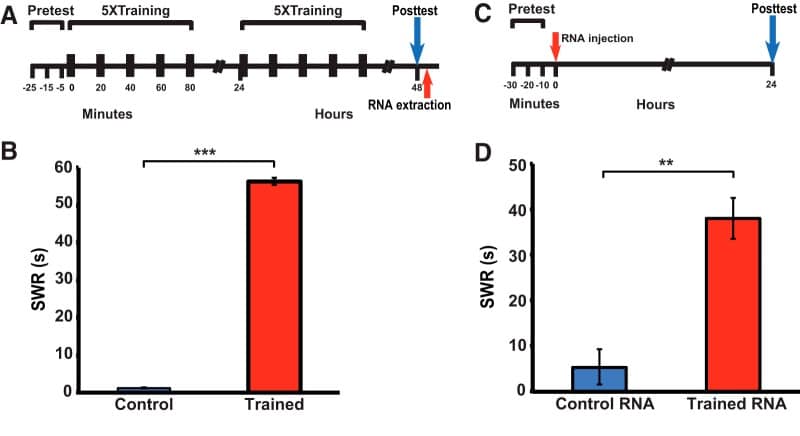
Figura 1.L’RNA estratto da animali donatori addestrati alla sensibilizzazione induce un miglioramento a lungo termine del CFA nel ricevente Aplysia. A, Protocollo sperimentale per l’induzione di LTS negli animali donatori. B, Durata media posttest del SWR nel controllo non addestrato (1,2 ± 0,1 s, n = 31 ) e addestrato (56,4 ± 2,0 s, n = 34) gruppi. Il gruppo addestrato ha mostrato una sensibilizzazione significativa, come indicato dal confronto con il gruppo di controllo (test Mann-Whitney, U = 496, p < 0,001). C, Protocollo sperimentale per gli esperimenti di iniezione di RNA. Il primo pretest si è verificato 2-3 h dopo il post test per l’addestramento comportamentale (A). D, Durata media del SWR misurata su ∼24 h dopo l’iniezione dell’RNA per i gruppi RNA di controllo (5,4 ± 3,9 s, n = 7) e RNA addestrato (38,0 ± 4,6 s, n = 7). I due gruppi differivano significativamente(U = 30, p < 0,003). Inoltre, i test Wilcoxon hanno indicato che la differenza tra il pretest e il posttest per il gruppo RNA addestrato era significativa(W = 28, p < 0,02), mentre non era significativa per il gruppo RNA di controllo (p > 0,2). I grafici a barre in questo e le figure che seguono indicano ± SEM; *p < 0, 05, **p < 0,01, ***p < 0,001, n. s., non significativo.
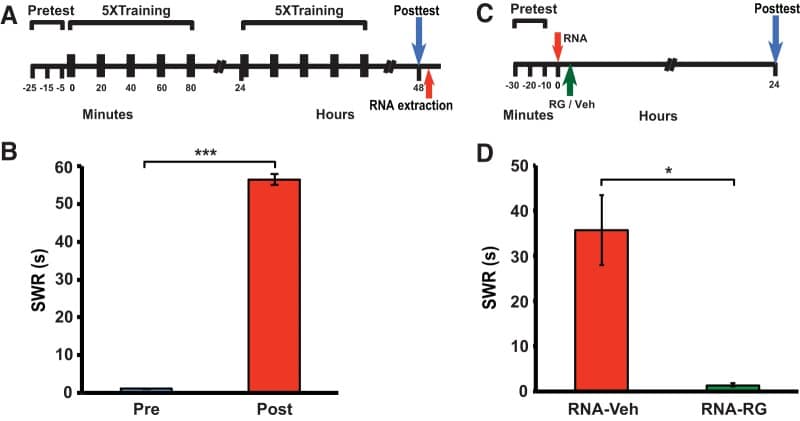
Figura 2.La metilazione del DNA è necessaria per il potenziamento del SWR indotto dall’RNA. A, Protocollo sperimentale per indurre la sensibilizzazione nel secondo gruppo di donatori. B, Durata media dopo il test del SWR(n = 38). L’addestramento ha prodotto la sensibilizzazione (SWR medio posttest = 56,4 ± 1,4 s, e SWR medio pre-test = 1,1 ± 0,1 s; W = 741, p < 0,001). C, Protocollo sperimentale per testare l’effetto dell’inibizione del DNMT sul potenziamento dell’SWR indotto dall’RNA. RG-108/veicolo è stato iniettato in animali 5-10 min dopo l’iniezione di RNA. D, Durata media post-iniezione del SWR nei gruppi RNA-Veh(n = 3) e RNA-RG(n = 7). La durata media del CFA nel gruppo RNA-Veh (35,7 ± 7,7 s) era significativamente più lunga di quella del gruppo RNA-RG (1,4 ± 0,3 s; U = 27, p < 0,02). Inoltre, il SWR post-prova è stato sensibilizzato rispetto al riflesso pre-test nel gruppo RNA-Veh (test t accoppiato, p < 0,05), ma non nel gruppo RNA-RG (p > 0,4).
Negli esperimenti con iniezioni di RNA (vedi Risultati), agli animali ingenui sono stati somministrati tre pretestuosi, identici a quelli che hanno preceduto l’addestramento alla sensibilizzazione, a 30, 20 e 10 minuti prima dell’iniezione (Figg. 1C, 2C). Un singolo post-test del SWR è stato eseguito a 24 ore dopo l’iniezione.

Figura 1.RNA estratto da animali donatori addestrati alla sensibilizzazione induce un miglioramento a lungo termine del SWR nel ricevente Aplysia. A, Protocollo sperimentale per l’induzione di LTS negli animali donatori. B, Durata media posttest del CFA nei gruppi di controllo non addestrati (1,2 ± 0,1 s, n = 31 ) e addestrati (56,4 ± 2,0 s, n = 34). Il gruppo addestrato ha mostrato una sensibilizzazione significativa, come indicato dal confronto con il gruppo di controllo (test Mann-Whitney, U = 496, p < 0,001). C, Protocollo sperimentale per gli esperimenti di iniezione di RNA. Il primo pretest si è verificato 2-3 h dopo il post test per l’addestramento comportamentale (A). D, Durata media del SWR misurata su ∼24 h dopo l’iniezione dell’RNA per i gruppi RNA di controllo (5,4 ± 3,9 s, n = 7) e RNA addestrato (38,0 ± 4,6 s, n = 7). I due gruppi differivano significativamente(U = 30, p < 0,003). Inoltre, i test Wilcoxon hanno indicato che la differenza tra il pretest e il posttest per il gruppo RNA addestrato era significativa(W = 28, p < 0,02), mentre non era significativa per il gruppo RNA di controllo (p > 0,2). I grafici a barre in questo e le figure che seguono indicano ± SEM; *p < 0, 05, **p < 0,01, ***p < 0,001, n. s., non significativo.

Figura 2.La metilazione del DNA è necessaria per il potenziamento del SWR indotto dall’RNA. A, Protocollo sperimentale per indurre la sensibilizzazione nel secondo gruppo di donatori. B, Durata media dopo il test del SWR(n = 38). L’addestramento ha prodotto la sensibilizzazione (SWR medio posttest = 56,4 ± 1,4 s, e SWR medio pre-test = 1,1 ± 0,1 s; W = 741, p < 0,001). C, Protocollo sperimentale per testare l’effetto dell’inibizione del DNMT sul potenziamento dell’SWR indotto dall’RNA. RG-108/veicolo è stato iniettato in animali 5-10 min dopo l’iniezione di RNA. D, Durata media post-iniezione del SWR nei gruppi RNA-Veh(n = 3) e RNA-RG(n = 7). La durata media del CFA nel gruppo RNA-Veh (35,7 ± 7,7 s) era significativamente più lunga di quella del gruppo RNA-RG (1,4 ± 0,3 s; U = 27, p < 0,02). Inoltre, il SWR post-prova è stato sensibilizzato rispetto al riflesso pre-test nel gruppo RNA-Veh (test t accoppiato, p < 0,05), ma non nel gruppo RNA-RG (p > 0,4).
RNA e preparazione e iniezione di farmaci
Per preparare una singola iniezione di RNA, i gangli pleurale-pedale e addominale sono stati rimossi da quattro a cinque animali addestrati alla sensibilizzazione, o da quattro a cinque controlli non addestrati, subito dopo il posttest di 48 ore. L’RNA totale è stato poi estratto dai gangli sezionati. I gangli sono stati inizialmente omogeneizzati in reagente TRIzol per 30 s; in genere, 1 ml di TRIzol è stato utilizzato per omogeneizzare i gangli centrali da due animali. Per ogni 1 ml di reagente TRIzol, 200 μl di cloroformio è stato aggiunto e mescolato per 15 s. Dopo l’incubazione a temperatura ambiente per 5-10 min, il campione è stato centrifugato a 12.000 × g per 15 min. La fase acquosa superiore è stata trasferita in una nuova provetta. Il campione è stato poi centrifugato per 10 min a 4°C dopo l’aggiunta di 500 μl di isopropanolo per precipitare l’RNA. I pellet RNA risultante sono stati lavati con il 70% di etanolo e centrifugato per 2 minuti a 4 ° C. Dopo essere stato essiccato all’aria per 10 minuti, il pellet di RNA da ogni tubo è stato sciolto in 30 microlitri DIH2O,poi l’RNA da gangli sezionato da animali addestrati (in genere, da quattro animali) è stato combinato, o l’RNA da gangli sezionato da animali non addestrati è stato combinato, in un unico tubo, e la concentrazione di RNA è stata misurata utilizzando Nano Drop (Thermo Fisher ND-1000). Dopo che la concentrazione di RNA era stata determinata, 70 μg di RNA combinato è stato aliquotare e ASW è stato aggiunto a questa aliquota per raggiungere un volume di 100 μl; questa soluzione è stata poi iniettata nell’emocoel di un animale attraverso il suo collo. Ogni animale ricevente riceveva quindi 70 µg di RNA da animali addestrati o da animali di controllo.
L’inibitore della metiltransferasi del DNA (DNMT) RG108 (Sigma) è stato sciolto in DMSO ad una concentrazione di 25 mM. Per inibire il DNMT, un volume di 100 μl/100 g di peso corporeo di RG108 è stato iniettato per via intraemiocoelica in ogni animale (Fig. 2C).
Coltura cellulare e misurazioni elettrofisiologiche
I neuroni sensoriali pleurici e i piccoli sifoni (LFS) motoneuroni sono stati dissociati individualmente dagli animali adulti e inseriti in colture cellulari(Rayport e Schacher, 1986; Lin e Glanzman, 1994). Alcune delle colture cellulari comprendevano neuroni isolati, sia esclusivamente sensoriali o esclusivamente motoneuroni; altre comprendevano coppie sinapticamente accoppiate di neuroni, ciascuna composta da un singolo neurone sensoriale e da un singolo motoneurone. Il mezzo di coltura cellulare era composto per il 50% da emolinfa sterile Aplysia e per il 50% da Leibowitz-15 (L-15, Sigma). Durante la registrazione elettrofisiologica le colture cellulari sono state perfuse con 50% ASW e 50% L-15 (mezzo di registrazione). Le registrazioni da neuroni isolati sono state effettuate utilizzando neuroni dissociati che erano stati in coltura per 5 d all’inizio degli esperimenti. Per gli esperimenti su coppie sinapticamente accoppiate di neuroni (colture sensomotorie), i neuroni erano in coltura per 3 d prima delle registrazioni iniziali. I neuroni sono stati impalati con micropipette appuntite (20-30 MΩ) riempite con 1,5 M di acetato di potassio, 0,5 M di cloruro di potassio, e 0,01 M HEPES (pH 7,2). I segnali di tensione registrati sono stati amplificati con un amplificatore Axoclamp 2B (Dispositivi Molecolari), digitalizzati con un ITC-18 (Instrutech), e acquisiti e memorizzati con il software Axograph.
Durante le misurazioni delle proprietà biofisiche dei neuroni sensoriali e motori isolati, il potenziale della membrana cellulare è stato bloccato in corrente a -50 mV. Il potenziale di azione (AP) soglia di cottura è stata determinata iniettando 2-s impulsi di corrente di intensità incrementale (0,1 nA per i neuroni sensoriali e 0,01 nA per i motoneuroni). Le cellule sono state iniettate con un 2-s impulsi di corrente costante di suprathreshold positivo per le misure di eccitabilità neuronale(Liu et al., 2011). Nel caso dei neuroni sensoriali, sono stati utilizzati impulsi di corrente di 0,5, 1,0, o 2,0 nA a seconda che la soglia iniziale di cottura era <0,5, ≥0,5, o ≥1,0 nA, rispettivamente. I neuroni sensoriali sono stati esclusi dall’analisi se il loro potenziale di membrana a riposo era più depolarizzato di -35 mV. Per testare l’eccitabilità dei motoneuroni, impulsi di corrente positiva di 0,1, 0,2, o 0,3 nA sono stati utilizzati quando la soglia di picco iniziale era <0,1, ≥0,1, o ≥0,2 nA, rispettivamente. I motoneuroni i cui potenziali di membrana erano più depolarizzati di -30 mV sono stati esclusi. Dopo le misurazioni elettrofisiologiche sono state completate, i microelettrodi sono stati rimossi dai neuroni, e le colture cellulari sono stati trattati con RNA-contenente mezzo o soluzione di veicolo (vedi risultati). Ventiquattro ore dopo, i neuroni sono stati reimpalati e le loro proprietà elettrofisiologiche rimisurate.
Negli esperimenti che coinvolgono le colture sensomotorie, l’ampiezza del EPSP monosinaptico evocato da un singolo AP presinaptico è stato valutato il giorno 1 dell’esperimento. A tal fine, il neurone sensoriale presinaptico e il motoneurone postsinaptico nella cocultura sono stati impalati con microelettrodi taglienti. Per evitare che il motoneurone si spari spontaneamente durante la prova, il potenziale di membrana del neurone è stato tenuto a -80 a -85 mV passando corrente negativa (0,3-0,8 nA) nella cella attraverso il microelettrodo di registrazione utilizzando il circuito a ponte dell’amplificatore. Un EPSP iniziale è stato suscitato attraverso una breve stimolazione intracellulare breve del neurone sensoriale utilizzando un impulso di corrente positiva (20 ms, 0,2-0,8 nA). Dopo il pretest, i microelettrodi sono stati rimossi dai neuroni sensoriali e motori, e il mezzo di registrazione è stato sostituito con mezzo di coltura cellulare. Poi la coltura è stato trattato sia con RNA-contenente mezzo di coltura o di controllo (vedi risultati). I sensoriali e motoneuroni sono stati reimpalati con microelettrodi e l’ampiezza del EPSP monosinaptico rivalutato 24 ore dopo.
RNA / veicolo trattamento delle colture cellulari
Dopo le prime misurazioni elettrofisiologiche del primo giorno, il mezzo di registrazione è stato lavato via con il normale mezzo di coltura cellulare. Le colture sono stati poi assegnati in modo casuale al trattamento con RNA da animali addestrati (gruppo RNA addestrato), RNA da animali non addestrati (gruppo RNA di controllo), o veicolo. Per i trattamenti di RNA, 1 microgrammo di RNA è stato aggiunto ad ogni piatto di coltura cellulare, ottenendo una concentrazione di 0,5 microgrammi di RNA per 1 ml di terreno di coltura cellulare. L’RNA dagli animali addestrati, l’RNA dagli animali di controllo, o il veicolo è stato aggiunto alla piastra di coltura cellulare e lasciato nella piastra per 24 ore, dopo di che è stato lavato via con il mezzo di registrazione per 30 minuti, e le misurazioni elettrofisiologiche post-pest fatto.
Analisi statistiche
Le analisi statistiche dei dati sono state effettuate con SigmaStat (Systat Software). I test non parametrici sono stati utilizzati per valutare la significatività statistica delle differenze ogni volta che si è reso necessario a causa della non-normalità dei dati o della violazione del presupposto di omogeneità della varianza tra i gruppi sperimentali. I test Mann-Whitney U sono stati utilizzati per il confronto di due gruppi indipendenti. Un test t accoppiato o un test Wilcoxon rank-sum è stato utilizzato per confrontare due gruppi dipendenti. Quando sono stati coinvolti tre gruppi indipendenti, la significatività delle differenze complessive del gruppo è stata inizialmente valutata con un test a senso unico ANOVA o un test di Kruskal-Wallis. Dato che le differenze di gruppo erano significative, i test post hoc di Dunn sono stati utilizzati per il confronto a coppie. La normalità della distribuzione è stata testata con un test Shapiro-Wilk. Il test di Levene centrato sulla media (pacchetto auto) è stato usato con il software R per testare l’omogeneità della varianza negli esperimenti sinaptici. Tutti i livelli di significatività riportati rappresentano valori a due code. Le analisi statistiche sono riassunte nella Tabella 1.
| Struttura dei dati | Tipo di test | Potenza (α = 0,05) | |
|---|---|---|---|
| a(Fig. 1B) | Non-normalmente distribuito | Test di Mann-Whitney | Non applicabile |
| b(Fig. 1D) | Non-normalmente distribuito | Test di Mann-Whitney | Non applicabile |
| c(Fig. 1D) | Non-normalmente distribuito | Test di Wilcoxon | Non applicabile |
| d(Fig. 1D) | Non-normalmente distribuito | Test di Wilcoxon | Non applicabile |
| e(Fig. 2B) | Non-normalmente distribuito | Test di Wilcoxon | Non applicabile |
| f(Fig. 2D) | Non-normalmente distribuito | Test di Mann-Whitney | Non applicabile |
| g(Fig. 2D) | Normalmente distribuito | Test t accoppiato | 0.647 |
| h(Fig. 2D) | Non-normalmente distribuito | Test di Wilcoxon | Non applicabile |
| i(Fig. 3B) | Non-normalmente distribuito | Test di Kruskal-Wallis seguito dal test di Dunn | Non applicabile |
| j(Fig. 3D) | Non-normalmente distribuito | Test di Kruskal-Wallis | Non applicabile |
| k(fig. 4B) | Non-normalmente distribuito | Il test di Levene | Non applicabile |
| l(Fig. 4B) | Non-normalmente distribuito | Test di Kruskal-Wallis | Non applicabile |
Risultati
L’iniezione di RNA da animali donatori addestrati alla sensibilizzazione provoca un miglioramento del riflesso di astinenza nei riceventi non addestrati
Per generare l’RNA utilizzato per il trasferimento di memoria, Aplysia individuali sono stati dati formazione sensibilizzazione individuale costituito da attacchi distanziati di shock della coda per due giorni consecutivi(Fig. 1A). L’addestramento ha prodotto un chiaro LTS, come indicato dal significativo miglioramento del SWR 24 h dopo il secondo giorno di addestramento (48 h posttest) nel gruppo di animali addestrati(Fig. 1B). Subito dopo le 48 ore di posttest, l’RNA è stato estratto dal sistema nervoso centrale (pleura, pedale e gangli addominali) degli animali di controllo e addestrati. L’RNA estratto è stato poi iniettato per via intraemiocoelica in altre aplisie ingenue ( animali riceventi; Fig. 1C). (Si noti che occasionalmente lotti di Aplysia catturati in natura non ha sensibilizzato. I dati comportamentali di questi animali sono stati esclusi dall’analisi, e l’RNA non è stato estratto da loro). La durata del SWR nei riceventi è stata misurata 24 ore dopo l’iniezione di RNA. Il CFA è stato significativamente migliorato nel gruppo di animali addestrati RNA rispetto al gruppo di controllo RNA(Fig. 1D). Inoltre, un confronto all’interno del gruppo ha indicato che la durata del riflesso dopo l’iniezione era significativamente più lunga rispetto alla durata presunta negli animali che hanno ricevuto l’iniezione di RNA da donatori addestrati; al contrario, il CFA dopo l’iniezione non è stato significativamente prolungato rispetto al CFA presunto negli animali che hanno ricevuto l’iniezione di RNA da donatori non addestrati. Così, solo l’RNA da animali sensibilizzati sembrava indurre un miglioramento dei riflessi nelle lumache riceventi.
L’inibizione della metilazione del DNA blocca l’effetto comportamentale dell’RNA da animali donatori sensibilizzati nei riceventi
Sia il consolidamento e il mantenimento del LTM per la sensibilizzazione in Aplysia dipendono dalla metilazione del DNA(Rajasethupathy et al., 2012; Pearce et al., 2017). Per determinare se il miglioramento comportamentale mediato dall’RNA richiesto dalla metilazione del DNA, abbiamo esaminato se l’inibizione della metilazione del DNA ha interrotto l’effetto sensibilizzante dell’RNA da animali addestrati. Aplysia sono stati dati ancora una volta 2 d di formazione sensibilizzazione, che ha prodotto LTS, e dopo l’RNA è stato estratto dai loro gangli centrali(Fig. 2A,B). L’RNA è stato poi iniettato in due gruppi di lumache ingenue; 5-10 minuti dopo, uno di questi gruppi (gruppo RNA-RG) ha ricevuto anche un’iniezione intraemicoelica dell’inibitore DNMT RG-108 (Brueckneret al., 2005; Pearce et al., 2017), mentre l’altro (gruppo RNA-Veh) ha ricevuto un’iniezione della soluzione del veicolo (Fig. 2C). Il gruppo RNA-Veh ha mostrato un significativo miglioramento del SWR 24 ore dopo; al contrario, il gruppo RNA-RG non ha mostrato un miglioramento del comportamento(Fig. 2D). Pertanto, la metilazione del DNA è necessaria per il miglioramento dell’SWR indotto dall’RNA, così come lo è per l’LTS del riflesso indotto dallo shock di coda(Pearce et al., 2017).
RNA da animali sensibilizzati induce una maggiore eccitabilità nei neuroni sensoriali dissociati da animali ingenui
Un vantaggio significativo di Aplysia come sistema modello per le analisi meccanicistiche dell’apprendimento e della memoria è la ricchezza delle conoscenze esistenti sulle basi biologiche della sensibilizzazione in questo organismo(Kandel, 2001; Byrne e Hawkins, 2015). Di conseguenza, abbiamo testato se l’RNA estratto da animali addestrati alla sensibilizzazione ha causato alternanze cellulari che imitano quelle note come risultato di ripetuti shock della coda. Per accertare se i cambiamenti cellulari indotti da RNA da animali sensibilizzati imitano i cambiamenti cellulari indotti da shock indotto, abbiamo fatto uso di sensori e motoneuroni del circuito di prelievo in coltura cellulare dissociata(Lin e Glanzman, 1994).
In risposta ad un impulso prolungato di depolarizzazione della corrente intracellulare, i neuroni sensoriali Aplysia mostrano un picco di “accomodamento”: essi sparano all’inizio, ma non in tutto l’impulso di corrente (Klein etal., 1986). La sensibilizzazione a lungo termine del riflesso difensivo di astinenza è accompagnata da un aumento a lungo termine dell’eccitabilità dei somati dei neuroni sensoriali centrali nel circuito di astinenza(Walters, 1987); questa maggiore eccitabilità si riflette come anti-accommodation, un aumento del numero di AP evocati da un impulso prolungato di corrente positiva(Cleary et al., 1998). Per verificare se l’RNA estratto da Aplysia addestrato altera l’accomodamento dei neuroni sensoriali, abbiamo usato neuroni sensoriali isolati in coltura cellulare dissociata. I neuroni sono stati inizialmente impalati con microelettrodi taglienti e il numero di AP evocati da un 2-s impulso intracellulare di suprathreshold corrente positiva quantificata(Fig. 3A). A seguito di questo pretest, i neuroni sensoriali sono stati trattati per 24 ore con RNA da donatori addestrati o RNA da donatori non addestrati. Altri neuroni sensoriali sono stati trattati con una quantità equivalente del solo veicolo. Il giorno successivo, l’RNA/veicolo è stato lavato via dai piatti di coltura con il mezzo di registrazione cellulare, e i neuroni sono stati reimpalati e reiniettati con la stessa corrente di suprathreshold per misurare i potenziali cambiamenti di eccitabilità. Le iniezioni correnti hanno prodotto un numero significativamente maggiore di AP nei neuroni sensoriali trattati con RNA da animali sensibilizzati che nei neuroni sensoriali trattati con veicoli o RNA da animali di controllo(Fig. 3B). Non c’è stata alcuna differenza significativa nella eccitabilità tra i neuroni sensoriali trattati con RNA di controllo e quelli trattati con il veicolo. L’antialloggiamento è noto per essere il risultato di una diminuzione delle correnti cicliche di potassio dipendenti da AMP nei neuroni sensoriali di Aplysia, e, in particolare, per la riduzione della corrente di tipo S che si attiva lentamente(Klein et al., 1986; Goldsmith e Abrams, 1992); quindi, l’RNA di animali addestrati alla sensibilizzazione può aumentare l’eccitabilità dei neuroni sensoriali attraverso la modulazione della stessa corrente che è modulata da scosse elettriche alla parete corporea di Aplysia.
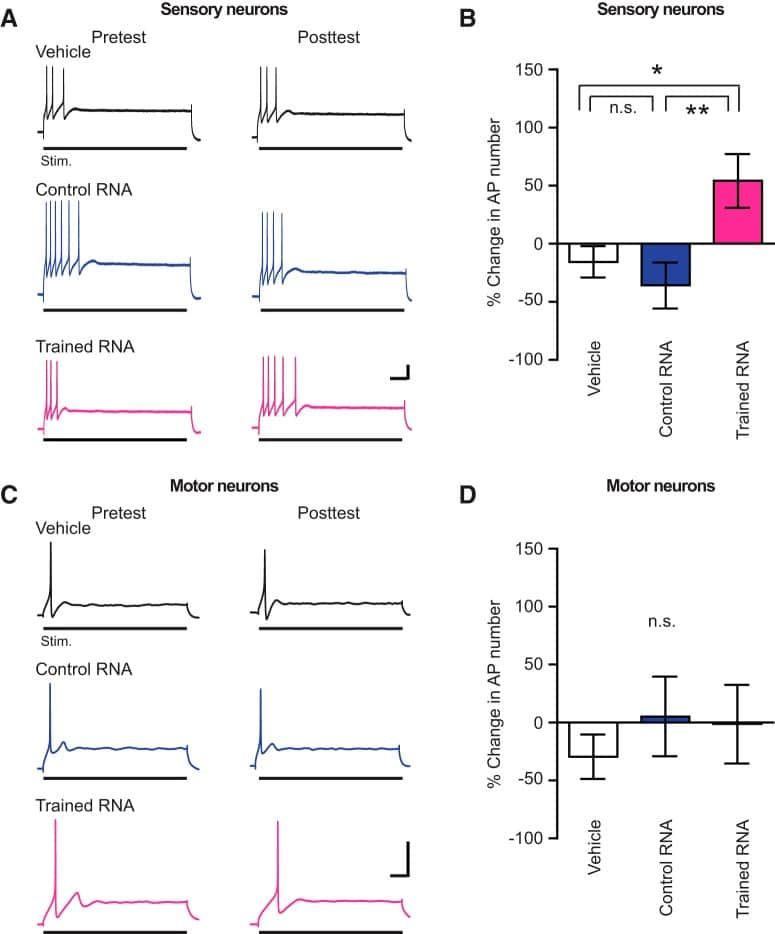
Figura 3.Il trattamento con RNA da animali addestrati aumenta l’eccitabilità nei neuroni sensoriali dissociati ma non nei motoneuroni dissociati. A, Tracce elettrofisiologiche campione da prove di eccitabilità sui neuroni sensoriali. Barre di scala: 20 mV, 0,25 s. B, Cambiamenti nell’eccitabilità dei neuroni sensoriali indotti dal trattamento RNA/veicolo. La variazione media degli AP evocati in ogni gruppo è stata: veicolo = -17,29 ± 12,86% (n = 19); controllo RNA = -35,76 ± 19,88% (n = 16); e RNA addestrato = 56,66 ± 22,07% (n = 19). Le differenze di gruppo sono state significative (Kruskal-Wallis; H = 11,81, p < 0,04). I test post hoc di Dunn hanno indicato che l’aumento del tiro nel gruppo RNA addestrato era maggiore di quello del gruppo di veicoli (q =2,44, p < 0,05) e del gruppo RNA di controllo (q = 3,25, p < 0, 004 ), rispettivamente. La differenza tra il gruppo veicolo e il gruppo RNA di controllo non era significativa(p > 0,9). C, Tracce di campione da prove di eccitabilità del motoneurone. Barre di scala: 25 mV, 0,25 s. D, Riepilogo dei cambiamenti post-trattamento dell’eccitabilità dei motoneuroni. I cambiamenti medi sono stati: gruppo veicolo = -29,28 ± 19,16% (n = 15); gruppo RNA di controllo = 5,278 ± 34,36% (n = 12); e gruppo RNA addestrato = -1,136 ± 34,01% (n = 14). Le differenze di gruppo nell’eccitabilità erano insignificanti(p > 0,7).

Figura 3.Il trattamento con RNA da animali addestrati aumenta l’eccitabilità nei neuroni sensoriali dissociati ma non nei motoneuroni dissociati. A, Tracce elettrofisiologiche campione da prove di eccitabilità sui neuroni sensoriali. Barre di scala: 20 mV, 0,25 s. B, Cambiamenti nell’eccitabilità dei neuroni sensoriali indotti dal trattamento RNA/veicolo. La variazione media degli AP evocati in ogni gruppo è stata: veicolo = -17,29 ± 12,86% (n = 19); controllo RNA = -35,76 ± 19,88% (n = 16); e RNA addestrato = 56,66 ± 22,07% (n = 19). Le differenze di gruppo sono state significative (Kruskal-Wallis; H = 11,81, p < 0,04). I test post hoc di Dunn hanno indicato che l’aumento del tiro nel gruppo RNA addestrato era maggiore di quello del gruppo di veicoli (q =2,44, p < 0,05) e del gruppo RNA di controllo (q = 3,25, p < 0, 004 ), rispettivamente. La differenza tra il gruppo veicolo e il gruppo RNA di controllo non era significativa(p > 0,9). C, Tracce di campione da prove di eccitabilità del motoneurone. Barre di scala: 25 mV, 0,25 s. D, Riepilogo dei cambiamenti post-trattamento dell’eccitabilità dei motoneuroni. I cambiamenti medi sono stati: gruppo veicolo = -29,28 ± 19,16% (n = 15); gruppo RNA di controllo = 5,278 ± 34,36% (n = 12); e gruppo RNA addestrato = -1,136 ± 34,01% (n = 14). Le differenze di gruppo nell’eccitabilità erano insignificanti(p > 0,7).
RNA da animali sensibilizzati non aumenta l’eccitabilità dei motoneuroni dissociati
Per accertare la specificità degli effetti cellulari del trattamento RNA, abbiamo esaminato gli effetti dell’applicazione di RNA da animali addestrati o animali di controllo a isolati piccoli sifoni (LFS) motoneuroni in coltura cellulare dissociata. Un precedente studio di LTS in Aplysia ha mostrato che, in contrasto con gli effetti osservati nei neuroni sensoriali, nei motoneuroni LTS non è stato accompagnato da un aumento significativo del numero di AP evocato per iniezione intracellulare di un impulso prolungato di corrente di suprathreshold(Cleary et al., 1998). Così, l’induzione di LTS non produce un aumento complessivo dell’eccitabilità dei motoneuroni. Allo stesso modo, non abbiamo osservato alcun effetto dell’RNA da animali addestrati alla sensibilizzazione sulle proprietà correlate all’eccitabilità dei motoneuroni isolati in coltura cellulare(Fig. 3C,D). Questo risultato indica che la modulazione dell’eccitabilità neuronale da parte dell’RNA di animali sensibilizzati era specifica per i neuroni sensoriali.
L’RNA di animali sensibilizzati ha un effetto variabile sulla forza sinaptica nelle culture sensomotorie
LTS in Aplysia comporta la facilitazione a lungo termine (LTF) della connessione monosinaptica tra i neuroni sensoriali e motori del circuito di prelievo(Frost et al., 1985). Di conseguenza, abbiamo esaminato gli effetti dell’RNA da donatori addestrati e non addestrati sulla forza delle sinapsi sensomotorie nella cultura cellulare dissociata(Montarolo et al., 1986; Cai et al., 2008). Non c’è stato alcun effetto a lungo termine di 24 ore di incubazione con RNA da animali addestrati, RNA da animali di controllo, o il veicolo sulla media EPSP evocato nei motoneuroni postsinaptici da un AP presinaptico(Fig. 4). Tuttavia, anche se la media EPSPs nei tre gruppi sperimentali non differivano in modo significativo, le variazioni tra le EPSPs nei tre gruppi erano significativamente disuguali a causa della maggiore varianza nella EPSPs per le sinapsi trattate con RNA da animali addestrati alla sensibilizzazione. L’ispezione dei dati sinaptici ha rivelato che l’RNA da donatori addestrati ha prodotto un grande miglioramento di un sottoinsieme delle sinapsi sensomotorie. Tale miglioramento non è mai stato osservato per le sinapsi trattate con RNA da animali non addestrati o per le sinapsi trattate con il veicolo.
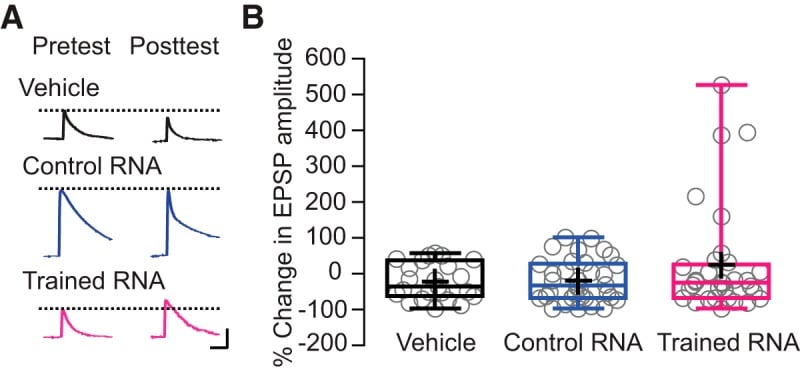
Figura 4.L’esposizione delle connessioni sinaptiche sensorimotorie in vitro a RNA da animali addestrati ha aumentato la forza di una sottopopolazione di sinapsi. A, Rappresentativo record di EPSPs evocati nei motoneuroni da un singolo AP presinaptico prima e 24 ore dopo i trattamenti RNA / veicolo. Barre di scala: 5 mV, 0.1s. B, Box e baffi trame che mostrano la distribuzione dei cambiamenti post-trattamento in ampiezza EPSP nei tre gruppi sperimentali. Le caselle delineano il secondo e il terzo quartile, le linee orizzontali nelle caselle rappresentano le mediane, e le barre verticali (baffi) mostrano l’estensione della diffusione dei dati. Le croci indicano i mezzi, mentre i singoli punti di dati sono rappresentati da cerchi. Le variazioni medie post-trattamento delle ampiezze dell’EPSP sono state: gruppo di veicoli = -23,38 ± 10,59% (n = 23); gruppo RNA di controllo = -21,32 ± 10,23% (n = 34); e gruppo RNA addestrato = 22,71 ± 26,70% (n = 32). Un test di Kruskal-Wallis non ha rivelato differenze significative tra i gruppi rispetto alle variazioni medie dell’ampiezza dell’EPSP (p >0,8). Si noti, tuttavia, che cinque delle 32 sinapsi trattate con RNA da animali addestrati hanno mostrato un aumento di >150%, mentre nessuna delle sinapsi trattate con veicolo o RNA da animali di controllo ha mostrato un aumento di questa grandezza. Un test di Levene ha confermato che i tre gruppi hanno mostrato variazioni significativamente disuguali (F(2,86) = 5,883, p < 0,005).

Figura 4.L’esposizione dei collegamenti sinaptici in vitro sensorimotori in vitro ad RNA da animali addestrati ha aumentato la forza di una sottopopolazione di sinapsi. A, Rappresentativo record di EPSPs evocati nei motoneuroni da un singolo AP presinaptico prima e 24 ore dopo i trattamenti RNA / veicolo. Barre di scala: 5 mV, 0.1s. B, Box e baffi trame che mostrano la distribuzione dei cambiamenti post-trattamento in ampiezza EPSP nei tre gruppi sperimentali. Le caselle delineano il secondo e il terzo quartile, le linee orizzontali nelle caselle rappresentano le mediane, e le barre verticali (baffi) mostrano l’estensione della diffusione dei dati. Le croci indicano i mezzi, mentre i singoli punti di dati sono rappresentati da cerchi. Le variazioni medie post-trattamento delle ampiezze dell’EPSP sono state: gruppo di veicoli = -23,38 ± 10,59% (n = 23); gruppo RNA di controllo = -21,32 ± 10,23% (n = 34); e gruppo RNA addestrato = 22,71 ± 26,70% (n = 32). Un test di Kruskal-Wallis non ha rivelato differenze significative tra i gruppi rispetto alle variazioni medie dell’ampiezza dell’EPSP (p >0,8). Si noti, tuttavia, che cinque delle 32 sinapsi trattate con RNA da animali addestrati hanno mostrato un aumento di >150%, mentre nessuna delle sinapsi trattate con veicolo o RNA da animali di controllo ha mostrato un aumento di questa grandezza. Un test di Levene ha confermato che i tre gruppi hanno mostrato variazioni significativamente disuguali (F(2,86) = 5,883, p < 0,005).
Discussione
Abbiamo dimostrato che l’RNA da sensibilizzazione addestrato Aplysia contiene componenti critici dell’engram per LTS, come indicato dalla sua capacità di indurre sensibilizzazione come miglioramento comportamentale quando iniettato in animali riceventi ingenui. È importante notare che la sensibilizzazione indotta da RNA, come l’LTS indotta da stimolazione nociva, richiede la metilazione del DNA per il suo consolidamento(Pearce et al., 2017; Fig. 2). Molti dei nostri risultati cellulari e comportamentali sostengono inoltre che questo presunto trasferimento di memoria dagli animali donatori ai riceventi non può essere facilmente attribuito ad effetti non specifici dell’RNA del donatore. In primo luogo, l’RNA di controllo (RNA estratto da donatori non addestrati) non ha prodotto la sensibilizzazione del SWR(Fig. 1). In secondo luogo, l’RNA da donatori addestrati ha avuto un effetto opposto sull’eccitabilità dei neuroni sensoriali coltivati rispetto a quelli dei donatori non addestrati(Fig. 3A,B). In terzo luogo, i cambiamenti prodotti dall’RNA da Aplysia sensibilizzata erano selettivi per i neuroni sensoriali; le proprietà biofisiche dei motoneuroni erano inalterate dall’RNA dei donatori sensibilizzati(Fig. 3C,D). Certo, le alterazioni che abbiamo osservato nelle proprietà biofisiche dei neuroni sensoriali in coltura dopo il trattamento con RNA da animali sensibilizzati è improbabile che rendano pienamente conto dei cambiamenti comportamentali prodotti negli animali riceventi intatti da iniezioni di RNA da donatori addestrati; tuttavia, poiché queste alterazioni biofisiche imitano quelle che si trovano negli animali intatti dopo l’addestramento LTS(Walters, 1987; Cleary et al., 1998), ci si aspetterebbe che contribuiscano sostanzialmente alla sensibilizzazione indotta dall’RNA.
È interessante che l’RNA di animali addestrati alla sensibilizzazione sembra produrre una forte facilitazione solo in un sottoinsieme di sinapsi sensomotorie(Fig. 4). Non comprendiamo la ragione della variabilità dell’effetto sinaptico dell’RNA da animali addestrati. Una possibilità è che ci sia una disomogeneità non ancora apprezzata tra la popolazione di neuroni sensoriali pleurici e/o piccoli sifoni motori che sono stati utilizzati per le coculture sensomotorie; secondo questa idea, solo alcuni dei neuroni dissociati avevano la capacità di esprimere i cambiamenti a lungo termine che contribuiscono alla LTF. Un’altra possibilità è che le alterazioni epigenetiche, in particolare la metilazione del DNA, che risultano dal trattamento con l’RNA di animali sensibilizzati inducano in modo più affidabile alterazioni a livello cellulare, come i cambiamenti nell’eccitabilità neuronale intrinseca(Meadows et al., 2016; vedi anche Meadows et al., 2015), rispetto alla LTF specifica per le sinapsi. Naturalmente, queste possibilità non si escludono a vicenda.
Nel complesso, i cambiamenti cellulari causati dall’RNA di animali addestrati sono stati certamente modesti rispetto ai cambiamenti comportamentali. Ma questo non è inaspettato; i riflessi di ritiro difensivo in Aplysia sono regolati da circuiti neurali interneuronali, oltre alle connessioni sensomotorie monosinaptiche(Cleary et al., 1995). Le iniezioni di RNA da donatori sensibilizzati possono aver prodotto modifiche dei percorsi interneuronali all’interno degli animali che hanno contribuito alla sensibilizzazione comportamentale. Inoltre, è importante notare che l’RNA è stato rimosso dai donatori 48 h dopo l’addestramento; infatti, l’RNA da animali addestrati ha prodotto un maggiore aumento dell’eccitabilità dei neuroni sensoriali in coltura a 48 h post-addestramento rispetto all’addestramento a lungo termine con serotonina(Liu et al., 2011, loro Fig. 6).
I nostri dati indicano che i componenti essenziali dell’engram per LTM in Aplysia possono essere trasferiti ad animali non addestrati, o a neuroni in coltura, tramite RNA. Questa scoperta solleva due domande: (1) Quale(i) RNA specifico(i) media(i) il trasferimento di memoria? e (2) Come fa l’RNA nudo ad arrivare dal mezzo di coltura emolinfa/cellulare nei neuroni di Aplysia? Per quanto riguarda la prima domanda, anche se al momento non conosciamo l’identità delle molecole portatrici di memoria, riteniamo che sia probabile che si tratti di ncRNA. Si noti che i risultati precedenti hanno coinvolto gli ncRNA, in particolare i microRNA (miRNA) e gli RNA che interagiscono con Piwi (piRNA; Rajasethupathy et al., 2009, 2012; Fiumara et al., 2015), in LTM in Aplysia. Gli ncRNA lunghi (lncRNA) rappresentano altre potenziali molecole candidate al trasferimento di memoria(Mercer et al., 2008). Per quanto riguarda la seconda domanda, recenti evidenze hanno rivelato potenziali percorsi per il passaggio di RNA extracellulare, privo di cellule, dai fluidi corporei ai neuroni. Così, i miRNA, per esempio, sono stati rilevati in molti tipi diversi di fluidi corporei, compreso il plasma sanguigno; e i miRNA extracellulari senza cellule possono diventare incapsulati all’interno di esosomi o attaccati a proteine della famiglia degli Argonauti (AGO), rendendo così i miRNA resistenti alla degradazione da parte delle nucleasi extracellulari(Turchinovich et al., 2012, 2013). Inoltre, gli esosomi contenenti miRNA sono stati segnalati per passare liberamente attraverso la barriera emato-encefalica(Ridder et al., 2014; Xu et al., 2017). Ed è ora apprezzato il fatto che gli RNA possono essere scambiati tra le cellule del corpo, anche tra i neuroni, attraverso vescicole extracellulari(Smalheiser, 2007; Valadi et al., 2007; Tkach e Théry, 2016; Ashley et al., 2018; Pastuzyn et al., 2018 ). Se, come crediamo, gli ncRNA nell’RNA estratto da animali sensibilizzati sono stati trasferiti ai neuroni di Aplysia, forse tramite vescicole extracellulari, probabilmente hanno causato uno o più effetti epigenetici che hanno contribuito all’induzione e al mantenimento dell’LTM(Fig. 2).
Ci sono state segnalazioni precedenti di trasferimenti di LTM da animali donatori addestrati a riceventi ingenui attraverso il cannibalismo (McConnell, 1962) o l’iniezione di RNA (Babichet al., 1965; Jacobson et al., 1965; Albert, 1966; Braud, 1970). Tuttavia, queste prime affermazioni sono state a lungo viste con scetticismo a causa di numerosi fallimenti nel replicare l’effetto di trasferimento della memoria(Hartry et al., 1964; Gross e Carey, 1965; Byrne et al., 1966; Luttges et al., 1966; Walker, 1966; Walker e Milton, 1966; McGaugh, 1967). I risultati negativi hanno convinto molti che i rapporti positivi del trasferimento di memoria erano attribuibili alla mancanza di controlli adeguati per i fattori indotti dalla formazione, come lo stress o l’eccitazione, e/o l’influenza di aspetti poco definiti dei metodi sperimentali utilizzati (tempo tra l’iniezione di RNA e il test comportamentale dei riceventi, metodo specifico di estrazione dell’RNA, ecc; McGaugh, 1967; Setlow, 1997).
Un grande vantaggio del nostro studio rispetto ai precedenti studi sul trasferimento della memoria è che abbiamo utilizzato un tipo di apprendimento, la sensibilizzazione del riflesso di ritiro difensivo in Aplysia, la cui base cellulare e molecolare è eccezionalmente ben caratterizzata(Kandel, 2001; Kandel, 2012; Byrne e Hawkins, 2015). L’ampia base di conoscenze sulla sensibilizzazione in Aplysia ci ha permesso di dimostrare che l’RNA da donatori sensibilizzati non solo ha prodotto un cambiamento comportamentale simile alla sensibilizzazione nei riceventi ingenui, ma ha anche causato specifiche alterazioni elettrofisiologiche dei neuroni coltivati che imitano quelli osservati negli animali sensibilizzati. I cambiamenti cellulari osservati dopo l’esposizione dei neuroni in coltura a RNA da animali addestrati rafforza significativamente il caso per il trasferimento di memoria positiva nel nostro studio.
Un’altra differenza tra il nostro studio e i precedenti tentativi di trasferimento di memoria tramite RNA è che ora c’è un meccanismo, sconosciuto 40 anni fa, per cui l’RNA può influenzare fortemente la funzione dei neuroni: le modifiche epigenetiche(Qureshi e Mehler, 2012). Infatti, il ruolo delle modifiche epigenetiche mediate da ncRNA nelle funzioni neurali, in particolare nell’apprendimento e nella memoria, è attualmente oggetto di una vigorosa indagine(Landry et al., 2013; Sweatt, 2013; Fischer , 2014; Nestler, 2014; Smalheiser, 2014; Marshall e Bredy, 2016). La nostra dimostrazione che l’inibizione della metilazione del DNA blocca l’effetto di trasferimento della memoria(Fig. 2) supporta l’ipotesi che gli effetti comportamentali e cellulari dell’RNA da Aplysia sensibilizzata nel nostro studio siano mediati, in parte, dalla metilazione del DNA(Rajasethupathy et al., 2012; vedi anche Pearce et al., 2017).
La scoperta che l’RNA da animali addestrati può trasferire l’engram per LTS in Aplysia offre un supporto drammatico all’idea che la memoria può essere immagazzinata in modo non sinaptico(Holliday, 1999; Gallistel e Balsam, 2014; Queenan et al., 2017), e indica i limiti del modello di plasticità sinaptica della conservazione di LTM(Mayford et al., 2012; Takeuchi et al., 2014). Inoltre, i nostri risultati suggeriscono che l’RNA potrebbe eventualmente essere utilizzato per modificare, o migliorare o deprimere, i ricordi.
References
- Memory in mammals: evidence for a system involving nuclear ribonucleic acid. Neuropsychologia. 1966; 4:79-92. DOI
- Retrovirus-like Gag protein Arc1 binds RNA and traffics across synaptic boutons. Cell. 2018; 172:262-274.e11. DOI | PubMed
- Transfer of a response to naive rats by injection of ribonucleic acid extracted from trained rats. Science. 1965; 149:656-657. PubMed
- Extinction in goldfish: facilitation by intracranial injection of RNA from brains of extinguished donors. Science. 1970; 168:1234-1236. PubMed
- Epigenetic reactivation of tumor suppressor genes by a novel small-molecule inhibitor of human DNA methyltransferases. Cancer Res. 2005; 65:6305-6311. DOI | PubMed
- Nonassociative learning in invertebrates. Cold Spring Harb Perspect Biol. 2015; 7:a021675. DOI | PubMed
- Memory transfer. Science. 1966; 153:658-659. PubMed
- Postsynaptic regulation of long-term facilitation in Aplysia. Curr Biol. 2008; 18:920-925. DOI | PubMed
- Reinstatement of long-term memory following erasure of its behavioral and synaptic expression in Aplysia. Elife. 2014; 3:e03896. DOI | PubMed
- Role of interneurons in defensive withdrawal reflexes in Aplysia. Learn Mem. 1995; 2:133-151. PubMed
- Cellular correlates of long-term sensitization in Aplysia. J Neurosci. 1998; 18:5988-5998. PubMed
- Epigenetic memory: the Lamarckian brain. EMBO J. 2014; 33:945-967. DOI | PubMed
- MicroRNA-22 gates long-term heterosynaptic plasticity in Aplysia through presynaptic regulation of CPEB and downstream targets. Cell Rep. 2015; 11:1866-1875. DOI | PubMed
- Monosynaptic connections made by the sensory neurons of the gill- and siphon-withdrawal reflex in Aplysia participate in the storage of long-term memory for sensitization. Proc Natl Acad Sci USA. 1985; 82:8266-8269. PubMed
- Time to rethink the neural mechanisms of learning and memory. Neurobiol Learn Mem. 2014; 108:136-144. DOI | PubMed
- cAMP modulates multiple K+ currents, increasing spike duration and excitability in Aplysia sensory neurons. Proc Natl Acad Sci USA. 1992; 89:11481-11485. PubMed
- Transfer of learned response by RNA injection: failure of attempts to replicate. Science. 1965; 150:1749. PubMed
- MiR-980 is a memory suppressor microRNA that regulates the autism-susceptibility gene A2bp1. Cell Rep. 2016; 14:1698-1709. DOI | PubMed
- Planaria: memory transfer through cannibalism reexamined. Science. 1964; 146:274-275. DOI | PubMed
- Is there an epigenetic component in long-term memory?. J Theor Biol. 1999; 200:339-341. DOI | PubMed
- Differential-approach tendencies produced by injection of RNA from trained rats. Science. 1965; 150:636-637. PubMed
- Memory trace and timing mechanism localized to cerebellar Purkinje cells. Proc Natl Acad Sci USA. 2014; 111:14930-14934. DOI | PubMed
- The molecular biology of memory storage: a dialogue between genes and synapses. Science. 2001; 294:1030-1038. DOI | PubMed
- The molecular biology of memory: cAMP, PKA, CRE, CREB-1, CREB-2, and CPEB. Mol Brain. 2012; 5:14. DOI | PubMed
- Facilitatory transmitters and cAMP can modulate accommodation as well as transmitter release in Aplysia sensory neurons: evidence for parallel processing in a single cell. Proc Natl Acad Sci USA. 1986; 83:7994-7998. DOI | PubMed
- New mechanisms in memory storage: piRNAs and epigenetics. Trends Neurosci. 2013; 36:535-542. DOI | PubMed
- Long-term potentiation of Aplysia sensorimotor synapses in cell culture: regulation by postsynaptic voltage. Proc Biol Sci. 1994; 255:113-118. DOI | PubMed
- The requirement for enhanced CREB1 expression in consolidation of long-term synaptic facilitation and long-term excitability in sensory neurons of Aplysia. J Neurosci. 2011; 31:6871-6879. DOI | PubMed
- An examination of "transfer of learning" by nucleic acid. Science. 1966; 151:834-837. DOI | PubMed
- Cognitive neuroepigenetics: the next evolution in our understanding of the molecular mechanisms underlying learning and memory?. NPJ Sci Learn. 2016; 1
- Synapses and memory storage. Cold Spring Harb Perspect Biol. 2012; 4:a005751. DOI | PubMed
- Memory transfer through cannibalism in planarians. J Neuropsychiatry. 1962; 3(Suppl 1):S42.
- Analysis of memory transfer and enhancement. Proc Am Phil Soc. 1967; 111:347-351.
- DNA methylation regulates neuronal glutamatergic synaptic scaling. Sci Signal. 2015; 8:ra61. DOI | PubMed
- Dynamic DNA methylation regulates neuronal intrinsic membrane excitability. Sci Signal. 2016; 9:ra83. DOI | PubMed
- Noncoding RNAs in long-term memory formation. Neuroscientist. 2008; 14:434-445. DOI | PubMed
- A critical period for macromolecular synthesis in long-term heterosynaptic facilitation in Aplysia. Science. 1986; 234:1249-1254. PubMed
- Epigenetic mechanisms of drug addiction. Neuropharmacology. 2014; 76:259-268. DOI | PubMed
- The neuronal gene Arc encodes a repurposed retrotransposon Gag protein that mediates intercellular RNA transfer. Cell. 2018; 172:275-288.e18. DOI | PubMed
- Role of protein synthesis and DNA methylation in the consolidation and maintenance of long-term memory in Aplysia. Elife. 2017; 6
- Non-coding RNAs as direct and indirect modulators of epigenetic regulation. Epigenetics. 2014; 9:3-12. DOI | PubMed
- Long-term sensitization of a defensive withdrawal reflex in Aplysia. Science. 1973; 182:1039-1042. PubMed
- On the research of time past: the hunt for the substrate of memory. Ann NY Acad Sci. 2017; 1396:108-125. DOI | PubMed
- Emerging roles of non-coding RNAs in brain evolution, development, plasticity and disease. Nat Rev Neurosci. 2012; 13:528-541. DOI | PubMed
- Characterization of small RNAs in Aplysia reveals a role for miR-124 in constraining synaptic plasticity through CREB. Neuron. 2009; 63:803-817. DOI | PubMed
- A role for neuronal piRNAs in the epigenetic control of memory-related synaptic plasticity. Cell. 2012; 149:693-707. DOI | PubMed
- Synaptic plasticity in vitro: cell culture of identified Aplysia neurons mediating short-term habituation and sensitization. J. Neurosci. 1986; 6:759-763. PubMed
- Extracellular vesicle-mediated transfer of genetic information between the hematopoietic system and the brain in response to inflammation. PLoS Biol. 2014; 12:e1001874. DOI | PubMed
- Engram cells retain memory under retrograde amnesia. Science. 2015; 348:1007-1013. DOI | PubMed
- Extra-coding RNAs regulate neuronal DNA methylation dynamics. Nat Commun. 2016; 7:12091. DOI | PubMed
- The mneme. George Allen: London; 1921.
- Georges Ungar and memory transfer. J Hist Neurosci. 1997; 6:181-192. DOI | PubMed
- Exosomal transfer of proteins and RNAs at synapses in the nervous system. Biol Direct. 2007; 2:35. DOI | PubMed
- The RNA-centred view of the synapse: non-coding RNAs and synaptic plasticity. Philos Trans R Soc Lond B Biol Sci. 2014; 369
- The emerging field of neuroepigenetics. Neuron. 2013; 80:624-632. DOI | PubMed
- The synaptic plasticity and memory hypothesis: encoding, storage and persistence. Philos Trans R Soc Lond B Biol Sci. 2014; 369:20130288. DOI | PubMed
- The activity-induced long non-coding RNA Meg3 modulates AMPA receptor surface expression in primary cortical neurons. Front Cell Neurosci. 2017; 11:124. DOI | PubMed
- Communication by extracellular vesicles: where we are and where we need to go. Cell. 2016; 164:1226-1232. DOI | PubMed
- Extracellular miRNAs: the mystery of their origin and function. Trends Biochem Sci. 2012; 37:460-465. DOI | PubMed
- Circulating miRNAs: cell-cell communication function?. Front Genet. 2013; 4:119. DOI | PubMed
- Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007; 9:654-659. DOI | PubMed
- Memory transfer in planarians: an artifact of the experimental variables. Psychonom Sci. 1966; 5:357-358. DOI
- Memory transfer vs. sensitization in cannibal planarians. Psychonom Sci. 1966; 5:293-294. DOI
- Multiple sensory neuronal correlates of site-specific sensitization in Aplysia. J Neurosci. 1987; 7:408-417. PubMed
- Neurons secrete miR-132-containing exosomes to regulate brain vascular integrity. Cell Res. 2017; 27:882-897. DOI | PubMed
- Epigenetic regulation of memory formation and maintenance. Learn Mem. 2013; 20:61-74. DOI | PubMed
Fonte
Bédécarrats A, Chen S, Pearce K, Cai D, Glanzman DL, et al. (2018) RNA from Trained . eNeuro 5(3): ENEURO.0038-18.2018. https://doi.org/10.1523/ENEURO.0038-18.2018





