Abstract
Introduzione
La valutazione della sicurezza dei candidati farmaci è cruciale per la scoperta di farmaci, consentendo lo sviluppo di farmaci che raggiungono gli effetti terapeutici desiderati con il minor rischio di effetti collaterali negativi. Le indagini normative precliniche e gli studi clinici sono progettati per affrontare la sicurezza dei farmaci candidati ed eliminare quelli che non soddisfano le aspettative di rischio-beneficio(Cook et al., 2014). Tuttavia, l’accesso limitato ad una vasta e diversificata popolazione di pazienti negli studi clinici, la co-somministrazione di farmaci non testati, come spesso accade, soprattutto con pazienti anziani che assumono più farmaci, e lo sviluppo di ADR associati al trattamento cronico, si traduce spesso in un’etichettatura post-marketing e in occasionali ritiri occasionali(Wysowski e Swartz, 2005; Lasser et al., 2002; Friedman et al., 1999; Downing et al., 2017). Pertanto, la farmacovigilanza post-marketing è essenziale per tenere traccia degli ADR e, in ultima analisi, ridurre oltre 1 milione di gravi effetti collaterali legati ai farmaci che si verificano ogni anno negli USA. Tra il 5% e il 10% di questi effetti collaterali sono mortali (Lazarou etal., 1998), e molti altri causano sofferenza ai pazienti, ospedalizzazione e aumento del carico del sistema sanitario (Moore etal., 1998). In effetti, il tasso di mortalità attribuito agli ADR li colloca tra le prime cause di morte negli USA (oltre 40.000 nel 2011), analogamente alla mortalità per suicidio(Hoyert e Xu, 2012).
Strumenti determinanti nella farmacovigilanza post-marketing sono i database che aggregano le segnalazioni ADR. Il più importante tra questi è il sistema di segnalazione degli eventi avversi della FDA (FAERS), che è forse il più esteso e tra i più accessibili di questi database, che attualmente contiene oltre 8,5 milioni di segnalazioni e in rapida crescita(U.S. Food and Drug Administration, 2016). FAERS e i relativi database, come quelli dell’EMEA e di Health Canada, possono fornire specifici fenotipi ADR tipici sia per singole classi di farmaci che per specifiche indicazioni e sono accessibili sia direttamente(U.S. Food and Drug Administration, 2016) sia tramite API(RELX Intellectual Properties SA, 2016; U.S. Food and Drug Administration, 2016). Questi database di eventi avversi su larga scala consentono di mettere in relazione fenotipi e composti clinici(Tatonetti et al., 2012), e sono stati ampiamente utilizzati dalla comunità clinica con grande impatto(O’Connell et al., 2006; Elashoff et al., 2011; Lawrence et al., 2006; Mackey et al., 2007).
È una proposta allettante sfruttare la pura e semplice scala di FAERS per individuare le associazioni farmaco-ADR che altrimenti verrebbero a mancare. Una sfida in questo senso è stata rappresentata dall’eterogeneità delle fonti di dati e dalla conflazione dei dati nel database.
FAERS, pur fornendo una solida cornice per la reportistica, contiene ridondanze, distorsioni e conflazioni che influenzano la sua analisi e interpretazione(McAdams et al., 2008). La nostra capacità di correlare i farmaci con i loro effetti è oscurata da qualcosa di semplice come il groviglio di sinonimi di farmaci in FAERS – in media 16 nomi diversi per i farmaci contenenti ogni principio attivo – che possono oscurare le associazioni.
Qui, investighiamo gli effetti che queste conflazioni di dati, inflazioni e imprecisioni possono avere sull’ADR e l’inferenza meccanicistica da parte di FAERS, e i metodi per affrontarli. Cominciamo con la mappatura degli identificatori dei farmaci in FAERS alle strutture chimiche normalizzate dei loro ingredienti, che riunisce le osservazioni sulla “droga completa”, non solo i nomi e i sinonimi particolari dei farmaci, che rimangono incompleti. Mappati a strutture chimiche uniche, abbiamo potuto calcolare i profili risolti nel tempo delle associazioni droga-ADR, che hanno rivelato intriganti comorbidità e somiglianze di ADR tra le droghe, e della loro evoluzione temporale. Ci siamo poi rivolti alle origini e ai controlli per la segnalazione dei pregiudizi nelle FAERS, considerando la segnalazione stimolata e le diverse comunità diverse, spesso non mediche, che possono contribuire alle FAERS. Questo è stato facilitato da un’analisi dell’evoluzione temporale delle segnalazioni di ADR e della sua correlazione con gli eventi di cronaca contemporanea. Illustriamo come questi pregiudizi possono ramificarsi con un’analisi approfondita del contenuto di FAERS su due inibitori COX-2, rofecoxib e celecoxib, e con due agonisti PPAR-γ, rosiglitazone e pioglitazone. Come esempi di come queste analisi possano collegare gli ADR a target specifici, consideriamo i profili ADR differenziali dei farmaci utilizzati per il trattamento del disturbo da deficit di attenzione e iperattività (ADHD), e come i loro ADR distinti possano essere spiegati in parte da target molecolari – una logica che viene spesso utilizzata – combinata con l’esposizione farmacocinetica – che viene spesso trascurata. Allo stesso modo, studiamo la differenziazione degli effetti collaterali ipertensivi degli inibitori VEGF-Receptor (VEGF-R2) in base alla loro potenza e ai profili farmacocinetici (PK). Le precauzioni e i metodi che descriviamo, possono consentire agli investigatori di utilizzare i FAERS con maggiore sicurezza ed evitare di confondere le associazioni basate sulla chimica e di segnalare i pregiudizi. Questo studio illustra anche come l’analisi comparativa degli ADR possa rivelare i meccanismi sottostanti ed evidenziare il valore di traduzione inversa nel processo di scoperta del farmaco.
Risultati
Analisi dei contenuti: tendenze inaspettate nel reporting FAERS
Il database FAERS contiene oltre 8,5 milioni di report ed è in costante crescita (oltre 1.320.000 report aggiunti nel 2015; Figura 1A. Abbiamo estratto 8.749.375 rapporti FAERS, mappati a 7.095.566 casi individuali. Spesso le condizioni di un paziente sono monitorate su un arco di più segnalazioni, che devono essere considerate quando si indaga sull’incidenza di una particolare associazione farmaco-ADR (U.S.Food and Drug Administration, 2016).10.7554/eLife.25818.003Figure 1.General information of the FDA Adverse Event Reporting System (FAERS) content (1997-2015).(A) Il numero cumulativo di segnalazioni in FAERS è mostrato nel pannello superiore; il pannello inferiore mostra il numero di nuove segnalazioni per trimestre.(B) Distribuzione delle identità dei reporter. I dati si basano sulle segnalazioni presentate tra il 2° trimestre 2002 (identificazione dei soggetti segnalanti iniziata in questo periodo) e il 4° trimestre 2015.(C) Distribuzione delle segnalazioni in base ai 7 risultati ADR definiti in FAERS.DOI:http://dx.doi.org/10.7554/eLife.25818.003
L’inflazione dei rapporti per moltiplicazione può aumentare l’apparente significato di un’associazione droga – effetto avverso, in particolare quando il numero totale di rapporti è basso. Per identificare sistematicamente i casi più simili, abbiamo confrontato tutte le coppie di segnalazioni utilizzando i dati demografici e le prescrizioni. Quasi l’1% delle segnalazioni in FAERS (61.780 casi) rappresentano casi di inserimento multiplo con farmaci identici, identici ADR, date degli eventi, età e sesso del paziente(File supplementare 1). È interessante notare che solo la metà delle segnalazioni in FAERS è stata presentata da operatori sanitari(Figura 1B). Oltre un terzo di essi (3,2 milioni) sono stati avviati dai pazienti stessi e il 9% sono stati etichettati come “non specificati”. Gli avvocati hanno riportato il 3% di tutti i casi di FAERS(Figura 1B).
FAERS utilizza sette descrittori dei risultati dei rapporti: “Morte”, “Minaccia di vita”, “Disabilità”, “Anomalia congenita”, “Intervento necessario per prevenire danni permanenti”, “Ricovero ospedaliero – iniziale o prolungato” e “Altro”. Tra questi, solo ‘Altro’ è usato per riportare risultati relativamente benigni. Inaspettatamente, solo il 40% circa degli esiti è stato identificato come “benigno”, mentre quasi il 15% dei casi segnalati è risultato essere mortale (Figura 1C). È una caratteristica della segnalazione in un database di presentazione aperto come FAERS che questo rapporto non riflette il vero equilibrio tra gli ADR di farmaci fatali e quelli relativamente benigni, ma piuttosto il rapporto degli ADR che si ritiene meritino di essere segnalati.
Tra le 945.526 segnalazioni in cui la morte è il risultato dell’ADR, 42.526 sono state collegate all’arresto cardiaco e 50.155 al suicidio. I principali ingredienti molecolari dei farmaci che erano sospetti primari nelle segnalazioni di decesso erano rosiglitazone: 17.165 (indicazione diabete di tipo II), rofecoxib: 11.386 (indicazioni primarie: artrite, dolore; ritirato dalla clinica), reteplasi: 11.386 (indicazione di infarto miocardico acuto (MI)), e talidomide: 17.104 (indicazione di mieloma multiplo; inoltre, 26.429 casi di morte sono stati attribuiti al lenalidomide, un derivato della talidomide prescritto anche per il mieloma). Per farmaci come il rofecoxib o il rosiglitazone, che sono prescritti per malattie gestibili e non mortali, si può ragionevolmente dedurre che l’ADR ha portato alla morte. Analogamente, un confronto tra il celecoxib (numero di decessi riportati: 4.066; Standardized Mortality Ratio [SMR][Everitt e Skrondal, 2010]: 1,3) e il rofecoxib, che sono prescritti per la stessa indicazione, evidenzia un SMR significativamente più elevato dei pazienti che assumono quest’ultimo farmaco (SMR: 5)(Rostom et al., 2007). Tuttavia, l’attribuzione della morte come ADR della talidomide quando viene utilizzata per il trattamento del mieloma multiplex, una malattia maligna e potenzialmente letale(Singhal et al., 1999) può essere difficile da sostenere; sembra probabile che l'”ADR” qui rifletta il cancro che il farmaco è destinato a trattare. Allo stesso modo, l’infarto miocardico acuto che la reteplasi è usata per il trattamento(Wooster e Luzier, 1999) può essere la causa di molti dei decessi ADR con cui il farmaco è catramato, non il farmaco stesso. Quando un farmaco viene usato per trattare una malattia potenzialmente letale, è necessario prestare attenzione nell’interpretare la morte come un ADR di quel farmaco.
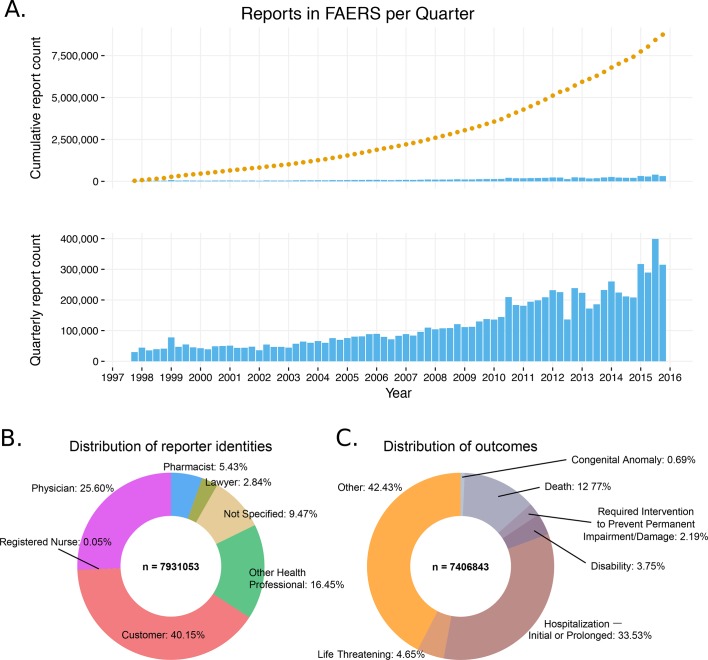
Figura 1.Informazioni generali sul contenuto del sistema FDA di segnalazione degli eventi avversi (FAERS) (1997-2015).(A) Il numero cumulativo di segnalazioni in FAERS è mostrato nel pannello superiore; il pannello inferiore mostra il numero di nuove segnalazioni per trimestre.(B) Distribuzione delle identità dei reporter. I dati si basano sulle segnalazioni presentate tra il 2° trimestre 2002 (identificazione dei soggetti segnalanti iniziata in questo periodo) e il 4° trimestre 2015.(C) Distribuzione delle segnalazioni in base ai 7 risultati ADR definiti in FAERS.DOI:
http://dx.doi.org/10.7554/eLife.25818.003
La mappatura dei farmaci in base ai loro ingredienti molecolari migliora il recupero del segnale
Nella maggior parte degli studi FAERS, i farmaci sono identificati utilizzando RxNorm(Wang et al., 2013; Nelson et al., 2011), un insieme di sinonimi di farmaci forniti dalla National Library of Medicine. Questa mappatura è sufficiente per le domande che possono essere poste a FAERS da un professionista clinico, come i segnali di sicurezza per una particolare formulazione del farmaco. Tuttavia, i prodotti che hanno identità diverse in risorse come RxNorm condividono ingredienti molecolari comuni e sono molto simili nelle loro attività su bersagli molecolari. Per studiare gli ADR associati alla fluoxetina, ad esempio, è necessario aggregare i suoi 378 diversi sinonimi. Senza tale aggregazione, i noti effetti collaterali della fluoxetina, come le disfunzioni sessuali, diventano statisticamente insignificanti (quattro casi in cui si considera solo il sinonimo di fluoxetina Prozac; Relative Reporting Ratio [RRR] = 1.75; q-valore q = 1), mentre una volta aggregati, questi ADR spiccano chiaramente (87 casi; RRRR = 6,67; q-valore = 2,56-10-96). Al contrario, nella sua forma non aggregata, il Prozac sembra avere associazioni statisticamente significative con l’anomalia dei cromosomi sessuali (un caso; RRR = 2,96; valore q = 2-10-3). Aggregata, tuttavia, questa associazione diventa insignificante (un caso; RRR = 2,78; q-valore = 1). Per coloro che sono interessati alla base molecolare delle azioni dei farmaci e degli effetti collaterali, un modo semplice per interrogare i farmaci come molecole è fondamentale.
Di conseguenza, abbiamo mappato i principi attivi dei farmaci in oltre il 98% dei rapporti utilizzando una combinazione di elaborazione del linguaggio naturale e di database multipli di sinonimi (vedi Materiali e metodi). Questo valore non solo è paragonabile al riconoscimento dell’81% ottenuto utilizzando solo i sinonimi in RxNorm, ma ci ha permesso di cercare associazioni che si basano su ricerche standard basate sulla cheminformatica. Sorprendentemente, dei 2729 ingredienti unici identificati, solo 1892 sono stati annotati come sospetti primari in almeno un rapporto; detto in modo diverso, 837 ingredienti attivi di farmaci non hanno riportato alcun tipo di ADR. Una trama degli ingredienti che sono stati associati agli ADR mostra che la distribuzione è in declino esponenziale, con il 90% degli ADR attribuiti al 40% degli ingredienti del farmaco(Figura 2). Dopo la correzione della distribuzione per gli ADR con valori q migliori di 0,05, il 90% può essere attribuito al 46% dei farmaci esaminati. Questa mappatura degli ingredienti è stata utilizzata nel corso delle analisi successive (vedi Materiali e metodi e Materiale supplementare).10.7554/eLife.25818.004Cifra 2.Istogrammi che mostrano la distribuzione del numero di ADR che sono stati attribuiti agli ingredienti unici.(A) Tutti gli ingredienti osservati – coppie ADR.(B) Coppie osservate al di sotto del taglio del valore q di 0.05.DOI:http://dx.doi.org/10.7554/eLife.25818.004
Come previsto, la mappatura dei farmaci in base ai loro principi attivi, e non basandosi semplicemente sull’aggregazione dei sinonimi, ha rafforzato la forza dei segnali del farmaco-ADR. Ad esempio, il farmaco antinfiammatorio non steroideo (FANS) indometacina è usato per trattare il dolore cronico e la febbre(MedicinesComplete, 2014). Quando abbiamo valutato l’indometacina come ingrediente, un forte segnale l’ha collegata all’ulcera gastrica (RRRR = 10,40; valore q = 3,65-10-72) e all’emorragia dell’ulcera gastrica (RRRR = 7,99; valore q = 6,78-10-18). Questi eventi avversi sono noti dalle etichette dei farmaci contenenti indometacina, confermate anche nel World Drug Index (WDI)(Thomson Scientific, 2016). Tuttavia, quando abbiamo cercato i nomi commerciali dei farmaci in cui viene utilizzata l’indometacina (RxNorm synonym matching), questi segnali sono stati dissipati nel rumore: il segnale più forte per l’ulcera gastrica è sceso a RRR = 1.79, q-valore = 1,00; il segnale più forte per l’emorragia dell’ulcera gastrica è sceso a RRR = 2,42, q-valore = 1,00.
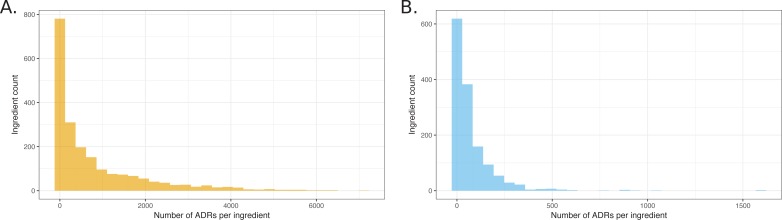
Figura 2.Istogrammi che mostrano la distribuzione del numero di ADR che sono stati attribuiti ad ingredienti unici.(A) Tutti gli ingredienti osservati – coppie di ADR.(B) Coppie osservate al di sotto del taglio del valore q di 0,05.DOI:
http://dx.doi.org/10.7554/eLife.25818.004
Pregiudizio nella rendicontazione ADR per indicazione, cambiamenti nell’ambiente normativo, clinico, sociale e legale
A volte gli ADR sono in conflitto con le indicazioni, e viceversa. Un esempio è un rapporto di rosiglitazone prescritto per il diabete mellito di tipo 2, con l’ADR nel rapporto anche per il diabete mellito(Tabella 1). In un altro rapporto, il rosiglitazone è stato identificato come il principale sospetto per l’insufficienza cardiaca congestizia, così come un agente terapeutico che è stato prescritto per la stessa condizione(Tabella 1). Abbiamo quantificato questa distorsione dell’indicazione sia a livello globale che nel tempo. Circa il 5% di tutti i rapporti relativi a qualsiasi farmaco descrive l’indicazione del farmaco come un evento avverso. Il numero di segnalazioni in cui sono stati riportati lo stesso ADR e la stessa indicazione è aumentato linearmente con il numero crescente di segnalazioni annuali fino al 2011, seguito da un calo improvviso(Figura 3). Potremmo tracciare una presentazione di “aggiornamento” consultiva della FDA sulle linee guida delle segnalazioni ADR per gli studi clinici fino alla data di entrata in vigore del 28 marzo 2011 (Devine, 2016). Questo documento fornisce chiare istruzioni ai soggetti che hanno presentato le relazioni per distinguere tra le condizioni preesistenti e gli ADR e, in effetti, potrebbe aver avuto un effetto significativo sulla qualità delle relazioni.10.7554/eLife.25818.005Figure 3.Relazioni con indicazioni o ADR erroneamente identificate.(A) Numero totale di relazioni in un dato anno in cui sono state riportate la stessa indicazione e l’ADR. (B) Numero di relazioni in un dato anno in cui il diabete è stato dichiarato come la reazione avversa causata dal rosiglitazone.DOI:http://dx.doi.org/10.7554/eLife.25818.00510.7554/eLife.25818.006Table1.Confusione di ADR con le indicazioni. Per il primo caso, il rosiglitazone prescritto per il diabete (Indicazione) è identificato come il principale sospetto (PS) per la causa del diabete mellito come ADR. Nel secondo caso, l’indicazione “insufficienza cardiaca congestizia congestizia” è data come indicazione per il rosiglitazone con l’ADR riportato di “insufficienza cardiaca congestizia congestizia”. Il terzo caso esemplifica la corretta segnalazione, dove sia l’ADR che l’indicazione di rosiglitazone sono riportati correttamente.DOI:http://dx.doi.org/10.7554/eLife.25818.006ReportCaseADRDrug/ Ruolo / Indicazione 6545021179039Diabete mellitoRosiglitazone/PS/Diabete mellito 5521616162007Cardiac failure congestiveRosiglitazone/PS/Cardiac failure congestive 6380841417085373Cardiac failure congestiveRosiglitazone/PS/Diabetes mellitus
Abbiamo dato un’occhiata più da vicino alle segnalazioni del rosiglitazone, dove l’insorgenza del diabete come effetto collaterale è stata attribuita all’uso di questo farmaco con relativa frequenza fino al 2004 (questa associazione ovviamente errata è significativa se considerata nella finestra di segnalazione del rosiglitazone (fino al 2011), con un RRRR = 1,57 e un valore q <10-5). Dopo il 2004, questa associazione è diminuita, così come le prescrizioni generali e la segnalazione di questo farmaco, a causa dei suoi effetti collaterali cardiovascolari ampiamente segnalati(Mannucci et al., 2010; Nissen e Wolski, 2007). In generale, un semplice confronto tra le indicazioni e gli ADR segnalati riduce la distorsione della ripetizione alla lettera.
Abbiamo applicato questi metodi per indagare su come le segnalazioni dei singoli farmaci cambiano nel tempo. In particolare, abbiamo monitorato il numero totale di segnalazioni presentate e l’incidenza degli eventi avversi segnalati preferibilmente in diversi punti temporali. Quando le segnalazioni sono ordinate in base alle date degli eventi in FAERS, si verificano “picchi” il primo giorno di ogni mese e picchi ancora più grandi il primo giorno di ogni anno. È importante notare che i segnali ADR gravi per i farmaci mostrano un aumento dipendente dal tempo (vedi Figure 4A, 5A, 6A e Figura 7A). I cambiamenti nelle associazioni droga-AdR nel tempo possono, naturalmente, riflettere nuove popolazioni a cui il farmaco è esposto.10.7554/eLife.25818.007Figure 4.Submission pattern and time evolution of rofecoxib FAERS reports.(A) Numero di segnalazioni (al giorno) in cui il rofecoxib è stato segnalato come sospetto principale. I punti rossi rappresentano eventi che hanno un impatto importante sul modello di segnalazione del rofecoxib da parte di FAERS.(B) Percentuale relativa di partecipazione di tutti gli ADR a livello di “termine preferito” (PT) osservati per il rofecoxib. Ogni ADR è rappresentato da un colore separato. I periodi di tempo caratteristici sulla linea temporale di questo farmaco sono delimitati da linee (associate ad eventi definitivi), e numerati. Le frazioni mensili di ADR qui mostrate sono anche riportate nel file supplementare 1.(C) Identità di coloro che segnalano l’ADR del rofecoxib nei vari periodi di segnalazione, contrassegnati in corrispondenza delle annotazioni in numeri romani nel pannello B. (D) Cluster di ADR basati sull’arricchimento (incidente cerebrovascolare e infarto del miocardio) osservati nei rapporti sul rofecoxib tra il 1997 e il 2006.DOI:http://dx.doi.org/10.7554/eLife.25818.00710.7554/eLife.25818.008Figure5.Storia dei rapporti FAERS sul celecoxib.(A) Numero di rapporti FAERS (al giorno) in cui il celecoxib è stato segnalato come sospetto principale.(B) Percentuale relativa di partecipazione di tutti gli ADR a livello di PT osservati per il celecoxib. Ogni ADR è rappresentato da un colore distinto. I periodi di tempo caratteristici sulla linea temporale di questo farmaco sono contrassegnati da linee e numerati. Le frazioni mensili di ADR qui mostrate sono anche riportate nel file supplementare 1.(C) Numero mensile di segnalazioni in cui il celecoxib era il principale sospetto; ogni riga corrisponde a un ADR a livello di PT separato. Il grafico in alto descrive tutte le segnalazioni con celecoxib come sospetto principale. Nel grafico in basso sono state omesse le segnalazioni in cui era presente anche il rofecoxib. I colori sono abbinati a quelli utilizzati nel pannello B.(D) I cluster basati sull’arricchimento degli ADR più frequentemente riportati (incidente cerebrovascolare e infarto del miocardio) osservati nei rapporti ccoxib. I colori corrispondono a quelli di B e C. Si noti che questo grafico non corrisponderà esattamente al pannello B, perché gli arricchimenti qui presentati mostrano il rapporto del numero di eventi osservati in un dato anno rispetto a quello che ci si aspetterebbe a caso, mentre le tracce in B mostrano una proporzione di un dato ADR rispetto ad altri ADR in un dato periodo di tempo.(E) Identità di coloro che segnalano gli ADR celecoxib in vari periodi di segnalazione, contrassegnati in modo da corrispondere alle annotazioni in numeri romani nel pannello B. DOI:http://dx.doi.org/10.7554/eLife.25818.00810.7554/eLife.25818.009Figure6.Segnalazioni di rosiglitazone.(A) Numero di segnalazioni FAERS (al giorno) in cui il rosiglitazone è stato segnalato come sospetto principale.(B) Percentuale di partecipazione al mese di tutti gli ADR a livello di PT osservati per il rosiglitazone. Ogni ADR è rappresentato da un colore distinto. I periodi di tempo caratteristici sulla linea temporale di questo farmaco sono delimitati da linee e numerati. Le frazioni mensili di ADR qui mostrate sono anche riportate nel file supplementare 1.(C) Identità di coloro che segnalano l’ADR del rosiglitazone in vari periodi di segnalazione, contrassegnati in modo da corrispondere alle annotazioni in numeri romani nel pannello B. (D) Cluster di ADR basati sull’arricchimento osservati nei rapporti sul rosiglitazone.DOI:http://dx.doi.org/10.7554/eLife.25818.00910.7554/eLife.25818.010Figure7.Il panorama delle segnalazioni di pioglitazone.(A) Numero di segnalazioni FAERS (al giorno) in cui il pioglitazone è stato segnalato come sospetto principale.(B) Percentuale di partecipazione al mese di tutti gli ADR a livello di PT è stata osservata per il pioglitazone. Ogni ADR è rappresentato da un colore distinto. I periodi di tempo caratteristici sulla linea temporale di questo farmaco sono contrassegnati da linee e numerati. Le frazioni mensili di ADR qui riportate sono riportate anche nel file supplementare 1.(C) Numero mensile di segnalazioni in cui il pioglitazone era il principale sospetto; ogni riga corrisponde a un ADR a livello di PT separato. Il grafico nella parte superiore del pannello mostra il numero di volte in cui sono stati segnalati singoli ADR, e in basso i corrispondenti arricchimenti mensili. Le tracce per l’insufficienza cardiaca sono state contraddistinte dal colore blu.(D) Cluster basati sull’arricchimento di ADR correlati al cancro osservati nei rapporti sul pioglitazone.(E) Identità di coloro che segnalano l’ADR da pioglitazone in vari periodi di segnalazione, contrassegnati per corrispondere alle annotazioni in numeri romani nel pannello B. (F) Struttura di rosiglitazone e pioglitazone.DOI:http://dx.doi.org/10.7554/eLife.25818.010
Abbiamo valutato l’evoluzione temporale dei rapporti di rofecoxib, un farmaco antinfiammatorio non steroideo (FANS) che allevia il dolore attraverso l’inibizione della COX-2(Figura 4). Diversi eventi importanti si sono verificati nel corso della vita clinica del rofecoxib dopo la sua approvazione da parte della FDA nel 1999: (1) Uno studio clinico di Bombardier et al. pubblicato nel novembre 2000 ha concluso che il rofecoxib ha aumentato il rischio di eventi cardiovascolari(Bombardier et al., 2000). (2) Introduzione delle avvertenze per gli eventi cardiovascolari sulle etichette di Vioxx (un marchio di rofecoxib) nell’aprile 2002. (3) Ritiro del rofecoxib dal mercato il 30 settembre 2004.
L’infarto del miocardio (RRR = 17,85; q-valore <10-5) e l’incidente cerebrovascolare (RRRR = 17,69; q-valore <10-5) hanno rappresentato una larga parte degli ADR segnalati per il rofecoxib dalla sua introduzione nel 1999 (Figura 4B e D). Prima dello studio di Bombardier et al. (2000), la maggior parte dei rapporti sono stati archiviati da medici. Tra la pubblicazione di Bombardier e l’introduzione dell’etichetta di avvertimento, questi rapporti dei medici sono rimasti costanti, mentre il numero di rapporti degli avvocati è cresciuto in modo sostanziale. Dopo l’introduzione dell’etichetta di avvertimento, il numero di segnalazioni dei medici è leggermente diminuito, ma la tendenza ad attribuire l’infarto del miocardio e l’incidente cerebrovascolare alla somministrazione di rofecoxib è stata ulteriormente cementata da coloro che si sono identificati come avvocati (vedi Figura 4C).
Abbiamo anche esaminato l’evoluzione temporale di un altro FANS inibitore della COX-2, il celecoxib, approvato dalla FDA nel dicembre 1998, poco prima di Vioxx(Figura 5). L’ispezione della linea temporale dei rapporti sul celecoxib mostra un leggero aumento del numero di rapporti intorno al settembre 2004, che riflette l’aumento dell’uso associato al ritiro del rofecoxib(Figura 5A). Fino a dicembre 2004, il modello di ADR nei rapporti sul celecoxib è dominato dall’incidente cerebrovascolare (RRR mensile fino a ~35) e dall’infarto del miocardio (RRR mensile fino a ~45) in modo simile a quello dei rapporti sul rofecoxib (Figura 5Be Figura 5D) . L’aumento del numero complessivo di segnalazioni intorno al settembre 2004 ha coinciso con le preoccupazioni sulla sicurezza del celecoxib, che probabilmente riflette un rapporto di aumento del rischio di eventi cardiovascolari in pazienti che hanno usato il celecoxib sistematicamente per periodi di tempo prolungati(Solomon et al., 2005). Abbiamo verificato se le tendenze nella segnalazione degli effetti collaterali del celecoxib fossero influenzate dalla co-somministrazione di rofecoxib, ma la distribuzione degli ADR è stata quasi identica dopo aver escluso l’8% delle segnalazioni in cui il rofecoxib era presente come farmaco concomitante(Figura 5C). Un esame più attento di questo schema ha rivelato che le segnalazioni durante questo periodo di tempo sono state in gran parte presentate da avvocati e da persone “non identificate”, mentre il contributo degli operatori sanitari è rimasto costante molto al di sotto del livello delle segnalazioni per il rofecoxib (Figura 5E). Queste tendenze sono state confermate dalla modellazione della regressione logistica (vedi Materiali e metodi e Supplemento 2), che ha mostrato che le segnalazioni di infarto del miocardio erano significativamente correlate con le segnalazioni di celecoxib presentate dagli avvocati prima del 2005 (Modello quattro nel Supplemento 2). Abbiamo anche considerato la moratoria Pfizer sulla pubblicità diretta al consumatore nel 2004 come un evento significativo sulle vendite e di conseguenza sulle segnalazioni ADR(Consumers Union and Consumer Reports Best Buy Drugs, 2005). Dopo il caso Vioxx, la FDA ha emesso una nuova etichettatura non solo per la selettività del COX-2, ma per tutti i FANS che stabiliscono nuovi standard di sicurezza per il settore antinfiammatorio(U.S. Food and Drug Administration, 2016). Mentre Vioxx è stato rimosso dalla clinica, Celebrex ha goduto di una rinascita dopo il 2004, in particolare come unico FANS selettivo per COX-2 nella clinica e a causa delle etichette aggiornate per altri FANS. Pfizer ha ripreso un’attenta pubblicità con un chiaro riferimento agli effetti collaterali che hanno aiutato il recupero dell’uso clinico del celecoxib. Mentre abbiamo esaminato questi effetti stimolanti, abbiamo anche riconosciuto che il volume delle vendite era destinato a crescere, ma non siamo stati in grado di determinare il volume a causa di una coincidente interferenza con l’aumento dei prezzi(Schondelmeyer e Purvis, 2014). Questo caso dimostra chiaramente la complessità delle prestazioni dei farmaci nell’ambiente post-marketing in cui il reporting ADR potrebbe essere significativamente modificato da molteplici fattori, compresi gli aspetti normativi e sociali.
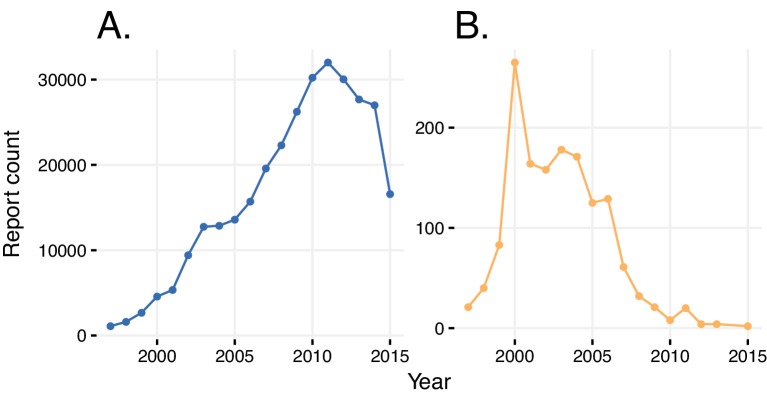
Figura 3.Rapporti con indicazioni o ADR erroneamente identificati.(A) Numero totale di segnalazioni in un dato anno in cui sono state segnalate la stessa indicazione e la stessa ADR. (B) Numero di segnalazioni in un dato anno in cui il diabete è stato dichiarato come reazione avversa causata dal rosiglitazone.DOI:
http://dx.doi.org/10.7554/eLife.25818.005
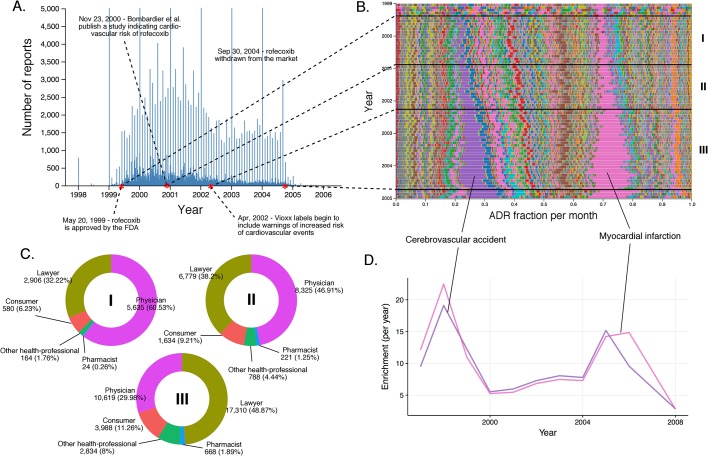
Figura 4.Schema di presentazione ed evoluzione temporale dei rapporti di rofecoxib FAERS.(A) Numero di rapporti (al giorno) in cui il rofecoxib è stato segnalato come sospetto principale. I punti rossi rappresentano eventi che hanno un impatto importante sul modello di segnalazione del rofecoxib da parte di FAERS.(B) Percentuale relativa di partecipazione di tutti gli ADR a livello di “termine preferito” (PT) osservati per il rofecoxib. Ogni ADR è rappresentato da un colore separato. I periodi di tempo caratteristici sulla linea temporale di questo farmaco sono delimitati da linee (associate ad eventi definitivi), e numerati. Le frazioni mensili di ADR qui mostrate sono anche riportate nel file supplementare 1.(C) Identità di coloro che segnalano l’ADR del rofecoxib nei vari periodi di segnalazione, contrassegnati in corrispondenza delle annotazioni in numeri romani nel pannello B. (D) Cluster di ADR basati sull’arricchimento (incidente cerebrovascolare e infarto del miocardio) osservati nei rapporti sul rofecoxib tra il 1997 e il 2006.DOI:
http://dx.doi.org/10.7554/eLife.25818.007
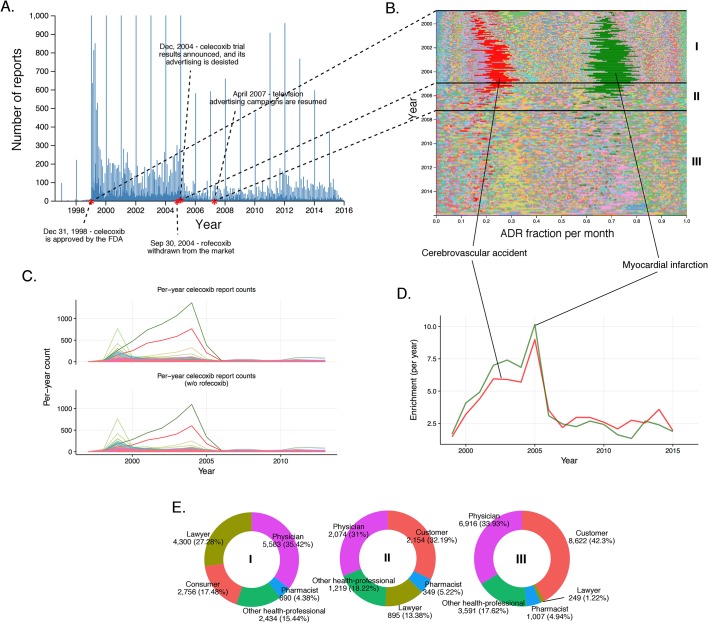
Figura 5.Storia dei rapporti di FAERS sul celecoxib.(A) Numero di rapporti FAERS (al giorno) in cui il celecoxib è stato segnalato come sospetto principale.(B) Percentuale relativa di partecipazione di tutti gli ADR a livello di PT osservati per il celecoxib. Ogni ADR è rappresentato da un colore distinto. I periodi di tempo caratteristici sulla linea temporale di questo farmaco sono contrassegnati da linee e numerati. Le frazioni mensili di ADR qui mostrate sono anche riportate nel file supplementare 1.(C) Numero mensile di segnalazioni in cui il celecoxib era il principale sospetto; ogni riga corrisponde a un ADR a livello di PT separato. Il grafico in alto descrive tutte le segnalazioni con celecoxib come sospetto principale. Nel grafico in basso sono state omesse le segnalazioni in cui era presente anche il rofecoxib. I colori sono abbinati a quelli utilizzati nel pannello B.(D) I cluster basati sull’arricchimento degli ADR più frequentemente riportati (incidente cerebrovascolare e infarto del miocardio) osservati nei rapporti ccoxib. I colori corrispondono a quelli di B e C. Si noti che questo grafico non corrisponderà esattamente al pannello B, perché gli arricchimenti qui presentati mostrano il rapporto del numero di eventi osservati in un dato anno rispetto a quello che ci si aspetterebbe a caso, mentre le tracce in B mostrano una proporzione di un dato ADR rispetto ad altri ADR in un dato periodo di tempo.(E) Identità di coloro che segnalano gli ADR celecoxib in vari periodi di riferimento, contrassegnati in modo da corrispondere alle annotazioni in numeri romani nel pannello B.DOI:
http://dx.doi.org/10.7554/eLife.25818.008
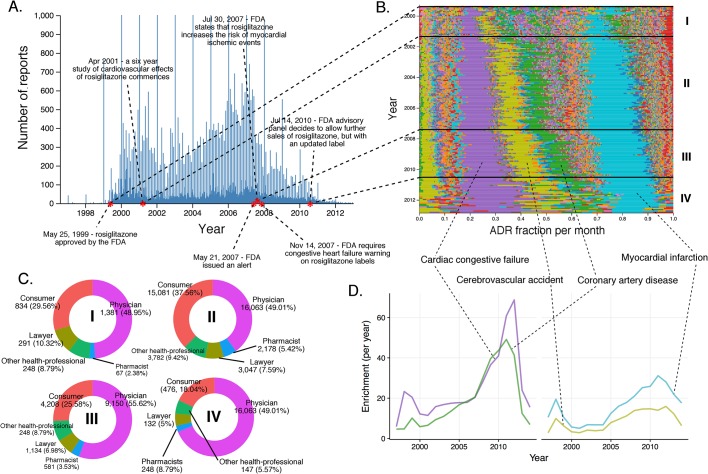
Figura 6.Rapporti di Rosiglitazone.(A) Numero di rapporti FAERS (al giorno) in cui il rosiglitazone è stato segnalato come sospetto principale.(B) Percentuale di partecipazione al mese di tutti gli ADR a livello di PT osservati per il rosiglitazone. Ogni ADR è rappresentato da un colore distinto. I periodi di tempo caratteristici sulla linea temporale di questo farmaco sono delimitati da linee e numerati. Le frazioni mensili di ADR qui mostrate sono anche riportate nel file supplementare 1.(C) Identità di coloro che segnalano l’ADR del rosiglitazone in vari periodi di segnalazione, contrassegnati in modo da corrispondere alle annotazioni in numeri romani nel pannello B. (D) Cluster di ADR basati sull’arricchimento osservati nei rapporti sul rosiglitazone.DOI:
http://dx.doi.org/10.7554/eLife.25818.009
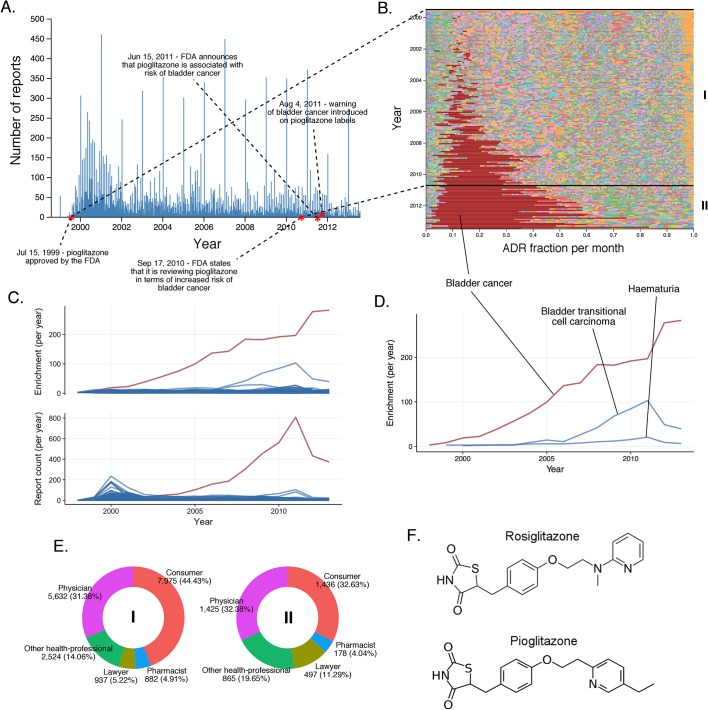
Figura 7.Il paesaggio dei rapporti di pioglitazone.(A) Numero di rapporti FAERS (al giorno) in cui il pioglitazone è stato segnalato come sospetto principale.(B) Percentuale di partecipazione al mese di tutti gli ADR a livello di PT è stata osservata per il pioglitazone. Ogni ADR è rappresentato da un colore distinto. I periodi di tempo caratteristici sulla linea temporale di questo farmaco sono contrassegnati da linee e numerati. Le frazioni mensili di ADR qui riportate sono riportate anche nel file supplementare 1.(C) Numero mensile di segnalazioni in cui il pioglitazone era il principale sospetto; ogni riga corrisponde a un ADR a livello di PT separato. Il grafico nella parte superiore del pannello mostra il numero di volte in cui sono stati segnalati singoli ADR, e in basso i corrispondenti arricchimenti mensili. Le tracce per l’insufficienza cardiaca sono state contraddistinte dal colore blu.(D) Cluster basati sull’arricchimento di ADR correlati al cancro osservati nei rapporti sul pioglitazone.(E) Identità di coloro che segnalano l’ADR da pioglitazone in vari periodi di segnalazione, contrassegnati per corrispondere alle annotazioni in numeri romani nel pannello B. (F) Struttura di rosiglitazone e pioglitazone.DOI:
http://dx.doi.org/10.7554/eLife.25818.010
Farmaci con struttura chimica e modalità d’azione simili possono presentare fenotipi clinici di ADR distinti
In generale si prevede che composti con strutture e modalità d’azione simili avranno profili ADR simili; ad esempio, diversi inibitori selettivi della ricaptazione della serotonina (SSRI) sono associati a comportamenti suicidi nei giovani adulti(U.S. Food and Drug Administration, 2016; Muller et al., 2015). Tuttavia, questo non è sempre il caso. I rapporti ADR post-commercializzazione degli analoghi strutturali rosiglitazone(Greene, 1999) e pioglitazone, che agiscono sullo stesso recettore primario γ (PPAR-γ) attivato dal proliferatore del perossisoma bersaglio e sono strutturalmente correlati, sono notevolmente diversi (confrontare le figure 6B e 7B ).
Per il rosiglitazone, molti rapporti relativi al cuore sono stati presentati dopo la sua approvazione da parte della FDA nel maggio 1999(Figura 6A, Figura 6B). Mentre il numero assoluto di rapporti è variato nel tempo, ed è stato influenzato dallo studio clinico e dai rapporti scientifici in modo molto simile al rofecoxib, la predominanza di effetti cardiaci, come l’insufficienza cardiaca congestizia cardiaca (RRR = 31,99; valore q <10-5), la malattia coronarica(RRRR = 26).32; q-valore <10-5), incidente cerebrovascolare(RRR = 11,72; q-valore <10-5), e infarto miocardico(RRR= 20,73; q-valore <10-5), rispetto ad altri eventi, è stato imperturbato per tutta la vita di questo farmaco (Figura 6B e D).
L’altro farmaco ipoglicemico, il pioglitazone, ha scatenato meno segnalazioni di effetti cardiaci rispetto al profilo clinico ADR del rosiglitazone dalla sua approvazione nel luglio 1999(Figura 7A). Sebbene l’analisi dei rapporti FAERS supporti un segnale statisticamente significativo tra pioglitazone e insufficienza cardiaca (RRR = 5,09; q-valore <10-5), l’evoluzione temporale di questo segnale rivela che il contributo maggiore alla sua forza statistica deriva da un singolo picco che si attenua entro l’anno 2002, e coincide con l’aumento del controllo del rosiglitazone (Figura 7C). A differenza del rosiglitazone, il panorama ADR del pioglitazone è dominato dal cancro alla vescica (RRR = 305,69; valore q <10-5), con un sostanziale aumento dei rapporti dal 2009 in poi (Figura 7B). Al contrario, questo segnale è significativamente sottorappresentato nei rapporti rosiglitazone (RRRR = 0,12; q-valore <10-5). Ci sono prove che agonisti PPAR non selettivi (α + γ) come il pioglitazone potrebbero contribuire alla carcinogenesi (Oleksiewiczet al., 2008; Piccinni et al., 2011), e un recente studio ha collegato il cancro alla vescica allo sviluppo di malattie renali croniche come effetto dell’uso a lungo termine del pioglitazone (Lee et al., 2014). Questa osservazione non è stata confermata con l’uso a breve termine del pioglitazone(Lewis et al., 2011), ed è importante notare che l’aumento dell’incidenza del cancro della vescica è legato al trattamento con pioglitazone che è in corso da più di 2 anni. A parte le evidenze scientifiche, è chiaro dalla popolazione che si sottopone al trattamento (per lo più avvocati e consumatori; si veda la Figura 7) che la segnalazione del carcinoma della vescica ha una componente significativa di stimolo nelle FAER. Poiché non esiste una chiara eziologia per l’alta incidenza di questo ADR, sono necessarie ulteriori indagini per esplorare l’effetto di terapie concomitanti come i glucocorticoidi che potrebbero influenzare il profilo degli effetti collaterali del pioglitazone. Tuttavia, i meccanismi che collegano il pioglitazone meno selettivo ma non il rosiglitazone agonista PPAR-γ selettivo al cancro della vescica non sono chiari, e questa associazione deve rimanere timida.
L’uso del rapporto mensile conta per eliminare i rapporti stimolati
Le tendenze e i pregiudizi nel reporting ADR possono ostacolare la divisione e l’affidabilità delle associazioni antidroga-AdR. L’associazione statisticamente significativa che abbiamo trovato tra pioglitazone e insufficienza cardiaca deriva principalmente dai rapporti precedenti al 2004, che possono riflettere l’opinione popolare secondo cui i tiazolidinedioni ipoglicemici causano effetti collaterali cardiovascolari(Nissen e Wolski, 2007). Mentre non si può escludere che ciò rifletta eventi reali, un’analisi statistica risolta nel tempo si oppone a questo. In un’analisi statistica risolta in un mese della significatività dell’associazione pioglitazone – insufficienza cardiaca, la maggior parte delle date ha indicato che non c’era un’associazione statisticamente significativa tra questa coppia farmaco-ADR (pannello superiore in Figura 8). Al contrario, l’associazione del rosiglitazone e dell’infarto del miocardio era statisticamente significativa in quasi ogni periodo di tempo (pannello inferiore in Figura 8). I periodi in cui l’associazione pioglitazone – insufficienza cardiaca è statisticamente significativa sono limitati ad un paio di picchi scarsi(Figura 8), e quindi suggeriamo questa associazione per essere stimolati, e molto probabilmente artefatti. Tali analisi statistiche mensili risolte per le associazioni farmaco-ADR possono essere ampiamente utili nel rilevare le tendenze di segnalazione di distorsioni. L’osservazione continua dei cambiamenti nei modelli di segnalazione e gli studi correlativi possono rivelare ulteriori aspetti delle potenziali discrepanze tra i profili clinici di farmaci strutturalmente simili. I dati pubblicati sugli effetti favorevoli del pioglitazone sui lipidi, principalmente sui trigliceridi, rispetto al rosiglitazone supportano anche le nostre osservazioni(Nissen e Wolski, 2007; Goldberg et al., 2005; Lincoff et al., 2007).10.7554/eLife.25818.011Figure 8.Statistical significance of association between pioglitazone and cardiac failure (top panel), and rosiglitazone and myocardial infarction (lower panel) over time.the horizontal line demark the critical q-value cutoff of 0.05, below which the association becomes statistically significant. Nelle date in cui l’associazione supera questa soglia, il suo valore q è indicato da un cerchio riempito, altrimenti è indicato da un cerchio vuoto. I valori q estremi inferiori a 1-10-300 non sono indicati.DOI:http://dx.doi.org/10.7554/eLife.25818.011
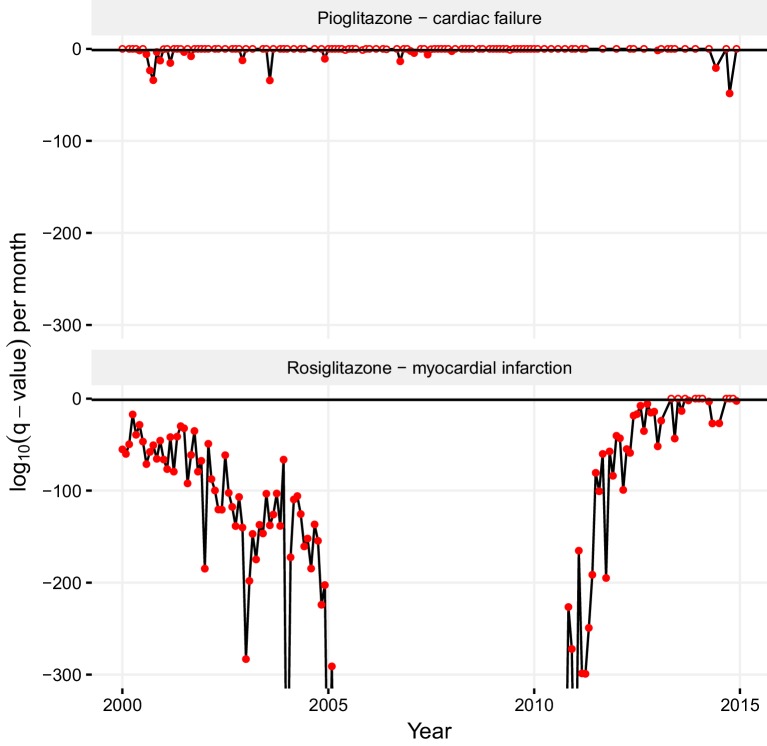
Figura 8.Figura 8. Significato statistico dell’associazione tra pioglitazone e insufficienza cardiaca (pannello superiore), e rosiglitazone e infarto del miocardio (pannello inferiore) nel tempo.La linea orizzontale segna il taglio critico q-valore di 0,05, al di sotto del quale l’associazione diventa statisticamente significativa. Nelle date in cui l’associazione supera questa soglia, il suo valore q è indicato da un cerchio riempito, altrimenti è indicato da un cerchio vuoto. I valori q estremi inferiori a 1-10-300 non sono indicati.DOI:
http://dx.doi.org/10.7554/eLife.25818.011
Combinare farmacocinetica e FAERS per studiare il meccanismo e per la traduzione inversa
C’è un grande interesse nell’uso della farmacovigilanza per l’identificazione dei target e per illuminare il meccanismo d’azione terapeutico e di ADR (Mulleret al., 2015; Nguyen e Lewis, 2014; Rothman et al. , 2000; Shively et al., 1999; Urban et al., 2014). Con l’abbinamento all’attività in vitro, si può sperare di associare un ADR che emerge in FAERS con i target responsabili della fisiologia, rendendo il collegamento: farmaco → target noto → ADR. Mentre noi stessi abbiamo sostenuto il ruolo della farmacologia in vitro per anticipare una possibile tossicologia(Lounkine et al., 2012; Bowes et al., 2012; Bender et al., 2007), farlo dipende in modo affidabile dalla conoscenza dell’esposizione del farmaco al target implicato. Senza considerare la farmacocinetica del farmaco, l’inferenza del farmaco → target → associazioni ADR basata su FAERS può fuorviare (Mullere Milton, 2012).
Un esempio illustrativo è l’ipertensione associata all’inibizione del fattore di crescita endoteliale vascolare o del suo recettore (VEGF, VEGF-R2; vedi Materiali e metodi). La rilevanza di tale inibizione dell’ipertensione è supportata dall’elevata incidenza di questa ADR con l’anticorpo umanizzato specifico del VEGF-R2, bevacizumab(Figura 9B)(Zhu et al., 2007). Corrispondentemente, anche diversi inibitori delle piccole molecole chinasi che inibiscono il VEGF-R2 con la farmacocinetica in vivo(Figura 9B) condividono l’effetto collaterale dell’ipertensione. Tuttavia, altri inibitori delle chinasi con inibizione del VEGF-R2 non sembrano aumentare le segnalazioni di ipertensione(Figura 9). Un’alta incidenza è segnalata solo con quei farmaci di questa classe che hanno margini di esposizione (EM) inferiori a 13 per questo target (biochimico IC50/Cmax; Figura 9). Abbiamo considerato diversi avvertimenti in questa analisi: (1) le esposizioni umane potrebbero variare da 5 a 10 volte, (2) molti degli inibitori della chinasi approvati clinicamente sono promiscui con pochi target che potrebbero influenzare la pressione sanguigna, e (3) in alcuni casi, la dimensione del campione clinico è relativamente piccola. Mentre tutti questi fattori potrebbero influenzare l’incidenza dell’ipertensione associata all’inibizione del VEGF-R, è possibile raccomandare un margine di esposizione di circa 10 per i candidati clinici in sviluppo preclinico per evitare questo effetto collaterale in clinica(Figura 9A). Pertanto, utilizzando un tale taglio EM nell’analisi FAERS, il segnale per questo ADR su casuale separerà i farmaci con evento avverso reale da quelli che ne sono privi(Figura 9).10.7554/eLife.25818.012Figure 9.L’ipertensione associata all’inibizione del VEGF-R2 dipende dal margine di esposizione dei farmaci anti-VEGF-R2 a piccole molecole (VEGF-R2 IC50/Cmax).(A) Margine di esposizione suggerito per gli inibitori VEGF-R in commercio, basato sull’incidenza post-marketing dell’ipertensione in correlazione con l’esposizione al plasma (VEGF-R IC50/ Cmax libero). Il margine proposto 10 volte rappresenta una chiara separazione degli inibitori VEGF-R con e senza aumento significativo dell’ipertensione con la sola eccezione del nintedanib.(B) I rapporti FAERS di inibitori della piccola molecola chinasi con inibizione del VEGF-R2 mostrano un aumento dell’incidenza di rapporti di ipertensione solo nel caso in cui il loro margine di esposizione sia inferiore a 13. L’etichetta dei farmaci con alta incidenza di ipertensione in FAERS elenca questo effetto collaterale, mentre nessuno di quei farmaci che hanno una bassa incidenza porta l’etichetta. *p-valore di associazione tra farmaco e ipertensione <0,001. Vengono forniti i conteggi(N), i conteggi previsti(E) e una misura di sproporzionalità spesso utilizzata (EB05) basata sulla banca dati FAERS della FDA di segnalazioni spontanee di sospette reazioni avverse ai farmaci. I valori di E sono il numero previsto di pazienti che segnalano un disturbo vascolare ipertensivo dopo l’assunzione di ciascun farmaco, se le segnalazioni del farmaco e le segnalazioni dell’evento sono indipendenti all’interno del database, a seconda dell’età e del sesso dei pazienti. Il rapporto N/E è una misura della sproporzionalità dei conteggi delle segnalazioni di ogni particolare combinazione farmaco-evento. Il valore EB05 (empirico Bayes 5% più basso rispetto ad un intervallo credibile del 90%) è una stima prudente della reale sproporzionalità di segnalazione che utilizza la prevalenza complessiva stimata delle associazioni di tossicodipendenti in tutto il database. Il valore di EB05 è inferiore a N/E e ha l’effetto di correggere il semplice rapporto per la varianza di campionamento e la polarizzazione dei confronti multipli. Si veda la letteratura (DuMouchel, 1999; DuMouchele Pregibon, 2001; Szarfman et al., 2002; Almenoff et al.,2007) per i dettagli e la discussione del database FAERS e l’uso di analisi di sproporzionalità all’interno di database di rapporti spontanei. I valori di EB05 per i primi tre farmaci indicano una fiducia del 95% che le segnalazioni di queste tre combinazioni di farmaci sono riportate circa tre o quattro volte più spesso di quanto ci si aspetterebbe se fossero indipendenti, mentre i valori di EB05 <1 negli ultimi tre farmaci della tabella non indicano alcuna prova di tassi di segnalazione superiori al previsto. Risultati più dettagliati dell’analisi bayesiana sono disponibili nel file supplementare 3. †Aumento significativo.DOI:http://dx.doi.org/10.7554/eLife.25818.012
Un caso più complesso emerge attraverso l’indagine del metilfenidato e degli antipsicotici atipici, risperidone/paliperidone (Corena-McLeod, 2015) e aripiprazolo, farmaci prescritti per il trattamento del disturbo da deficit di attenzione e iperattività (ADHD) (CorreiaFilho et al., 2005; Ercan et al., 2012; Fernández-Mayoralas et al.,2012). L’analisi FAERS indica che il trattamento con risperidone/paliperidone, quest’ultimo è il principale metabolita attivo del risperidone, aumenta la frequenza di ginecomastia e galattorrea, mentre il metilfenidato ha una bassa incidenza di questi ADR, così come altri antipsicotici atipici, come l’aripiprazolo(Figura 10)(RELX Intellectual Properties SA, 2016). Ad esempio, tra il 2007 e il 2013, ci sono stati 5073 e 123 casi in FAERS, rispettivamente, in cui il risperidone e il paliperidone sono il principale sospetto di ginecomastia (Figura 10, RRRR= 113,82, valore q <10-5; RRRR = 7,53, valore q<10-5). Per l’aripiprazolo (RRR = 0,85) e il metilfenidato (RRR = 1,39), tuttavia, i valori q erano vicini a 1, il che indica l’assenza di associazioni significative con questo ADR (Figura 10B). Pertanto, i dati FAERS separano chiaramente il profilo del risperidone/paliperidone da entrambi i metilfenidati, con cui si sovrappone per il trattamento dell’ADHD, e da altri antipsicotici atipici, come l’aripiprazolo. Il risultato sarebbe che il bersaglio responsabile della ginecomastia e della galattorrea per il risperidone/paliperidone non è modulato né dal metilfenidato né da altri antipsicotici atipici. Sebbene ciò sia corretto per il metilfenidato, non è corretto per gli antipsicotici atipici. Il profilo clinico degli antipsicotici atipici dipende dal loro modello di impegno con i target del sistema nervoso centrale, in gran parte recettori e trasportatori (Richelson, 1996).10.7554/eLife.25818.013Figure 10.L’integrazione dei dati farmacodinamici e farmacocinetici è necessaria per interpretare le informazioni FAERS.(A) Analisi FAERS del modello di refertazione della ginecomastia nei pazienti trattati con risperidone tra il 2002-2015.(B) Tabella riassuntiva del profilo farmacologico in vitro, voci FAERS (numero totale di segnalazioni, e segnalazioni di ginecomastia, iperprolattinemia e cardiopatia valvolare in cui i farmaci elencati erano i principali sospetti) e calcolo del margine di esposizione di aripiprazolo, risperidone/paliperidone e metilfenidato. Gli effetti prominenti di risperidone/paliperidone al recettore della dopamina D2 in combinazione con la TI stretta differenzia questi composti dal resto. I test sono stati eseguiti presso gli Istituti Novartis per la ricerca biomedica di Cambridge. *Asterischi denotano saggi funzionali. formica: antagonismo.DOI:http://dx.doi.org/10.7554/eLife.25818.013
Sia l’aripiprazolo che il risperidone/paliperidone sono antipsicotici atipici con elevata affinità ai recettori dopaminergici, serotoninergici, adrenergici e istaminergici (Figura 10B[Lounkine et al., 2012; Rothet al., 2000]). E ‘ben stabilito che l’inibizione della dopamina D2, ma non 5-HT2C recettori sono legati alla iperprolattinemia, che è il meccanismo di base di ginecomastia e galattorrea(Calarge et al., 2009; Alladi et al., 2017). Indipendentemente dalla loro potenza simile al recettore della dopamina D2, la differenza tra il profilo ADR di aripiprazolo e risperidone/paliperidone si spiega con il loro meccanismo d’azione (il risperidone è un antagonista completo e l’aripiprazolo è un agonista parziale) e in particolare con il loro profilo PK, che rivela che il margine di esposizione (EM[Muller e Milton, 2012]) per la D2 è grande per l’aripiprazolo e quindi questo ADR non si è manifestato. Per il risperidone, l’EM è inferiore a uno che spiega l’alta incidenza di ginecomastia(Figura 10). Il metilfenidato non influisce affatto sul recettore D2, e di conseguenza questo ADR non è stato osservato.
Mentre il paliperidone è noto per causare iperprolattinemia(Bostwick et al., 2009) che è confermato dai dati FAERS, resta da spiegare perché ha un tasso di segnalazione significativamente inferiore rispetto al suo genitore, il risperidone, con un’attività simile al recettore D2 (Arakawaet al., 2008).
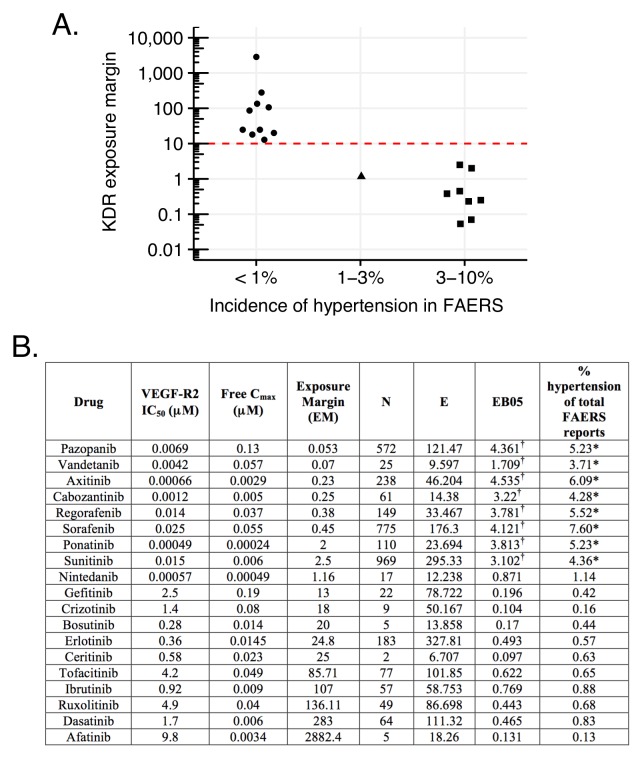
Figura 9.L’ipertensione associata all’inibizione del VEGF-R2 dipende dal margine di esposizione dei farmaci anti-VEGF-R2 a piccole molecole (VEGF-R2 IC50/Cmax).(A) Margine di esposizione suggerito per gli inibitori VEGF-R commercializzati, basato sull’incidenza post-marketing dell’ipertensione in correlazione con l’esposizione al plasma (VEGF-R IC50/Cmax libero). Il margine proposto 10 volte rappresenta una chiara separazione degli inibitori VEGF-R con e senza aumento significativo dell’ipertensione con la sola eccezione del nintedanib.(B) I rapporti FAERS di inibitori della piccola molecola chinasi con inibizione del VEGF-R2 mostrano un aumento dell’incidenza di rapporti di ipertensione solo nel caso in cui il loro margine di esposizione sia inferiore a 13. L’etichetta dei farmaci con alta incidenza di ipertensione in FAERS elenca questo effetto collaterale, mentre nessuno di quei farmaci che hanno una bassa incidenza porta l’etichetta. *p-valore di associazione tra farmaco e ipertensione <0,001. Vengono forniti i conteggi(N), i conteggi previsti(E) e una misura di sproporzionalità spesso utilizzata (EB05) basata sulla banca dati FAERS della FDA di segnalazioni spontanee di sospette reazioni avverse ai farmaci. I valori di E sono il numero previsto di pazienti che segnalano un disturbo vascolare ipertensivo dopo l’assunzione di ciascun farmaco, se le segnalazioni del farmaco e le segnalazioni dell’evento sono indipendenti all’interno del database, a seconda dell’età e del sesso dei pazienti. Il rapporto N/E è una misura della sproporzionalità dei conteggi delle segnalazioni di ogni particolare combinazione farmaco-evento. Il valore EB05 (empirico Bayes 5% più basso rispetto ad un intervallo credibile del 90%) è una stima prudente della reale sproporzionalità di segnalazione che utilizza la prevalenza complessiva stimata delle associazioni di tossicodipendenti in tutto il database. Il valore di EB05 è inferiore a N/E e ha l’effetto di correggere il semplice rapporto per la varianza di campionamento e la polarizzazione dei confronti multipli. Si veda la letteratura (DuMouchel, 1999; DuMouchele Pregibon, 2001; Szarfman et al., 2002; Almenoff et al.,2007) per i dettagli e la discussione del database FAERS e l’uso di analisi di sproporzionalità all’interno di database di rapporti spontanei. I valori di EB05 per i primi tre farmaci indicano una fiducia del 95% che le segnalazioni di queste tre combinazioni di farmaci sono riportate circa tre o quattro volte più spesso di quanto ci si aspetterebbe se fossero indipendenti, mentre i valori di EB05 <1 negli ultimi tre farmaci della tabella non indicano alcuna prova di tassi di segnalazione superiori al previsto. Risultati più dettagliati dell’analisi bayesiana sono disponibili nel file supplementare 3. †Aumento significativo.DOI:
http://dx.doi.org/10.7554/eLife.25818.012
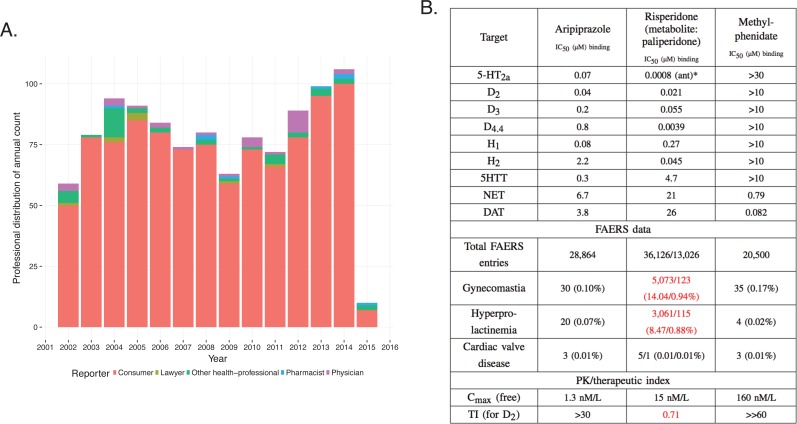
Figura 10.L’integrazione dei dati farmacodinamici e farmacocinetici è necessaria per interpretare le informazioni FAERS.(A) Analisi FAERS del modello di segnalazione della ginecomastia nei pazienti trattati con risperidone tra il 2002 e il 2015.(B) Tabella riassuntiva del profilo farmacologico in vitro, voci FAERS (numero totale di segnalazioni, e segnalazioni di ginecomastia, iperprolattinemia e malattia delle valvole cardiache in cui i farmaci elencati erano i principali sospetti) e calcolo del margine di esposizione di aripiprazolo, risperidone/paliperidone e metilfenidato. Gli effetti prominenti di risperidone/paliperidone al recettore della dopamina D2 in combinazione con la TI stretta differenzia questi composti dal resto. I test sono stati eseguiti presso gli Istituti Novartis per la ricerca biomedica di Cambridge. *Asterischi denotano saggi funzionali. formica: antagonismo.DOI:
http://dx.doi.org/10.7554/eLife.25818.013
Discussione
Da questo studio emergono quattro osservazioni chiave. In primo luogo, gran parte del segnale potenziale in FAERS e nei relativi database è oscurato dalla ridondanza dei nomi chimici. Questo introduce false associazioni che cadrebbero nell’insignificanza sull’aggregazione dei sinonimi, e questo nasconde associazioni che sarebbero significative sull’aggregazione. Questo può essere affrontato rappresentando i principi attivi con le loro strutture chimiche uniche in una forma facilmente ricercabile come facciamo qui(File supplementare 1). In secondo luogo, le relazioni FAERS si orientano verso risultati seri, in parte a causa di una confusione tra ADR e risultati. In terzo luogo, FAERS soffre di diverse forme di conflazione: molteplici voci, indicazioni con gli ADRs, notiziabilità, e influenze scientifiche e legali. Queste possono essere rilevate da analisi statistiche, compreso il confronto dei rapporti nel tempo. Quarto, e forse più generativamente, una volta corretti questi pregiudizi e conflazioni, si può rivelare il meccanismo molecolare degli ADR precedentemente nascosti; un esempio qui esplorato è l’associazione del cancro della vescica urinaria con agonisti misti PPAR-α e PPAR-γ.
Una delle principali ragioni della tendenza di FAERS a favorire esiti gravi è la conflazione tra gli ADR e gli esiti. Questo può derivare da una questione semplice come la confusione sul fatto che la “morte” sia elencata come ADR – associata solo al farmaco – o come risultato – associata alla malattia stessa. Questo è il caso dell’attribuzione dell’effetto collaterale “morte” all’uso della talidomide nel multiplex del mieloma complesso, quando questo riflette l’alto tasso di mortalità della malattia stessa (Greene, 1999). Naturalmente, ci sono alcuni casi in cui l’uso di un farmaco può aumentare il tasso di mortalità, anche nel trattamento di malattie potenzialmente letali, come nel caso del milrinone per le sindromi da insufficienza cardiaca acuta (AHFS) (Bayramet al., 2005) o per l’insufficienza cardiaca cronica grave (Packeret al., 1991). La situazione può essere migliorata quando un farmaco viene utilizzato in diverse indicazioni con sintomi ed esiti distinti, consentendo di differenziare gli esiti della malattia da quelli legati al farmaco. I FAERS potrebbero essere ulteriormente sviluppati per allertare automaticamente lo sperimentatore in merito ai comuni pregiudizi di indicazione, come l’alto tasso di mortalità nei tumori maligni o le anomalie metaboliche di base nel diabete. In questi casi è necessaria un’attenta analisi statistica per differenziare gli esiti associati alla malattia o al farmaco sospetto. Per ora la categoria “esito” dovrebbe essere usata con cautela per l’analisi ADR, specialmente in studi su larga scala che aggregano i dati di diversi farmaci.
In linea di principio, la presentazione di rapporti FAERS richiede conoscenze mediche, poiché essi includono indicazioni specifiche per le quali sono stati prescritti i farmaci, l’identificazione del principale sospetto di ADR, e la descrizione strutturata di ADR secondo i termini MedDRA. Tuttavia, un terzo delle segnalazioni sono fornite dai clienti, e la metà da coloro che non si identificano come professionisti medici, compresi gli avvocati. Ciò contribuisce all’elevata ridondanza e all’errore di FAERS, e alla “segnalazione stimolata” di cui soffre (Hoffmanet al., 2014). Questo sembra essere stato il caso del celecoxib, la cui associazione con gli eventi cerebro e cardiovascolari nei rapporti FAERS è stata guidata principalmente da rapporti di professionisti legali(Figura 5E). Dopo il ritiro del rofecoxib, la percentuale di questi eventi per il celecoxib è tornata in secondo piano. Per casi come questi, un’analisi temporale delle associazioni ADR-droga è essenziale in quanto può individuare le associazioni spurie. L’interrogazione dei FAERS e dei relativi database per illuminare i meccanismi molecolari dell’ADR, e in effetti i profili target condivisi dei farmaci, è stata un’area di interesse molto recente(Center for Drug Evaluation and Research, 2015). Anche in questo caso, troviamo che la disambiguazione delle ADR, delle indicazioni, delle segnalazioni e dei pregiudizi di indicazione può rivelare associazioni precedentemente oscurate. Un esempio è l’associazione del cancro alla vescica con il pioglitazone agonista misto PPAR-α e PPAR-γ. L’analisi FAERS è strumentale in questo caso, fornendo informazioni su una vasta popolazione di pazienti e consentendo il confronto con il selettivo PPAR-γ rosiglitazone agonista, che non è associato con il cancro della vescica (Figura 6) (Smith,2001).
Il miglioramento dei metodi statistici per la rilevazione dei segnali è un’area di ricerca attiva(Wysowski e Swartz, 2005; Lasser et al., 2002; Friedman et al.,1999; Moore et al., 1998; Harpaz et al,2013a) e molta attenzione è rivolta a metodi statistici avanzati come le componenti informative (bayesiane) (Harpazet al., 2013a), la statistica empirica di Bayes (Harpaz et al.,2013b) e i metodi gerarchici (Harpaz et al.,2013b). Come per tutti gli approcci statistici e di machine learning, questi metodi presuppongono dati di input puliti – i pregiudizi e il rumore che affrontano sono di natura statistica. Abbiamo utilizzato un noto approccio di sproporzionalità, il relativo rapporto di segnalazione (RRR) con χ 2 test statistici per la sproporzionalità. L’RRR ha i suoi limiti e può non dare risultati migliori rispetto ai metodi più avanzati (Harpazet al., 2013a). L’obiettivo del nostro studio era come una corretta preparazione dei dati di input – pulizia della mappatura degli ingredienti dei farmaci e stima dei rapporti multipli – aumenta le prestazioni di rilevamento del segnale, anche con un metodo semplice come l’RRR. Crediamo che l’applicazione delle procedure e delle precauzioni che abbiamo descritto in questa sede, insieme a metodi statistici più avanzati, aumenterà ulteriormente le loro prestazioni.
Una precauzione fondamentale è che semplici associazioni come l’RRR o il drug-target non producono rilevanza clinica senza informazioni farmacocinetiche, il che assicura che il target implicato sia esposto al farmaco a concentrazioni efficaci. Ciò è illustrato dal confronto tra i farmaci per l’ADHD risperidone e aripiprazolo e ginecomastia. Entrambi i farmaci influenzano il recettore della dopamina D2 che è alla base dell’ADR, ma solo il risperidone raggiunge un’esposizione sufficiente a scatenarlo. L’esempio dell’inibitore VEGF-R2 suggerisce che questo tipo di valutazione è l’unico modo per individuare oggettivamente le coppie target dell’ADR e spiegare i meccanismi alla base della loro manifestazione. Affidarsi solo ad un ADR → farmaco → schema di target in vitro può essere insufficiente per comprendere i target condivisi o i meccanismi molecolari; come Goodman ha suggerito molto tempo fa, l’esposizione farmacocinetica rimane cruciale (Goodman eGilman, 1985).
FAERS, una risorsa già preziosa per medici e scienziati farmaceutici, potrebbe essere migliorata in diversi modi per migliorare la farmacovigilanza post-marketing. In primo luogo, si consiglia di introdurre una mappatura automatica dei farmaci e dei sinonimi degli ingredienti, come discusso in questo documento. Si potrebbero emettere allarmi per le indicazioni in cui gli esiti gravi sono comuni e difficili da distinguere dagli ADR. Le associazioni definitive di farmaci-ADR richiederebbero informazioni sull’esposizione. In questo caso, la disponibilità della dose applicata e dei dati PK associati è essenziale. Attualmente non viene fornita alcuna dose e i dati PK possono essere ottenuti solo da fonti diverse. Una di queste fonti è PharmaPendium(RELX Intellectual Properties SA, 2016), che contiene sia dati FAERS che informazioni PK, ma anche qui i dati non sono collegati direttamente, e questa risorsa è solo commerciale e non è disponibile al pubblico. I database pubblici a cui FAERS potrebbe collegarsi includono DailyMed o drugs.com, che potenzialmente fornirebbero informazioni sulla farmacocinetica, sulle etichette dei farmaci, sulle formulazioni e sulle indicazioni approvate.
Ci sono diversi punti deboli dell’approccio attuale, che sembra essere più o meno generale per gli sforzi minerari di FAERS. Abbiamo incontrato difficoltà nel differenziare le associazioni farmaco-ADR quando diversi farmaci sono stati somministrati insieme, in particolare quando le combinazioni contengono farmaci con possibili effetti sinergici o antagonisti. Inoltre, formulazioni diverse dello stesso principio attivo possono contribuire a differenziare il profilo del farmaco, cosa difficile da cogliere con l’approccio attuale.
Infine, l’introduzione dell’automazione della segnalazione in FAERS servirebbe al duplice scopo di ridurre gli errori, come l’errata classificazione degli ADR e delle indicazioni, e di rendere lo strumento più interattivo e gratificante per i professionisti della salute. Si può immaginare che i soggetti che inviano le segnalazioni ricevano un feedback su voci simili, compresi i casi relativi allo stesso farmaco sospetto, alle indicazioni, alla popolazione di pazienti e ai regimi di trattamento più comuni o problematici. Tra gli altri vantaggi, lo strumento potrebbe anche aiutare a definire il “farmaco sospetto” in scenari terapeutici, indipendentemente dall’intenzione dei partecipanti. Mentre questo sviluppo avrebbe bisogno di investimenti, si potrebbe immaginare di intraprenderlo come parte di una partnership pubblico-privata da cui tutti trarrebbero beneficio.
Conclusioni
Le sfide e le opportunità in FAERS e anche dai relativi database derivano dalle sue ambizioni. Pubblica rapporti multipli – medici, pazienti, altri professionisti del settore medico, avvocati – su più farmaci, denominati in più modi e presi in più contesti. FAERS non rappresenta una fonte di osservazioni sui farmaci rigorosamente rivista e attentamente canalizzata, come fa uno studio clinico – non c’è un braccio placebo in FAERS, né ci sono segnalazioni di casi in cui un dato farmaco è stato prescritto e non ha causato effetti collaterali. Contiene informazioni non controllate e volontarie su larga scala. Questo può essere visto come una caratteristica di FAERS – un database progettato con la generazione di ipotesi piuttosto che con il test delle ipotesi in mente. Tuttavia, le ipotesi che FAERS suggerisce dipendono in modo critico dalla capacità di districarne i dati. Strumenti come quelli qui descritti sono cruciali per il controllo per le osservazioni spesso conflittuali e contraddittorie nei rapporti FAERS, dove gli esiti gravi sono riportati in eccesso, la morte segnalata è spesso legata alla presentazione da parte dei pazienti stessi, un singolo evento è riportato più volte, le vere associazioni tra farmaci ed eventi avversi sono mancate perché un singolo agente è nominato in più modi, o una malattia meccanicisticamente correlata si verifica in diverse categorie di organi del sistema. Una volta che i suoi dati vengono disaggregati, FAERS rappresenta un’opportunità senza precedenti per tracciare gli esiti dei farmaci in ampie popolazioni di pazienti, rivelando nuove associazioni. Il potere di tale analisi è che può essere applicata in modo sistematico e completo attraverso un numero massiccio di osservazioni.
Riconosciamo che un metodo completamente automatizzato, come quello qui descritto, non può sostituire la conoscenza degli esperti. Ciò che un tale metodo può fare è identificare, dare priorità e, a volte, privare di priorità le associazioni di eventi negativi per la droga e, a volte, anche l’inferenza meccanicistica, per un’identificazione dettagliata degli esperti. Questo approccio dovrebbe essere utile alla crescente comunità di regolatori, pagatori, medici e pazienti che lavorano con e dipendono dalle tendenze che emergono nei FAERS per migliorare l’uso di droghe e i risultati sanitari. Mettendo diversi di questi strumenti a disposizione della comunità, speriamo di consentire in futuro l’interrogatorio di FAERS da parte di altri ricercatori.
Materiali e metodi
Fonte dati FAERS
I rapporti FAERS sono stati scaricati il 24 maggio 2016 dal database FEARS (U.S.Food and Drug Administration, 2016) per gli anni compresi tra il quarto trimestre del 1997 e il quarto trimestre del 2015. L’ADR, l’indicazione, il ruolo della droga (sospetto primario, sospetto secondario, concomitante) e i dati sui risultati sono stati mappati utilizzando gli identificatori dei rapporti ISR ai singoli rapporti. I farmaci sono stati identificati con il nome del farmaco segnalato in FAERS.
Mappatura delle droghe in base agli ingredienti
Abbiamo raccolto un elenco di sinonimi di farmaci, utilizzando database pubblici e su licenza, tra cui Thompson Reuters Integrity (ThomsonReuters, 2016), GVK (GVK Biosciences, 2014), Drugbank(Law et al., 2014),ChEMBL (Gaulton et al., 2012)e RxNorm (Nelson et al.,2011). Questi sinonimi sono stati abbinati ai prodotti farmaceutici e alle strutture degli ingredienti molecolari costitutivi, codificati con InChIKeys (International Union of Pure and Applied Chemistry, 2016). Abbiamo letto in tutti i nomi dei farmaci da tutti i rapporti FAERS, e tutti i sinonimi che erano stati assemblati. I caratteri non alfabetici (eccetto i numeri), le maiuscole e i termini che portavano poche informazioni sull’identità delle droghe (come articoli, o parole spesso presenti come ‘acido’) sono stati rimossi dai nomi delle droghe FAERS e dai nomi dei sinonimi, e le parti rimanenti dei nomi sono state simbolizzate. Ogni farmaco FAERS gettonato è stato poi confrontato con ogni sinonimo gettonato, e la sovrapposizione dei gettoni è stata registrata per ogni coppia utilizzando il coefficiente di somiglianza Tanimoto tc. Il sinonimo con il valore tcpiù alto è stato scelto per un dato farmaco, a condizione che il tcfosse ≥0,2; per qualsiasi farmaco, se è stato trovato un sinonimo con tc di 0, 99 o superiore, è stato considerato una corrispondenza esatta, e utilizzato per identificare il farmaco in questione senza confronto con altri sinonimi. Per i nomi di farmaci più frequenti (tra i primi 500) in FAERS, abbiamo mappato manualmente quei nomi di farmaci su InChIKeys che non potevano essere mappati. Poiché InChIKeys non sono tipicamente calcolati per macromolecole di grandi dimensioni, in questi casi abbiamo usato il nome non proprietario al posto di InChIKey.
Termini di reazione avversa ai farmaci
La maggior parte degli ADR in FAERS sono riportati utilizzando il Medical Dictionary for Regulatory Activities (MedDRA) (Brownet al., 1999). Alcuni rapporti più vecchi contenevano termini che non fanno parte del MedDRA più recente che viene utilizzato attualmente. Per normalizzare e annotare i termini ADR estratti dai rapporti abbiamo utilizzato un algoritmo di Levenshtein che ha confrontato i termini ADR FAERS con la terminologia MedDRA. Abbiamo fissato il punteggio minimo di Levenshtein al quale un dato termine MedDRA è stato considerato un perfetto abbinamento a 0,95, e il punteggio minimo accettabile a 0,90 al di sopra del quale è stato scelto il termine con il punteggio più alto per standardizzare un determinato ADR. Altri 32 termini ADR sono stati standardizzati manualmente, lasciando meno dello 0,5% di termini ADR non eguagliati.
Stabilire le associazioni di indicazione degli ingredienti – ADR e degli ingredienti
Abbiamo utilizzato il consolidato Relative reporting ratio (RRR) insieme a una statistica χ 2 per il rilevamento della sproporzionalità del segnale (Harpazet al., 2013a). Abbiamo costruito le tabelle di contingenza ingrediente-ADR e calcolato il numero previsto di occorrenze, l’RRR, e i valori χ 2 p correttiper Yates (Yates,1934) per queste tabelle di contingenza, come implementato in SciPy (Jones et al.,2001). Il False discovery rate (FDR) è stato controllato (Joneset al., 2001) utilizzando la procedura Holm (Holm, 1979), che ha prodotto valori q. Le associazioni sono state selezionate: (a) sono state riportate almeno cinque volte in FAERS; (b) avevano un valore q <0,05; e (c) avevano un RRR >1. Queste coppie ingrediente – ADR sono mostrate nel file supplementare 1.
Calcolo delle associazioni ingrediente – ADR su base mensile
Con i dati FAERS annotati con le date degli ADR, per ogni ingrediente – coppia ADR abbiamo calcolato le frequenze di co-occorrenza, i valori RRR e i valori p basati su χ 2 per ogni mese tra gennaio 1997 e dicembre 2015. In questi calcoli abbiamo utilizzato il numero di farmaci, i valori ADR e i rapporti totali solo per il mese in questione. Il tasso di falsificazione (False discovery rate, FDR) è stato controllato utilizzando la procedura Holm (per ogni mese separatamente), ottenendo i valori q. Nel file supplementare 1 per ogni ingrediente statisticamente significativo (in aggregato) – associazione ADR, abbiamo riportato i numeri di mesi in cui i valori q erano inferiori a 0,05 e in cui i valori q erano superiori o uguali a 0,05.
Aspetti generali delle statistiche utilizzate per la farmacovigilanza post-marketing
Poiché le segnalazioni spontanee non sono rigorosamente campionate da una popolazione di pazienti con esposizione nota ai farmaci di interesse, non è possibile calcolare i tassi di incidenza o i rischi relativi. Al contrario, vengono comunemente calcolati i rapporti tra i conteggi degli eventi farmacologici e le misure di esposizione intuitivamente plausibili, chiamati rapporti di sproporzionalità. I database dei conteggi delle prescrizioni sembrano naturali da utilizzare, come discusso in letteratura (Stromet al., 2013); tuttavia, questi portano a difficoltà nell’integrazione di due database separati così come ad ambiguità nel significato delle prescrizioni, come la misurazione del numero di mesi di fornitura, la regione geografica di produzione e di erogazione, il consumo da parte dei pazienti, e così via. Sia la FDA (Duggiralaet al., 2016) che l’EMA (EudravigilanceExpert Working Group, 2006), documentiguida per l’analisi dei database dei rapporti spontanei da parte di due dei più importanti enti normativi farmaceutici del mondo, si concentrano sull’uso di misure di sproporzionalità che possono essere calcolate all’interno di un unico database di rapporti spontanei. Il PRRR (Duggiralaet al., 2016) e lo strettamente correlato RRR definito sopra sono semplici misure calcolabili dalla semplice tabella 2 × 2 dei conteggi dei rapporti classificati per farmaco citato e per evento citato, mentre uncalcolo leggermente più complesso (Mantel e Haenszel, 1959) può prima stratificare, eventualmente confondendo variabili come il sesso e l’età del paziente, e l’anno solare del rapporto, e poi sommare tra gli strati per ottenere un conteggio previsto da confrontare con il conteggio osservato. Il rapporto della FDA (Duggiralaet al., 2016) discute anche il concetto di stime bayesiane del “restringimento” (DuMouchel,1999), che tentano di ridurre gli effetti della varianza in piccoli campioni adattando l’intera serie di sproporzionamenti di eventi farmacologici ad una distribuzione precedente e poi usando quella per calcolare una distribuzione posteriore per ogni singola sproporzionalità, ottenendo una stima centrale che indica l’EBGM (media geometrica empirica di Bayes) e un intervallo posteriore del 90% (EB05, EB95). In questo lavoro, usiamo la semplice misura RRR per diversi calcoli globali attraverso il database FAERS, e in alcuni punti presentiamo le misure bayesiane presumibilmente più affidabili quando ci si concentra su particolari eventi di interesse farmacologico.
Raggruppamento dell’ADR in base all’evoluzione del tempo
Abbiamo considerato il numero di rapporti in ogni mese (evoluzioni temporali) per i singoli ADR osservati in tutti i FAERS per quattro farmaci: rofecoxib, celecoxib, rosiglitazone e pioglitazone. Con la conoscenza dei numeri di ciascuno dei farmaci considerati, degli ADR e del numero di rapporti totali in FAERS in ogni mese, abbiamo calcolato i valori RRR risolti in un mese per le coppie farmaco-ADR. Le evoluzioni temporali dei valori RRR sono state raggruppate per ogni farmaco utilizzando il metodo di partizionamento per la massima dissimiglianza, come implementato in R (RCore Team, 2013) ottenuto dalla somiglianza (coefficiente di correlazione Pearson) delle evoluzioni temporali di RRR.
Modelli di regressione logistica della dipendenza dell’infarto miocardico dall’uso del celecoxib
Per ogni rapporto FAERS, abbiamo notato se a) il celecoxib è stato segnalato come il principale farmaco sospetto, b) se è stato segnalato un infarto del miocardio, c) l’occupazione della persona che ha presentato il rapporto, e d) se l’evento segnalato è avvenuto prima del 2005 (quando il rofecoxib era ancora sul mercato). Utilizzando questi dati e l’implementazione da parte di R della regressione logistica binomiale (tramite la funzione glm()), abbiamo preparato quattro modelli (con la funzione logit link) (R CoreTeam, 2013) per indagare se l’infarto del miocardio è associato all’uso di celecoxib, all’occupazione della persona che presenta la segnalazione, e alla segnalazione che è stata presentata prima del 2005. In ogni modello, la segnalazione dell’infarto del miocardio è servita come variabile di output e le combinazioni delle variabili rimanenti sono state utilizzate come variabili di input. I modelli risultanti sono riassunti e descritti più dettagliatamente nel file supplementare 2.
Analisi dell’associazione fra inibizione VEGF-R2 e ipertensione
Oltre all’analisi descritta in questo lavoro, l’ulteriore data mining bayesiano e l’analisi statistica dell’ipertensione legata all’inibizione del VEGF-R2 si sono basati sui metodi descritti in dettaglio da DuMouchel (DuMouchel, 1999), DuMouchel e Pregibon (DuMouchele Pregibon, 2001), Szarfman et al. (Szarfman et al., 2002), e Almenoff et al. (Almenoff et al.,2007).
References
- Alladi CG, Mohan A, Shewade DG, Rajkumar RP, Adithan S, Subramanian K. Risperidone-Induced adverse drug reactions and role of DRD2 (-141 C ins/Del) and 5htr2c (-759 C>T) Genetic polymorphisms in patients with Schizophrenia. Journal of Pharmacology & Pharmacotherapeutics. 2017; 8:28-32. DOI | PubMed
- Almenoff JS, Pattishall EN, Gibbs TG, DuMouchel W, Evans SJ, Yuen N. Novel statistical tools for monitoring the safety of marketed drugs. Clinical Pharmacology & Therapeutics. 2007; 82:157-166. DOI | PubMed
- Arakawa R, Ito H, Takano A, Takahashi H, Morimoto T, Sassa T, Ohta K, Kato M, Okubo Y, Suhara T. Dose-finding study of paliperidone ER based on striatal and extrastriatal dopamine D2 receptor occupancy in patients with schizophrenia. Psychopharmacology. 2008; 197:229-235. DOI | PubMed
- Bayram M, De Luca L, Massie MB, Gheorghiade M. Reassessment of dobutamine, dopamine, and milrinone in the management of acute heart failure syndromes. The American Journal of Cardiology. 2005; 96:47-58. DOI | PubMed
- Bender A, Scheiber J, Glick M, Davies JW, Azzaoui K, Hamon J, Urban L, Whitebread S, Jenkins JL. Analysis of pharmacology data and the prediction of adverse drug reactions and off-target effects from chemical structure. ChemMedChem. 2007; 2:861-873. DOI | PubMed
- Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, Day R, Ferraz MB, Hawkey CJ, Hochberg MC, Kvien TK, Schnitzer TJ, VIGOR Study Group. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. New England Journal of Medicine. 2000; 343:1520-1528. DOI | PubMed
- Bostwick JR, Guthrie SK, Ellingrod VL. Antipsychotic-induced hyperprolactinemia. Pharmacotherapy. 2009; 29:64-73. DOI | PubMed
- Bowes J, Brown AJ, Hamon J, Jarolimek W, Sridhar A, Waldron G, Whitebread S. Reducing safety-related drug attrition: the use of in vitro pharmacological profiling. Nature Reviews Drug Discovery. 2012; 11:909-922. DOI | PubMed
- Brown EG, Wood L, Wood S. The medical dictionary for regulatory activities (MedDRA). Drug Safety. 1999; 20:109-117. DOI | PubMed
- Calarge CA, Ellingrod VL, Acion L, Miller DD, Moline J, Tansey MJ, Schlechte JA. Variants of the dopamine D2 receptor gene and risperidone-induced hyperprolactinemia in children and adolescents. Pharmacogenetics and Genomics. 2009; 19:373-382. DOI | PubMed
- Center for Drug Evaluation and Research. Drug Safety and Availability – FDA Drug Safety Communication: FDA warns that DPP-4 inhibitors for type 2 diabetes may cause severe joint pain. 2015. Publisher Full Text
- Consumers Union, Consumer Reports Best Buy Drugs. The NSAID drugs: prescriptions and prices. 2005. Publisher Full Text
- Cook D, Brown D, Alexander R, March R, Morgan P, Satterthwaite G, Pangalos MN. Lessons learned from the fate of AstraZeneca’s drug pipeline: a five-dimensional framework. Nature Reviews Drug Discovery. 2014; 13:419-431. DOI | PubMed
- Corena-McLeod M. Comparative Pharmacology of Risperidone and Paliperidone. Drugs in R&D. 2015; 15:163-174. DOI | PubMed
- Correia Filho AG, Bodanese R, Silva TL, Alvares JP, Aman M, Rohde LA. Comparison of risperidone and methylphenidate for reducing ADHD symptoms in children and adolescents with moderate mental retardation. Journal of the American Academy of Child & Adolescent Psychiatry. 2005; 44:748-755. DOI | PubMed
- Devine M. Adverse events: Refresher and updates. 2016. Publisher Full Text
- Downing NS, Shah ND, Aminawung JA, Pease AM, Zeitoun JD, Krumholz HM, Ross JS. Postmarket Safety events among novel therapeutics approved by the US Food and Drug Administration between 2001 and 2010. JAMA. 2017; 317:1854-1863. DOI | PubMed
- Duggirala HJ, Tonning JM, Smith E, Bright RA, Baker JD, Ball R, Bell C, Bouri K, Bright-Ponte SJ, Botsis T, Boyer M, Burkhart K, Condrey GS, Chen JJ, Chirtel S, Filice RW, Francis H, Jiang H, Levine J, Martin D, Oladipo T, O’Neill R, Palmer LAM, Paredes A, Rochester G, Sholtes D, Wong HL, XU Z, Szarfman A, Kass-Hout T. Data mining at FDA. 2016. Publisher Full Text
- DuMouchel W, Pregibon D. Empirical Bayes Screening for Multi-Item Associations. ACM Press; 2001.
- DuMouchel W. Bayesian Data Mining in Large Frequency Tables, with an Application to the FDA Spontaneous Reporting System. The American Statistician. 1999; 53:177-190. DOI
- Elashoff M, Matveyenko AV, Gier B, Elashoff R, Butler PC. Pancreatitis, pancreatic, and thyroid Cancer with glucagon-like peptide-1-based therapies. Gastroenterology. 2011; 141:150-156. DOI | PubMed
- Ercan ES, Uysal T, Ercan E, Akyol Ardic U, Ardıc UA. Aripiprazole in children and adolescents with conduct disorder: a single-center, open-label study. Pharmacopsychiatry. 2012; 45:13-19. DOI | PubMed
- Eudravigilance Expert Working Group. Guideline on the use of statistical signal detection methods in the EudraVigilance data analysis system. 2006. Publisher Full Text
- Everitt B, Skrondal A. The Cambridge Dictionary of Statistics. Cambridge University Press: New York; 2010.
- Fernández-Mayoralas DM, Fernández-Jaén A, Muñoz-Jareño N, Calleja-Pérez B, Fernández-Perrone AL, Arribas SL. Treatment with paliperidone in children with behavior disorders previously treated with risperidone: an open-label trial. Clinical Neuropharmacology. 2012; 35:227-230. DOI | PubMed
- Friedman MA, Woodcock J, Lumpkin MM, Shuren JE, Hass AE, Thompson LJ. The safety of newly approved medicines: do recent market removals mean there is a problem?. JAMA. 1999; 281:1728-1734. PubMed
- Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. ChEMBL: a large-scale bioactivity database for drug discovery. Nucleic Acids Research. 2012; 40:D1100-D1107. DOI | PubMed
- Goldberg RB, Kendall DM, Deeg MA, Buse JB, Zagar AJ, Pinaire JA, Tan MH, Khan MA, Perez AT, Jacober SJ, GLAI Study Investigators. A comparison of lipid and glycemic effects of pioglitazone and rosiglitazone in patients with type 2 diabetes and dyslipidemia. Diabetes Care. 2005; 28:1547-1554. DOI | PubMed
- Goodman LS, Gilman A. Goodman and Gilman’s the Pharmacological Basis of Therapeutics. MacMillan USA; 1985.
- Greene DA. Rosiglitazone: a new therapy for type 2 diabetes. Expert Opinion on Investigational Drugs. 1999; 8:1709-1719. DOI | PubMed
- GVK Biosciences. GVK Biosciences. 2014. Publisher Full Text
- Harpaz R, DuMouchel W, LePendu P, Bauer-Mehren A, Ryan P, Shah NH. Performance of pharmacovigilance signal-detection algorithms for the FDA adverse event reporting system. Clinical Pharmacology & Therapeutics. 2013a; 93:539-546. DOI | PubMed
- Harpaz R, DuMouchel W, LePendu P, Shah NH. Proceedings of the 19th ACM SIGKDD International Conference on Knowledge Discovery and Data Mining. ACM; 2013b.
- Hoffman KB, Demakas AR, Dimbil M, Tatonetti NP, Erdman CB. Stimulated reporting: the impact of US food and drug administration-issued alerts on the adverse event reporting system (FAERS). Drug Safety. 2014; 37:971-980. DOI | PubMed
- Holm SA. simple sequentially rejective multiple test procedure. Scandinavian Journal of Statistics. 1979; 6:65-70.
- Hoyert DL, Xu J, others Deaths: preliminary data for 2011. National Vital Statistics Reports : From the Centers for Disease Control and Prevention, National Center for Health Statistics, National Vital Statistics System. 2012; 61:1-51. PubMed
- International Union of Pure and Applied Chemistry. The IUPAC International Chemical Identifier (InChI). 2016. Publisher Full Text
- Jones E, Oliphant T, Peterson P. 2001.
- Lasser KE, Allen PD, Woolhandler SJ, Himmelstein DU, Wolfe SM, Bor DH. Timing of new black box warnings and withdrawals for prescription medications. JAMA. 2002; 287:2215-2220. DOI | PubMed
- Law V, Knox C, Djoumbou Y, Jewison T, Guo AC, Liu Y, Maciejewski A, Arndt D, Wilson M, Neveu V, Tang A, Gabriel G, Ly C, Adamjee S, Dame ZT, Han B, Zhou Y, Wishart DS. DrugBank 4.0: shedding new light on drug metabolism. Nucleic Acids Research. 2014; 42:D1091-D1097. DOI | PubMed
- Lawrence KR, Adra M, Gillman PK. Serotonin toxicity associated with the use of linezolid: a review of postmarketing data. Clinical Infectious Diseases. 2006; 42:1578-1583. DOI | PubMed
- Lazarou J, Pomeranz BH, Corey PN. Incidence of adverse drug reactions in hospitalized patients: a meta-analysis of prospective studies. JAMA. 1998; 279:1200-1205. PubMed
- Lee MY, Hsiao PJ, Yang YH, Lin KD, Shin SJ. The association of pioglitazone and urinary tract disease in type 2 diabetic taiwanese: bladder Cancer and chronic kidney disease. PLoS One. 2014; 9DOI | PubMed
- Lewis JD, Ferrara A, Peng T, Hedderson M, Bilker WB, Quesenberry CP, Vaughn DJ, Nessel L, Selby J, Strom BL. Risk of bladder Cancer among diabetic patients treated with pioglitazone: interim report of a longitudinal cohort study. Diabetes Care. 2011; 34:916-922. DOI | PubMed
- Lincoff AM, Wolski K, Nicholls SJ, Nissen SE. Pioglitazone and risk of cardiovascular events in patients with type 2 diabetes mellitus: a meta-analysis of randomized trials. JAMA. 2007; 298:1180-1188. DOI | PubMed
- Lounkine E, Keiser MJ, Whitebread S, Mikhailov D, Hamon J, Jenkins JL, Lavan P, Weber E, Doak AK, Côté S, Shoichet BK, Urban L. Large-scale prediction and testing of drug activity on side-effect targets. Nature. 2012; 486:361-367. DOI | PubMed
- Mackey AC, Green L, Liang LC, Dinndorf P, Avigan M. Hepatosplenic T cell lymphoma associated with infliximab use in young patients treated for inflammatory bowel disease. Journal of Pediatric Gastroenterology and Nutrition. 2007; 44:265-267. DOI | PubMed
- Mannucci E, Monami M, Di Bari M, Lamanna C, Gori F, Gensini GF, Marchionni N. Cardiac safety profile of rosiglitazone. International Journal of Cardiology. 2010; 143:135-140. DOI | PubMed
- Mantel N, Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. Journal of the National Cancer Institute. 1959; 22:719-748. PubMed
- McAdams M, Staffa J, Dal Pan G. Estimating the extent of reporting to FDA: a case study of statin-associated rhabdomyolysis. Pharmacoepidemiology and Drug Safety. 2008; 17:229-239. DOI | PubMed
- MedicinesComplete. Indometacin: Martindale: The Complete Drug Reference. 2014. Publisher Full Text
- Moore N, Lecointre D, Noblet C, Mabille M. Frequency and cost of serious adverse drug reactions in a department of general medicine. British Journal of Clinical Pharmacology. 1998; 45:301-308. DOI | PubMed
- Muller PY, Dambach D, Gemzik B, Hartmann A, Ratcliffe S, Trendelenburg C, Urban L. Integrated risk assessment of suicidal ideation and behavior in drug development. Drug Discovery Today. 2015; 20:1135-1142. DOI | PubMed
- Muller PY, Milton MN. The determination and interpretation of the therapeutic index in drug development. Nature Reviews Drug Discovery. 2012; 11:751-761. DOI | PubMed
- Nelson SJ, Zeng K, Kilbourne J, Powell T, Moore R. Normalized names for clinical drugs: rxnorm at 6 years. Journal of the American Medical Informatics Association. 2011; 18:441-448. DOI | PubMed
- Nguyen TQ, Lewis JH. Sumatriptan-associated ischemic colitis: case report and review of the literature and FAERS. Drug Safety. 2014; 37:109-121. DOI | PubMed
- Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. New England Journal of Medicine. 2007; 356:2457-2471. DOI | PubMed
- O’Connell KA, Wood JJ, Wise RP, Lozier JN, Braun MM. Thromboembolic adverse events after use of recombinant human coagulation factor VIIa. JAMA. 2006; 295:293-298. DOI | PubMed
- Oleksiewicz MB, Southgate J, Iversen L, Egerod FL. Rat Urinary Bladder Carcinogenesis by Dual-Acting PPARα+γAgonists. PPAR Research. 2008; 2008:1-14. DOI
- Packer M, Carver JR, Rodeheffer RJ, Ivanhoe RJ, DiBianco R, Zeldis SM, Hendrix GH, Bommer WJ, Elkayam U, Kukin ML. Effect of oral milrinone on mortality in severe chronic heart failure. the PROMISE Study Research Group. The New England Journal of Medicine. 1991; 325:1468-1475. DOI | PubMed
- Piccinni C, Motola D, Marchesini G, Poluzzi E. Assessing the association of pioglitazone use and bladder Cancer through drug adverse event reporting. Diabetes Care. 2011; 34:1369-1371. DOI | PubMed
- R Core Team. 2013.
- RELX Intellectual Properties SA. PharmaPendium. 2016. Publisher Full Text
- Richelson E. Synaptic effects of antidepressants. Journal of Clinical Psychopharmacology. 1996; 16:1S-7. DOI | PubMed
- Rostom A, Dubé C, Lewin G, Tsertsvadze A, Barrowman N, Code C, Sampson M, Moher D, U.S. Preventive Services Task Force. Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors for primary prevention of colorectal Cancer: a systematic review prepared for the U.S. Preventive Services Task Force. Annals of Internal Medicine. 2007; 146:376-389. DOI | PubMed
- Rothman RB, Baumann MH, Savage JE, Rauser L, McBride A, Hufeisen SJ, Roth BL. Evidence for possible involvement of 5-HT(2B)receptors in the cardiac valvulopathy associated with fenfluramine and other serotonergic medications. Circulation. 2000; 102:2836-2841. DOI | PubMed
- Schondelmeyer SW, Purvis L. Rx Price Watch Report. 2014. Publisher Full Text
- Shively BK, Roldan CA, Gill EA, Najarian T, Loar SB. Prevalence and determinants of valvulopathy in patients treated with dexfenfluramine. Circulation. 1999; 100:2161-2167. DOI | PubMed
- Singhal S, Mehta J, Desikan R, Ayers D, Roberson P, Eddlemon P, Munshi N, Anaissie E, Wilson C, Dhodapkar M, Zeddis J, Barlogie B. Antitumor activity of thalidomide in refractory multiple myeloma. New England Journal of Medicine. 1999; 341:1565-1571. DOI | PubMed
- Smith U. Pioglitazone: mechanism of action. International Journal of Clinical Practice. Supplement. 2001;13-18. PubMed
- Solomon SD, McMurray JJ, Pfeffer MA, Wittes J, Fowler R, Finn P, Anderson WF, Zauber A, Hawk E, Bertagnolli M, Adenoma Prevention with Celecoxib (APC) Study Investigators. Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. New England Journal of Medicine. 2005; 352:1071-1080. DOI | PubMed
- Strom BL, Kimmel SE, Hennessy S. Textbook of Pharmacoepidemiology. Wiley-Blackwell; 2013.
- Szarfman A, Machado SG, O’Neill RT. Use of screening algorithms and computer systems to efficiently signal higher-than-expected combinations of drugs and events in the US FDA’s spontaneous reports database. Drug Safety. 2002; 25:381-392. DOI | PubMed
- Tatonetti NP, Ye PP, Daneshjou R, Altman RB. Data-driven prediction of drug effects and interactions. Science Translational Medicine. 2012; 4DOI | PubMed
- Thomson Reuters. Thomson Reuters Integrity. 2016. Publisher Full Text
- Thomson Scientific. World Drug Index. 2016. Publisher Full Text
- U.S. Food and Drug Administration. Antidepressant Use in Children, Adolescents, and Adults. 2016. Publisher Full Text
- U.S. Food and Drug Administration. COX-2 Selective (includes Bextra, Celebrex, and Vioxx) and Non-Selective Non-Steroidal Anti-Inflammatory Drugs (NSAIDs). 2016. Publisher Full Text
- U.S. Food and Drug Administration. openFDA. 2016. Publisher Full Text
- U.S. Food and Drug Administration. Questions and Answers on FDA’s Adverse Event Reporting System (FAERS). 2016. Publisher Full Text
- Roth BL, Lopez E, Patel S, Kroeze WK. The Multiplicity of Serotonin Receptors: Uselessly Diverse Molecules or an Embarrassment of Riches?. The Neuroscientist. 2000; 6:252-262. DOI
- Urban L, Maciejewski M, Lounkine E, Whitebread S, Jenkins JL, Hamon J, Fekete A, Muller PY. Translation of off-target effects: prediction of ADRs by integrated experimental and computational approach. Toxicol. Res.. 2014; 3:433-444. DOI
- Wang L, Jiang G, Li D, Liu H. Standardizing drug adverse event reporting data. Studies in Health Technology and Informatics. 2013; 192PubMed
- Wooster MB, Luzier AB. Reteplase: a new thrombolytic for the treatment of acute myocardial infarction. Annals of Pharmacotherapy. 1999; 33:318-324. DOI | PubMed
- Wysowski DK, Swartz L. Adverse drug event surveillance and drug withdrawals in the United States, 1969-2002: the importance of reporting suspected reactions. Archives of Internal Medicine. 2005; 165:1363-1369. DOI | PubMed
- Yates F. Contingency tables involving small numbers and the χ 2 test. Supplement to the Journal of the Royal Statistical Society. 1934; 1:217-235. DOI
- Zhu X, Wu S, Dahut WL, Parikh CR. Risks of proteinuria and hypertension with bevacizumab, an antibody against vascular endothelial growth factor: systematic review and meta-analysis. American Journal of Kidney Diseases. 2007; 49:186-193. DOI | PubMed
Fonte
Maciejewski M, Lounkine E, Whitebread S, Farmer P, DuMouchel W, et al. () Reverse translation of adverse event reports paves the way for de-risking preclinical off-targets. eLife 6e25818. https://doi.org/10.7554/eLife.25818





